荣昌生物纬迪西妥单抗(RC48)治疗尿路上皮癌获FDA突破性疗法认定
2020-09-22 医药魔方 医药魔方
近日,荣昌生物制药(烟台)股份有限公司(RemeGen)宣布自主研发的抗体-药物偶联(ADC)药物注射用纬迪西妥单抗(Disitamab vedotin,商品名:爱地希®,研究代号:RC48)获得美国
近日,荣昌生物制药(烟台)股份有限公司(RemeGen)宣布自主研发的抗体-药物偶联(ADC)药物注射用纬迪西妥单抗(Disitamab vedotin,商品名:爱地希?,研究代号:RC48)获得美国FDA的突破性疗法认定(Breakthrough Therapy Designation),适应症为HER2表达的(IHC 2+或IHC 3+)局部晚期或转移性尿路上皮癌患者的二线治疗。几个月前,该新药已被美国FDA授予快速通道认定。
突破性疗法源于《美国食品和药物管理局安全及创新法案》(FDASIA)规定,旨在加速开发及审查治疗严重或威胁生命疾病的新药。作为继快速通道、加速批准、优先审评以后美国FDA的又一个新药评审通道,获得突破性疗法认证的药物开发能得到包括FDA高层官员在内的更加密切的指导,保障在最短时间内为患者提供新的治疗选择。纬迪西妥单抗获得FDA突破性疗法认定,意味着该新药临床数据较现有治疗手段显示出显着疗效,将加速推进临床开发进程,早日满足患者需求。
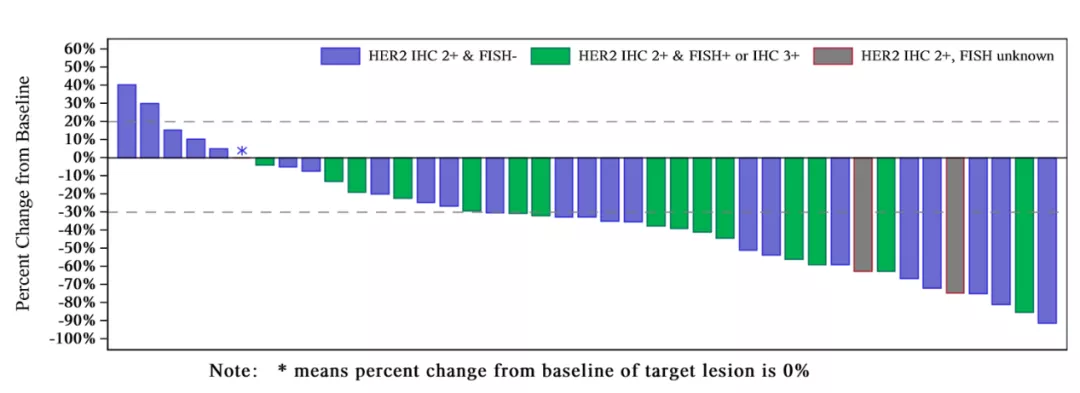
根据2019年美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)年会上公布的由北京大学肿瘤医院副院长郭军教授牵头的研究结果显示:在接受RC48-ADC治疗的43例二线及多线尿路上皮癌受试者中,确证客观缓解率(cORR)高达51.2%,疾病控制率(DCR)高达90.7%。目前,国内外尚未有治疗HER2阳性尿路上皮癌的药品获得上市批准。RC48的上述疗效结果实现了重大突破,不仅有效率高,而且大幅延长了一线治疗失败后患者的生存期,填补了巨大医学需求。
2020年8月27日,纬迪西妥单抗用于治疗局部晚期或转移性胃癌(包括胃食管结合部腺癌)患者的新药上市申请被中国国家药品监督管理局正式受理,并被纳入优先审评审批程序,这是在中国第一个提交新药上市申请的自主研发的ADC药物。该药物还在2018年9月获得美国FDA胃癌孤儿药资格认证,计划将于2021年在美国进行用于胃癌的II期临床试验。纬迪西妥单抗还在我国开展了HER2低表达乳腺癌III期临床研究,明年将在美国启动III期临床研究。2021年,纬迪西妥单抗将在国内开展多个适应症的II/III期临床研究。
根据美通社的预测显示,2025年ADC药物市场规模将达到99.3亿美元,复合年增长率有望将达到25.9%。由于ADC结构复杂,其工艺开发和单克隆抗体的传统生产涉及更高的技术难度和复杂性。荣昌生物拥有一个全面集成ADC开发和生产平台,涵盖ADC开发及生产的整个过程,拥有符合全球GMP要求的生产设施。
利用独有、强大的ADC平台,荣昌生物开发了一系列ADC药物,除了RC48已在中国申请新药上市外,RC88正在进行I期临床试验,RC108已申报临床并获国家药品监督管理局药品评审中心(CDE)受理,且今后几年每年都会有进入临床研究阶段的ADC候选药物,前景无限。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#突破性疗法#
0
#上皮癌#
65