以质控促规范,以规范促提升 | 肿瘤HRD检测前景可期
2024-05-11 测序中国 测序中国 发表于上海
通过HRD检测,临床可以更准确地识别PARP抑制剂等治疗的潜在获益人群,进而优化治疗决策,提高治疗效果。
同源重组修复缺陷(HRD)可导致细胞水平的DNA双链断裂损伤修复途径发生障碍,造成基因组和染色体不稳定,表现为对引起DNA断裂的铂类药物以及PARP抑制剂高度敏感。通过HRD检测,临床可以更准确地识别PARP抑制剂等治疗的潜在获益人群,进而优化治疗决策,提高治疗效果。
HRD作为恶性肿瘤常见的分子标记,在多种癌症中以不同频率发生,以卵巢癌、乳腺癌、前列腺癌和胰腺癌最为普遍,其中约有50%的卵巢癌患者为HRD阳性[1]。《同源重组修复缺陷临床检测与应用专家共识(2021版)》[2]指出,HRD已成为晚期卵巢癌患者临床应用PARP抑制剂的重要生物标志物,也对乳腺癌、前列腺癌等肿瘤的PARP抑制剂和铂类药物的临床用药具备一定的指导价值。
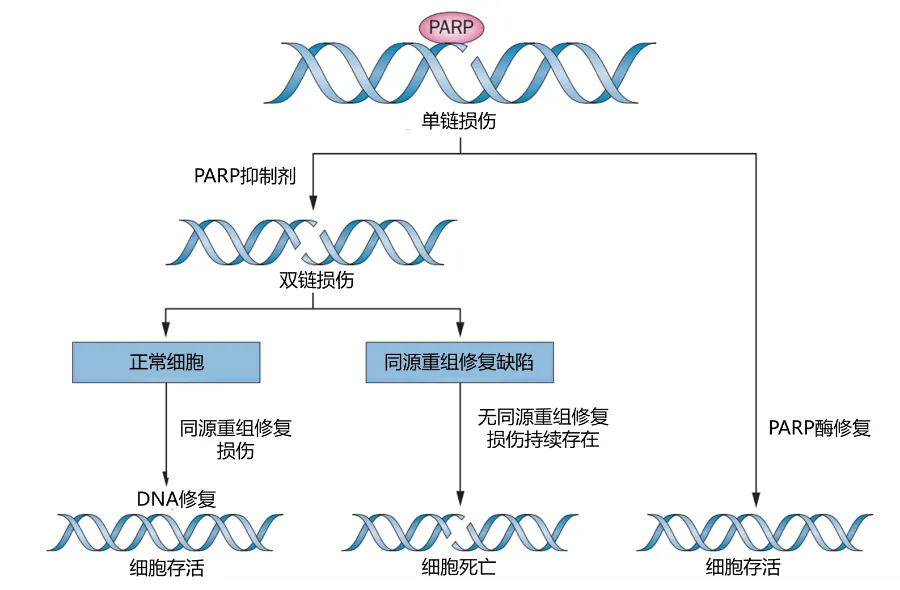
图:PARP抑制剂的作用机理[3]
规范进行时
HRD检测质控和标准化项目
PARP抑制剂等靶向药物促进了癌症的精准治疗,而HRD的准确检测是保证精准用药的前提之一。HRD检测的方法包括HRR相关基因突变检测、基因组瘢痕、突变谱系分析,但该检测目前国内外尚无统一标准,不同的HRD评估方法与评分算法是非等效的,在疗效预测效能、检测结果一致性等方面尚缺乏标准化验证方案,在临床应用与诊疗实施上仍存在挑战和局限性。HRD检测的质量控制及标准化建设已迫在眉睫。
为此,我国多家权威机构已经合作开展相关项目,逐步更新适合中国人群的HRD检测规范共识。
1 HRD一致性评估与质量控制项目
“HRD一致性评估与质量控制项目”由国家病理质控中心(PQCC)指导,由北京协和医院病理专家梁智勇、复旦大学附属肿瘤医院病理专家周晓燕牵头,联合业内企业等共同开展,旨在评估院内病理科、检验科、分子诊断中心各实验室HRD检测能力及一致性,促进和规范国内HRD检测。
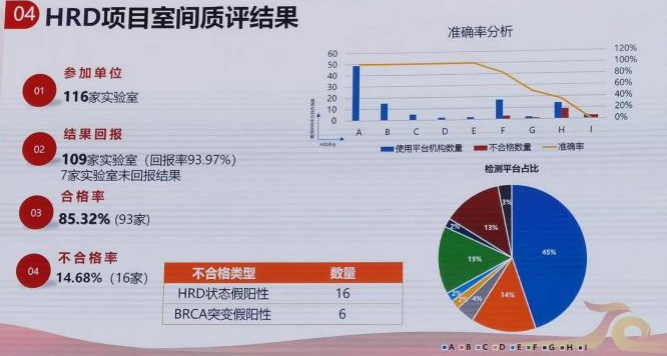
“HRD一致性评估与质量控制项目”于2022年10月启动,由各医院院内临床实验室对标定的样本进行HRD检测分析,项目专家小组进行检测结果评估。该项目于近期公布了2023年HRD室间质评的初步结果:共有116家实验室参与,其中109家实验室进行了结果回报;参评单位采用不同的NGS平台和Panel进行检测,总体合格率为85.32%,不合格率14.68%;不合格类型包括HRD状态假阳性(16家)和BRCA突变假阳性(6家),不同NGS平台的HRD检测准确率存在一定差异,有待进一步优化和完善。
2 中国HRD标准化项目
“中国HRD标准化项目”由国家癌症中心/中国医学科学院肿瘤医院、中国食品药品检定研究院、中国抗癌协会病理专委会、北京肿瘤学会病理专委会共同发起,旨在形成泛癌种HRD标准化的指导性文件,规范临检机构的HRD检测,推动临床落地应用。
该项目于2021年11月启动,分三个阶段实施[4]:第I阶段围绕HRD的使用,建立HRD标准化共识。第II阶段项目分为IIa/b(细胞系参考品评价HRD检测方法的准确性)和IIc(回顾性卵巢癌临床样本验证方法的准确性、疗效)两个方向展开。第III阶段将基于1-2个回顾性/前瞻性、多中心、多臂、开放标签临床研究,探索矫正后HRD检测是否可在卵巢癌中复现优势获益人群。
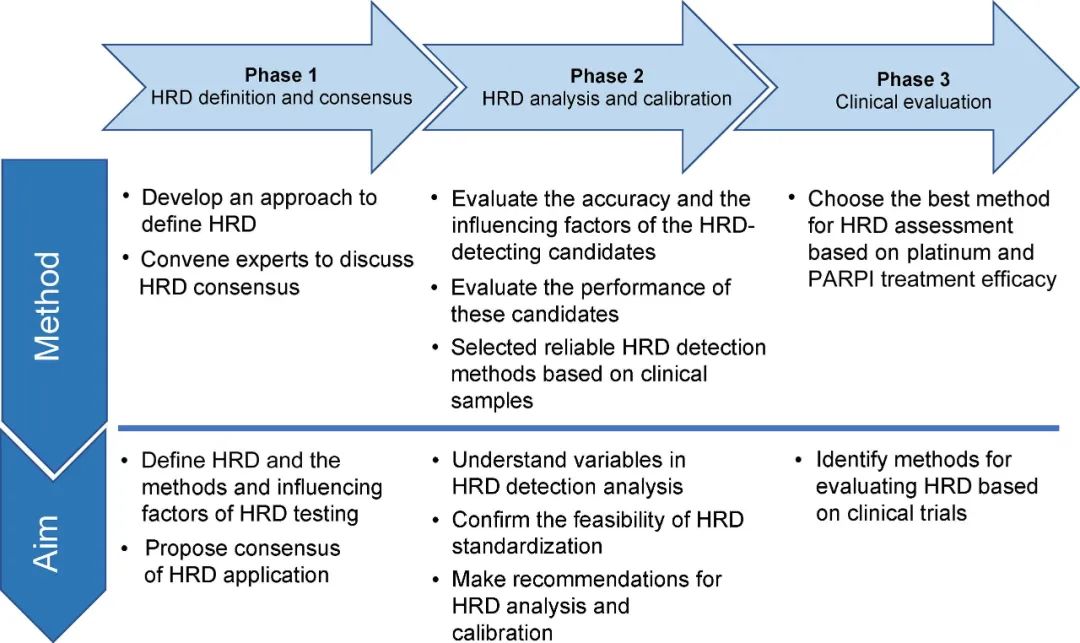
图:中国HRD标准化项目流程图[4]
2023年2月,“中国HRD标准化项目”第一阶段成果发表在Genomics Proteomics & Bioinformatics,回顾了HRD的定义、评估方法、临床应用、检测挑战以及评估方法的优化和标准化,为HRD评估的标准化提供理论依据[4]。文章提出目前涉及HRD评估的优化和统一有三个问题亟须解决:确定HRD评估的最佳测序方法,进一步优化最适合检测HRD的样本类型,制定中国患者HRD评估临床验证切实可行的方法和标准。
对HRD的精确评估,将进一步改善肿瘤诊断和治疗,使越来越多的患者受益。我们期待HRD检测规范化、标准化的相关指导性文件发布。
百花齐放
国内外HRD检测现状
目前,全球范围内仅2款基于西方人群设计的HRD检测产品获得FDA批准:Myriad myChoice® CDx和FoundationFocus™ CDx BRCA LOH Assay。虽然我国尚无HRD商业化检测产品获得中国国家药监局(NMPA)批准,但国内已有可及的验证合格的HRD试剂盒。
同时,各大基因检测公司也在积极布局HRD产品的开发与申报。
1 国外
Myriad myChoice® CDx和FoundationFocus™ CDx BRCA LOH Assay已经被FDA批准作为HRD阳性患者的伴随诊断或辅助诊断。HRD可导致细胞基因组高度不稳定,在整个基因组上产生的变异特征称之为基因组瘢痕(GS),GS的表现形式包括:杂合性缺失(LOH)、端粒等位基因不平衡(TAI)和大片端迁移(LST)。以上两款获批的产品均是基于SNPs的“基因组瘢痕”的基础理论进行HRD检测。
Myriad myChoice® CDx检测包含BRCA1/2基因编码区和54091个SNPs,计算 LOH、TAI和LST的综合评分,HRD状态判读标准为:BRCA致病性突变阳性或HRD评分≥42分,即为HRD阳性;若分值<42分,且BRCA为野生型,则为HRD阴性。
FoundationFocus™ CDx BRCA LOH 检测包括2个方面:肿瘤BRCA突变状态和LOH。通过覆盖22条染色体上324个基因的3500个SNPs,计算发生LOH的片段占整个基因组的比例。若tBRCA致病性突变阳性,无论LOH比率多少均为HRD阳性;若tBRCA致病性突变阴性,高LOH(LOH比率≥16%)的患者判定为HRD阳性;BRCA为野生型且LOH比率<16%判定为HRD阴性[2]。
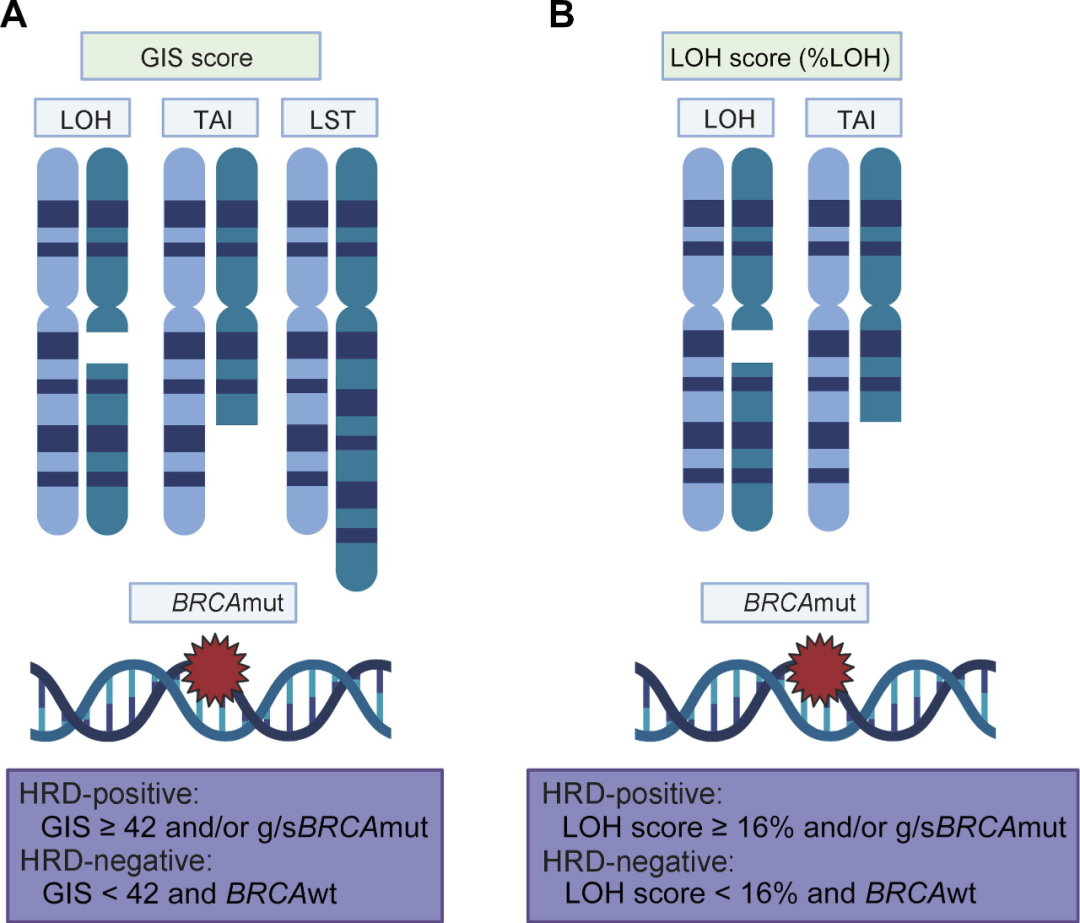
图:基于基因组疤痕的HRD分析[4] 。A为Myriad Choice® CDx;B为FoundationFocus™ CDx BRCA LOH
由此可见,以上两个FDA批准的HRD产品的检测范围和阳性定义均有差异,且是基于西方人群开发,尚缺乏中国人群的研究数据。
2 国内
燃石医学
2020年,燃石医学引入了Myriad的HRD基因组不稳定性评分算法,并于2021年上市了myChoice™ HRD Plus,在早期myChoice™的基础上增加了包括HRR、MSI等108个相关基因,为临床治疗提供更多参考信息,为患者使用PARP抑制剂治疗提供可靠的指导。myChoice™ HRD Plus适用于亚洲人群检测,性能验证数据显示,myChoice™ HRD Plus检测的准确性与Myriad检测高度一致[5]。
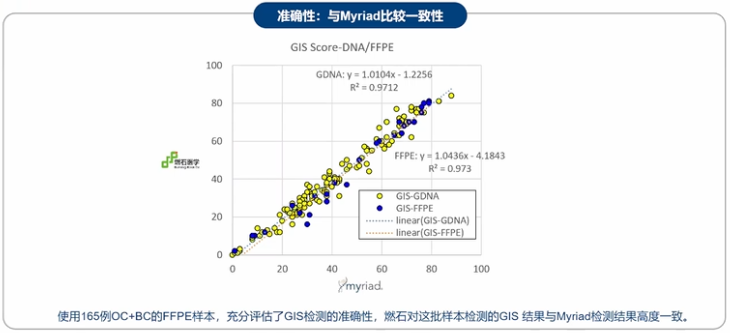
图:myChoice™ HRD Plus检测性能验证数据[5]
艾德生物
艾德生物基于全球首创的核心专利基因组不稳定性状态评估方法(GSS®算法),筛选了同时兼顾东西方人群的2.4万个代表性SNP位点,开发出AmoyDx® HRD Focus Panel。同时,艾德生物还通过引入对肿瘤细胞纯度和倍型的校正,提高计算结果的准确性;且基于海量的基因组测序数据,补充了我国人群杂合度较高的位点,可满足卵巢癌、前列腺癌、胰腺癌、乳腺癌等癌种PARP抑制剂的用药指导需求[6]。
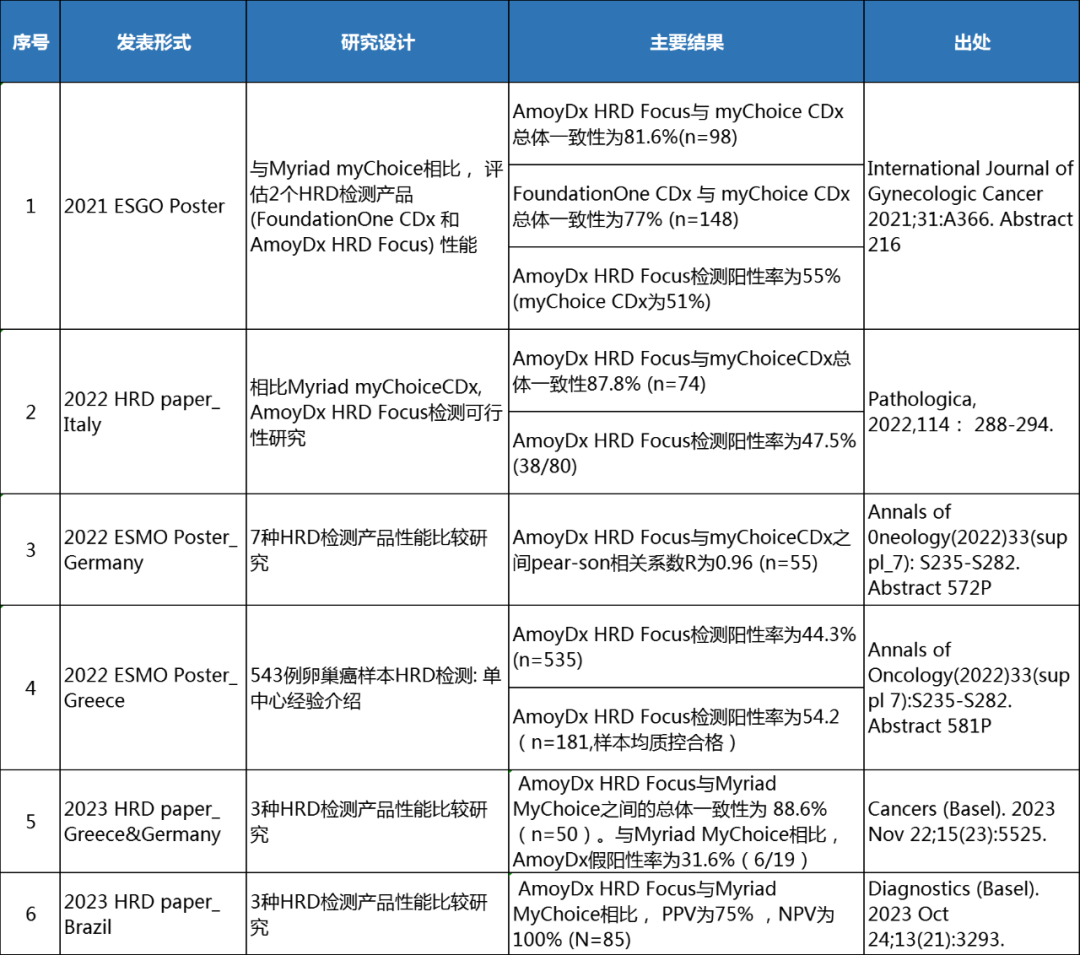
截止到目前,全球已有多个国家的中心实验室分别对艾德生物的HRD检测产品与Myriad myChoice CDx的一致性进行了独立性能评估,均得到了高度一致的结果[7]。最新数据显示,AmoyDx® HRD Focus Panel与Myriad MyChoice CDx的总体一致性达88.6%[8]。
此外,艾德生物的HRD产品已与奥拉帕利的原研药企阿斯利康签署伴随诊断合作协议,通过推动HRD检测的临床应用,可从奥拉帕利治疗获益的卵巢癌患者人群将进一步扩大[9]。
表:艾德生物HRD检测的一致性评估汇总[7-8]
世和基因
2020年,世和基因推出了盼汝胜GeneseeqPrime® HRD检测,该产品于2023年获得欧盟CE认证。GeneseeqPrime® HRD依托中国人群大数据平台开发,针对中国人SNPs位点进行探针设计,均匀覆盖全基因组,可综合评估LOH、TAI和LST判断基因组瘢痕评分。2022年发表在BMC Cancer的研究成果显示,采用GeneseeqPrime® HRD检测中国大人群样本的HRD状态,可全面揭示HRD状态、BRCA1/2、其他HRR基因和伴发基因分子特征,证实了HRD状态在中国卵巢癌患者铂类敏感性的预测价值[10]。
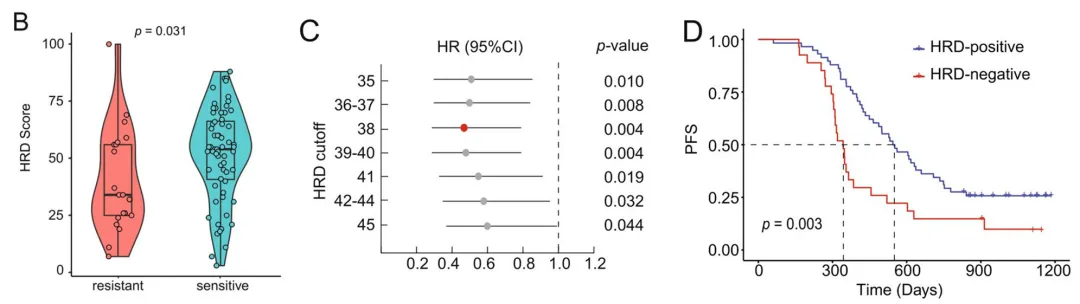
图:HRD状态(GeneseeqPrime® HRD检测)与患者生存及预后预测因素分析[10]。
华大基因
华大基因于2020年推出了HRD检测技术(GSA)产品:华然迪® HRD score检测。HRD score可综合评估LOH、TAI和LST,通过检测数十万个基因组SNP位点的突变情况,全面评估HRD状态。复旦大学附属肿瘤医院吴小华教授团队与华大基因合作,开展了国内首个卵巢癌患者HRD状态与含铂化疗相关性的前瞻性研究,发现基于HRD score检测的结果可精准预测我国卵巢癌患者铂化疗敏感性,该成果于2023年发表在Journal of Ovarian Research[11]。
华大基因独立开发的GSA算法可以通过NGS计算肿瘤样本的纯度和倍性,反映肿瘤样本的基因组不稳定性程度和大规模拷贝数变异。临床样本结果显示,GSA算法计算的综合HRD评分的准确度和灵敏度均表现良好,与Affymetrix OncoScan™检测相比准确率为98%,与BRCA1/2缺陷状态相比灵敏度为95.2%[12]。
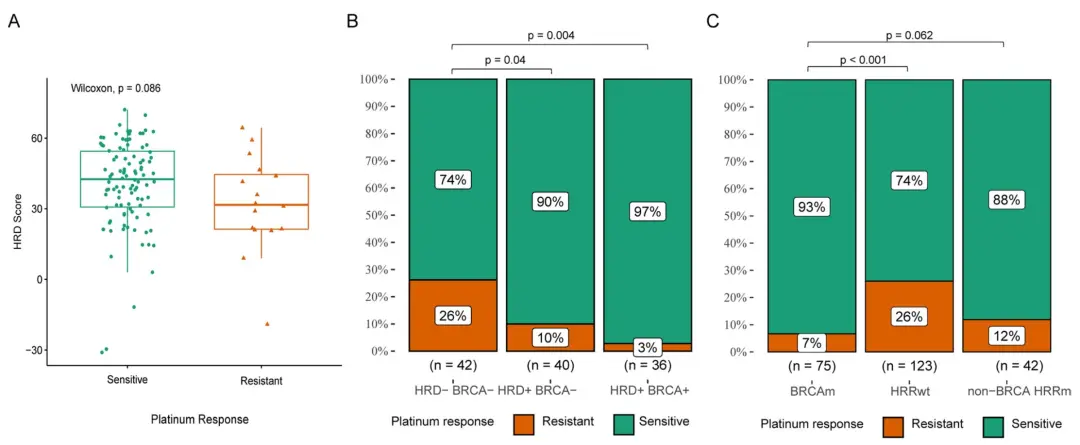
图:HRD评分(华然迪® HRD score检测)、HRR突变和HRD状态与铂化疗疗效的关系[11]
吉因加
吉因加HRD检测相关产品Onco1021+HRD覆盖包含BRCA1/2基因在内的36个HRR基因,同时包含HRD指标,全面指导卵巢癌及其它实体瘤PARP抑制剂获益人群的筛选。据吉因加公布的内部数据显示,在BRCA1/2缺陷样本中,Onco1021+HRD检出的HRD阳性率为95%,与Myriad MyChoice CDx评价标准一致,与用WES方法评估的HRD评分具有较好一致性[13]。
纳昂达
纳昂达于2021年推出了HRD分析产品HiSNP Ultra Panel v1.0(分析52592个SNP位点)。在HRD检测方面,HiSNP Ultra Panel与WGS具有相当的一致性,且略优于WES Panel[14]。
普瑞基准
普瑞基准推出的昂可迪Pro检测可作为EOC-HRD研究、NANT大型临床样本研究中的HRD检测方法,用于预测卵巢癌一线化疗和PARP抑制剂维持治疗PFS和OS,且昂可迪Pro检测的HRD可作为中国晚期卵巢癌患者PARP抑制剂用药的参考标志物[15]。
Illumina
Illumina TruSight Oncology 500 HRD检测已于2022年在我国上市,其引入了Myriad基因组不稳定性评分专利算法。经验证,与Myriad HRD检测结果高度一致(总体一致性达到96.0%)[16]。
表:国内多个自主研发的HRD检测产品性能与临床验证数据汇总
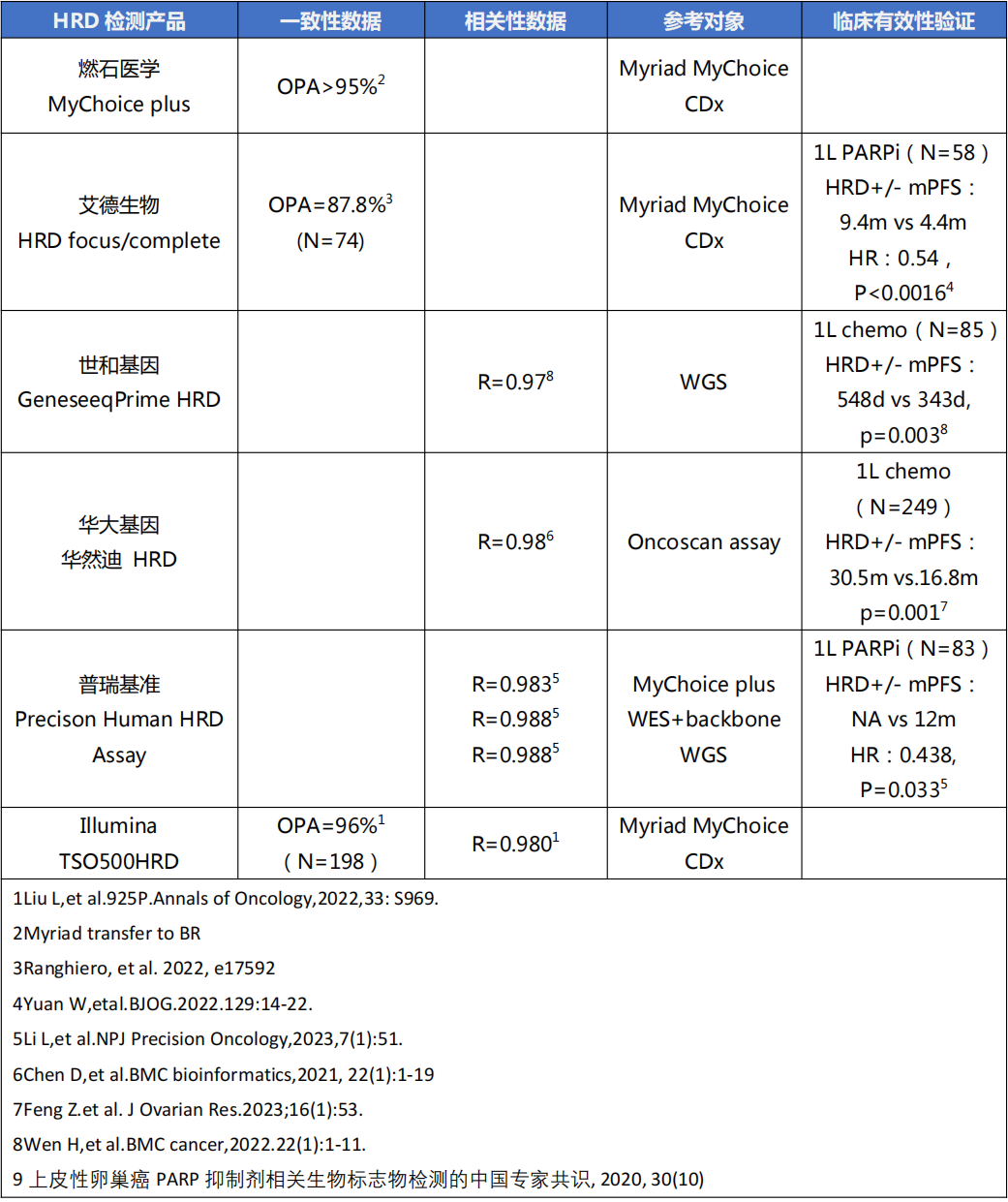
我国多家基因检测机构已经基于中国人群数据进行了产品研发和验证,也与FDA获批产品保持较好的一致性,并在临床应用研究中取得了初步成果。但各家采用的方法和算法、阈值尚不统一,验证的人群数量有限,放大到中国大基数人群中的研究结果尚未可知。
发布在即
《卵巢癌分子病理检测临床应用指南》
近期,奥拉帕利新适应症“靶向药奥拉帕利联合贝伐珠单抗一线维持治疗HRD阳性晚期卵巢癌”已正式纳入《国家基本医疗保险和工伤保险药品目录》,有望为更多HRD阳性的卵巢癌患者带来福音,这也对HRD的规范检测提出了更高、更迫切的要求。
即将发布的《卵巢癌分子病理检测临床应用指南》为HRD检测的规范应用带来了新的指导方向。2023年12月,复旦大学附属肿瘤医院病理科周晓燕教授首度介绍了该指南内容[17]。指南强调,约一半的卵巢癌患者为HRD阳性,可能从PARP抑制剂中获益,因此临床HRD检测尤为重要。目前已有多个PARP抑制剂获批用于卵巢癌的治疗,明确PARP抑制剂在HRD综合状态阳性患者中具有显著的抗肿瘤活性,成为晚期卵巢癌一线及铂敏感复发化疗有效后维持治疗的方案。BRCA/HRD检测对卵巢癌维持治疗药物选择具有重要意义。
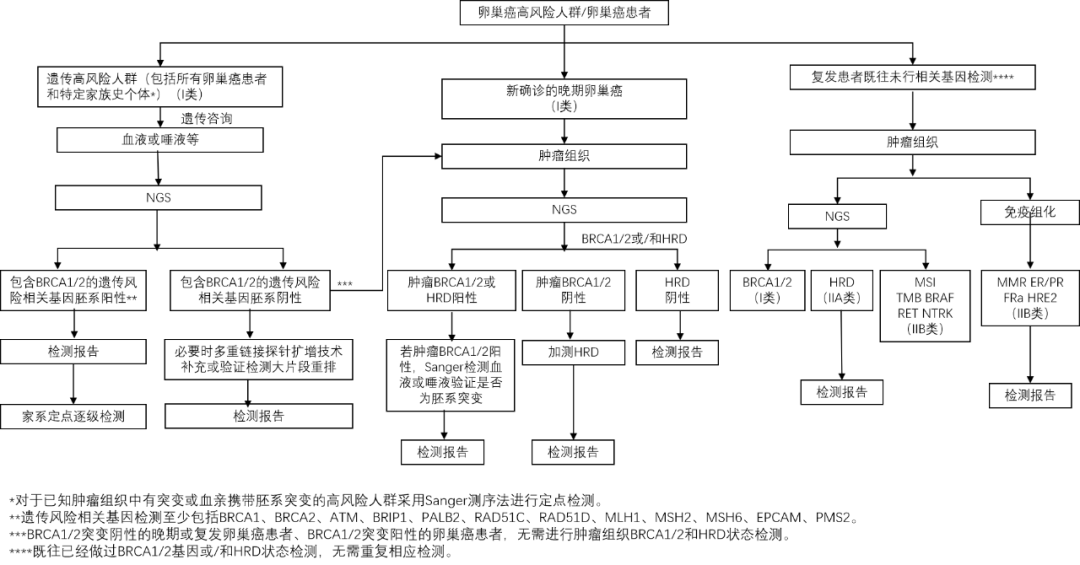
图:卵巢癌分子病理检测策略与路径图[17]
作为打通分子病理-临床端的指南,《卵巢癌分子病理检测临床应用指南》的发布将为我国广大科研和医务工作者带来更切实的临床解决方案,帮助我国卵巢癌HRD检测规范化水平进一步提高。
展 望
基于临床的迫切需求,我国正积极建立HRD检测规范或共识,努力为开展HRD检测提供更多理论和实践依据。
《同源重组修复缺陷临床检测与应用专家共识(2021版)》规范了HRD检测的设计和报告细节,建立起HRD检测临床应用的规范化指导文件;“HRD一致性评估与质量控制”项目可帮助了解我国院内HRD检测现状,促进HRD产品遵循高质量标准研发;“中国HRD标准化项目”精准定义HRD,并以前瞻性视角关注HRD标准的建立。一系列指南共识与质控研究的发布,将为我国HRD检测及肿瘤精准诊疗带来规范性参考。
我们相信,HRD检测规范化之路虽然充满了挑战,但在众多领域专家的共同努力之下,必将前景可期!
参考资料:
[1] 中国抗癌协会妇科肿瘤专业委员会, & 中华医学会病理学分会. (2020). 上皮性卵巢癌PARP抑制剂相关生物标志物检测的中国专家共识. 中国癌症杂志, 30(10), 841-848.
[2]《同源重组修复缺陷临床检测与应用专家共识(2021版)》,中国癌症防治杂志,2021年8月第13卷第4期
[3]Sonnenblick A, de Azambuja E, Azim HA Jr, Piccart M. An update on PARP inhibitors—moving to the adjuvant setting. Nat Rev Clin Oncol. 2015;12(1):27-41.
[4]Patient Assessment and Therapy Planning Based on Homologous Recombination Repair Deficiency. Genomics Proteomics Bioinformatics. Volume 21, Issue 5, October 2023, Pages 962–975, https://doi.org/10.1016/j.gpb.2023.02.004
[5]https://mp.weixin.qq.com/s/zM8PX35Xp_8prgO9FCyMsw
[6]https://mp.weixin.qq.com/s/CUnPAybOtQHLKT2g10CVKg
[7]https://t.10jqka.com.cn/pid_265208801.shtml
[8] Elena Fountzilas, Kyriaki Papadopoulou, Thomas Chatzikonstantinou, et al. Concordance between Three Homologous Recombination Deficiency (HRD) Assays in Patients with High-Grade Epithelial Ovarian Cancer. Cancers 2023, 15(23), 5525; https://doi.org/10.3390/cancers15235525
[9]https://www.amoydx.com/newDetail/137
[10] Wen H, Feng Z, Ma Y T, et al. Homologous recombination deficiency in diverse cancer types and its correlation with platinum chemotherapy efficiency in ovarian cancer[J]. BMC Cancer, 2022
[11] Homologous recombination deficiency status predicts response to platinum-based chemotherapy in Chinese patients with high-grade serous ovarian carcinoma. J Ovarian Res, 2023
[12] GSA: an independent development algorithm for calling copy number and detecting homologous recombination deficiency (HRD) from target capture sequencing. BMC Bioinformatics 22, 562 (2021)
[13]https://mp.weixin.qq.com/s/yWjYn7KHzwPZVHZsY32RzQ
[14] Improved detection of homologous recombination deficiency in Chinese patients with ovarian cancer: a novel non-exonic single-nucleotide polymorphism (SNP)-based next-generation sequencing (NGS) panel. Molecular Oncology,2023
[15]https://mp.weixin.qq.com/s/rZM6Bf3cMlz62U_i1JCzaw
[16] Analytical Performance of A Next-generation Sequencing (NGS) Assay Kit for Assessing Homologous Recombination Deficiency (HRD) from Solid Tumor Samples. 2022ESMO.
[17]https://mp.weixin.qq.com/s/zDJGBeC0SbM_e344wZRuYA
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#HRD检测# #同源重组修复缺陷#
94