【衡道丨病例】微腺体腺病(Microglandular Adenosis,MGA)如何诊断?
2024-08-15 衡道病理 衡道病理 发表于上海
今天就由上海交通大学医学院附属瑞金医院张学敏老师为大家分享微腺体腺病的病理诊断要点。
定义
微腺体腺病是一种由单层上皮细胞组成的随意增殖的圆形小腺体组成,没有肌上皮细胞。
临床表现
1.通常因其他原因的乳腺活检偶然发现;
2.发生于微腺体腺病的癌,可触及肿块;
3.良性,但具有恶性潜能。
组织形态学
结构
1.腺管呈小圆形,管腔开放,不成角,内含致密的嗜酸性胶样物
2.随意生长,不以小叶为中心,浸润周围乳腺和脂肪组织
细胞
1.单层立方上皮
2.胞浆嗜双色
3.核小而圆,染色质细腻,核仁不明显
4.缺乏肌上皮细胞,存在基底膜
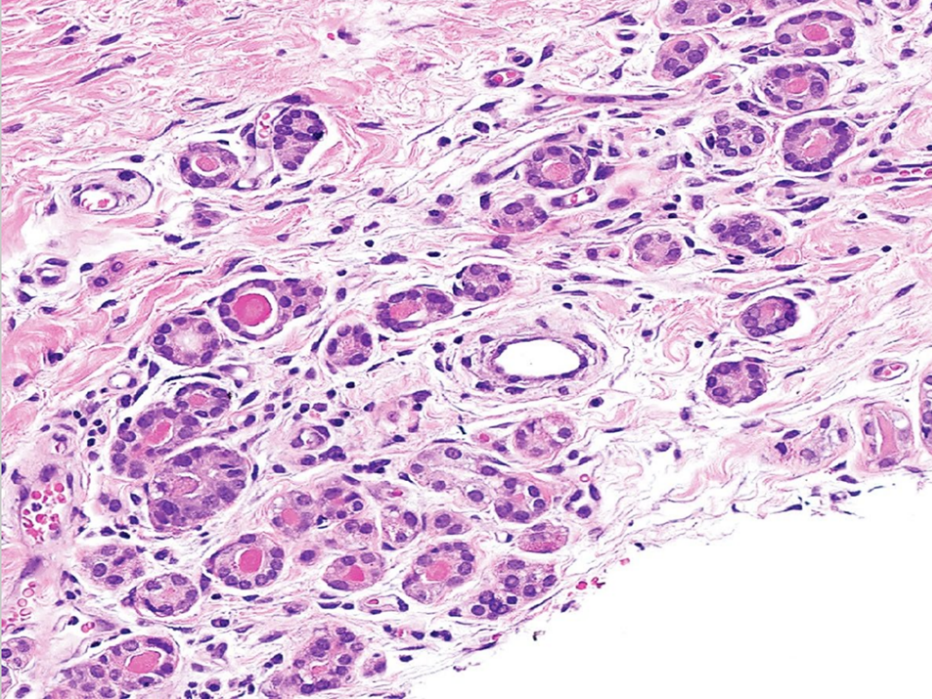
图1:微腺体腺病。小的圆形腺体在纤维间质中随意分布,缺乏小叶中心性生长模式,腺体由一层立方细胞排列,细胞核染色质细腻
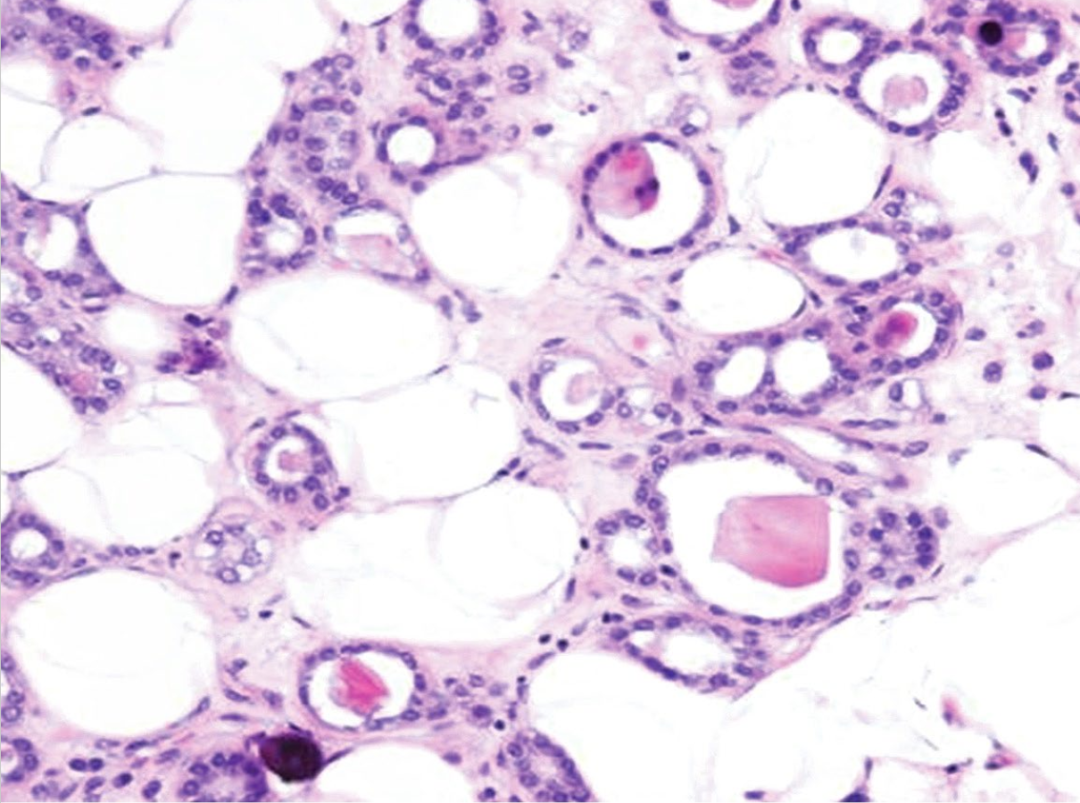
图2:微腺体腺病。管腔内有嗜酸性分泌物
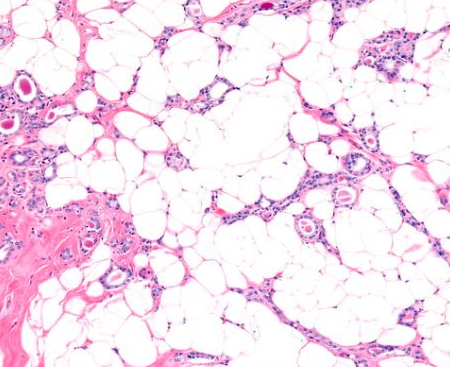
图3:微腺体腺病。腺体向周围脂肪组织呈浸润性的生长
免疫组化
1.通常表达细胞角蛋白、S100、组织蛋白酶D、EGFR;
2.EMA、ER、PR、Her-2阴性表达;
3.肌上皮标记物阴性表达。
特殊染色
1.Collagen IV和层黏连蛋白示基底膜存在
2.PAS染色可示管腔内分泌物及基底膜
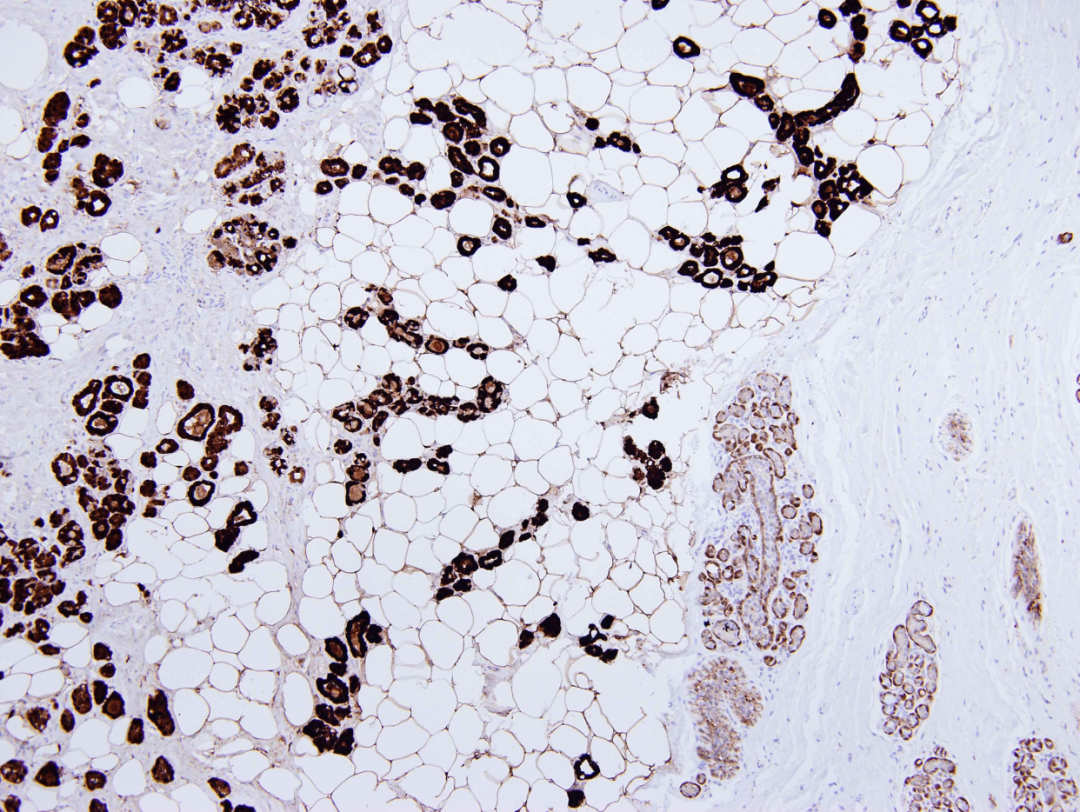
图4:微腺体腺病。腺体 S100核和浆弥漫强阳性。正常小叶和导管仅显示肌上皮染色,脂肪细胞也呈阳性
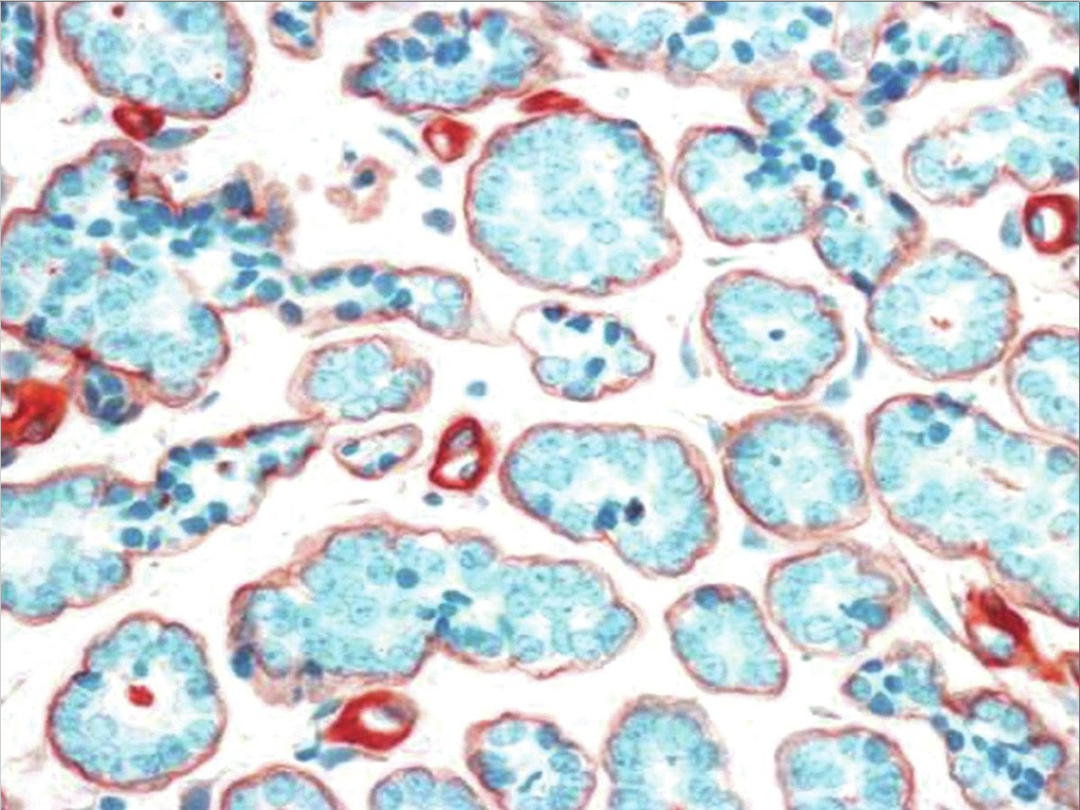
图5:微腺体腺病。IV型胶原染色显示腺体周围完整的基底膜
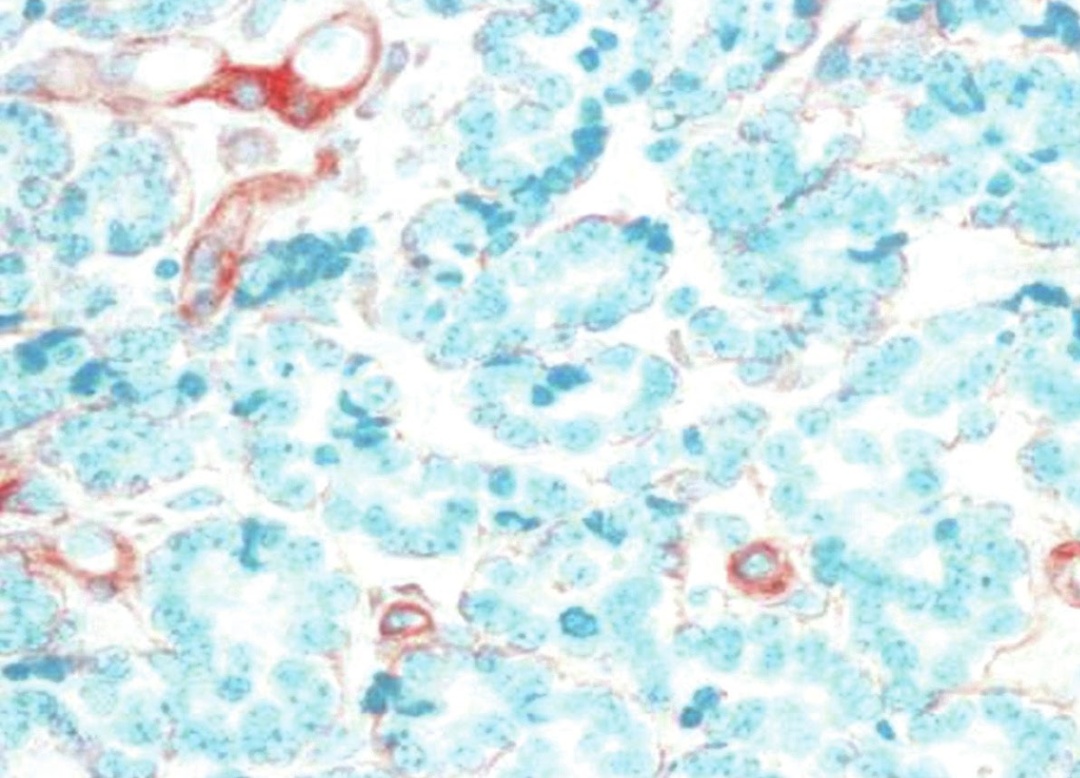
图6:微腺体腺病。SMA的免疫组织化学染色显示肌上皮缺失
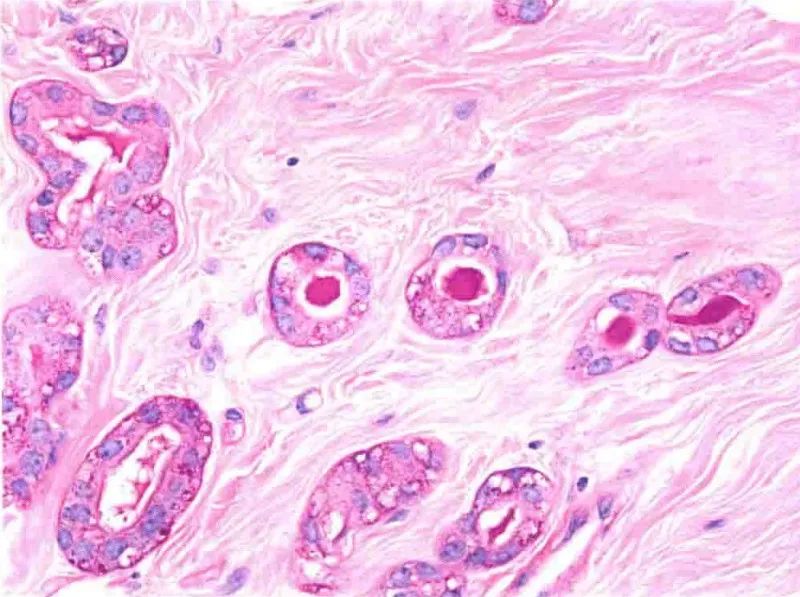
图7:微腺体腺病。PAS染色显示腺腔内分泌物阳性
鉴别诊断
1、高分化浸润性导管癌
-
无基底膜
-
细胞明显异型性,核分裂象多
-
无管腔分泌物
-
伴随促结缔组织增生性间质
-
分化好的浸润性癌通常表达ER、PR、EMA
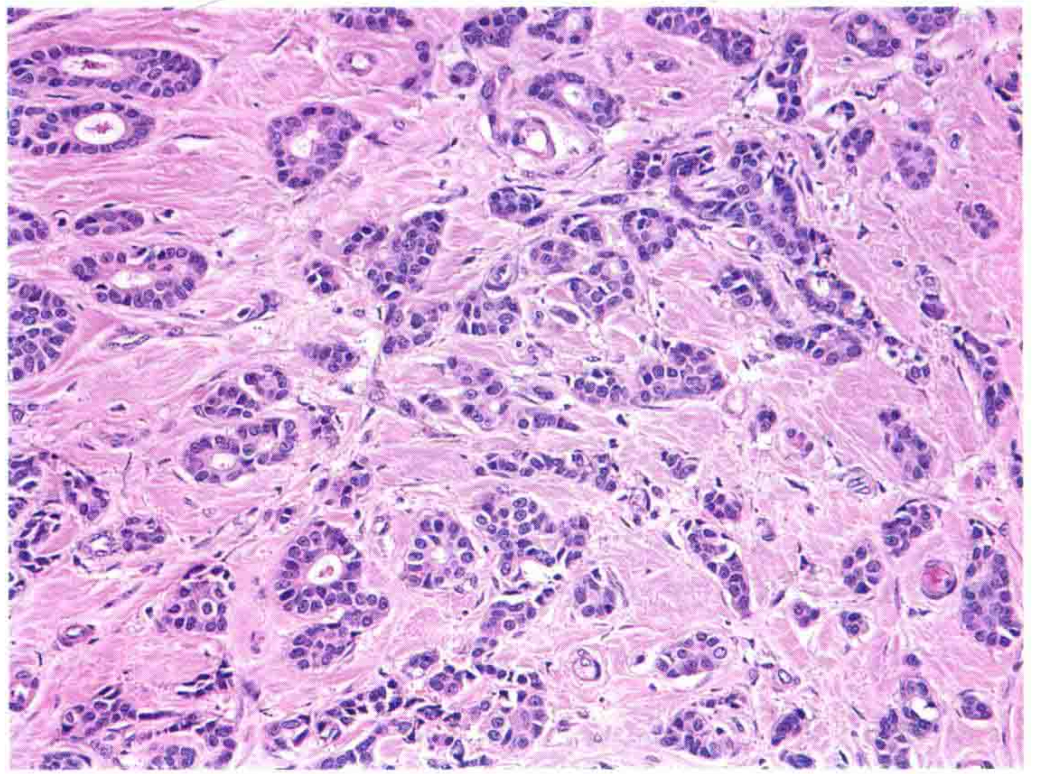
图8:高分化浸润性导管癌
2、小管癌
-
预后非常好的特殊类型乳腺癌
-
由衬附单层细胞、具有开放性管腔的高分化小管构成(>90%)
-
低级别浸润性癌,腺管常呈星芒状浸润
-
管腔大小不一,成角,核仁不明显,缺少核分裂象
-
缺少肌上皮及基底膜
-
复层、细胞异型性明显和核分裂象高不能诊断为小管癌!
-
ER、PR、EMA常阳性,S100阴性
-
伴随间质促纤维结缔组织反应
-
HER2罕见阳性
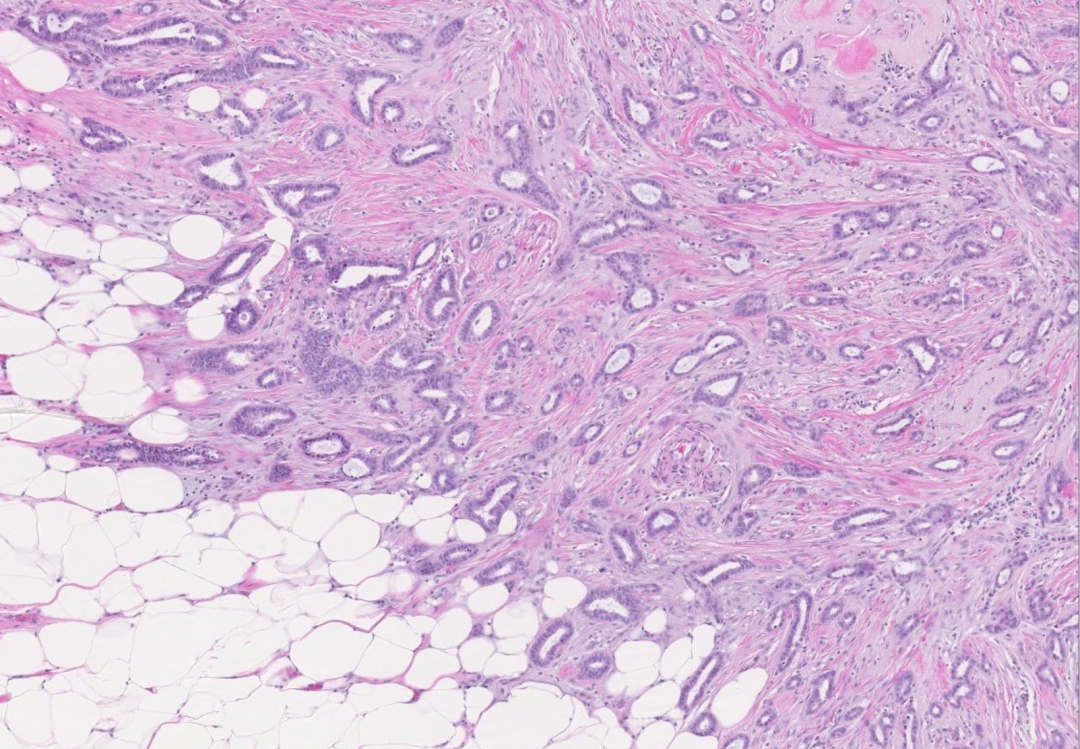
图9:小管癌。有开放腔的圆形、成角的小管无规律的分布,内衬单层上皮细胞浸润纤维间质内。
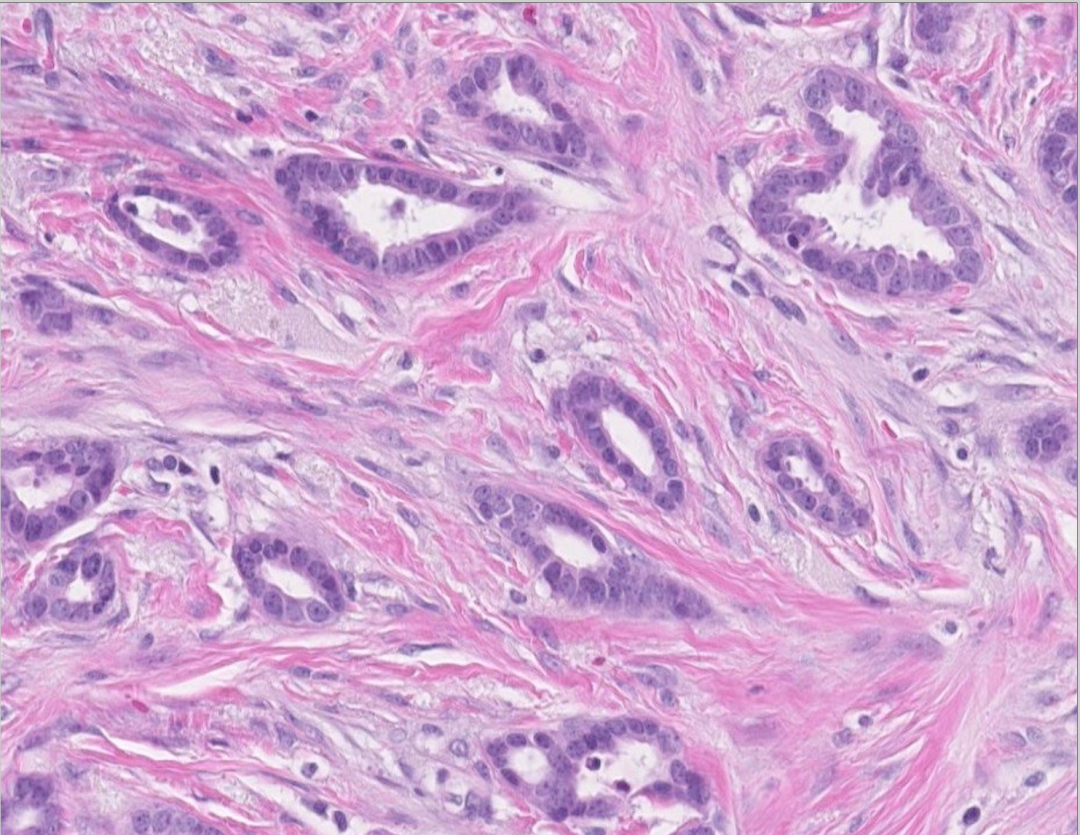
图10:小管癌。水滴状小管内衬的无异型的细胞,伴随促纤维结缔组织的间质
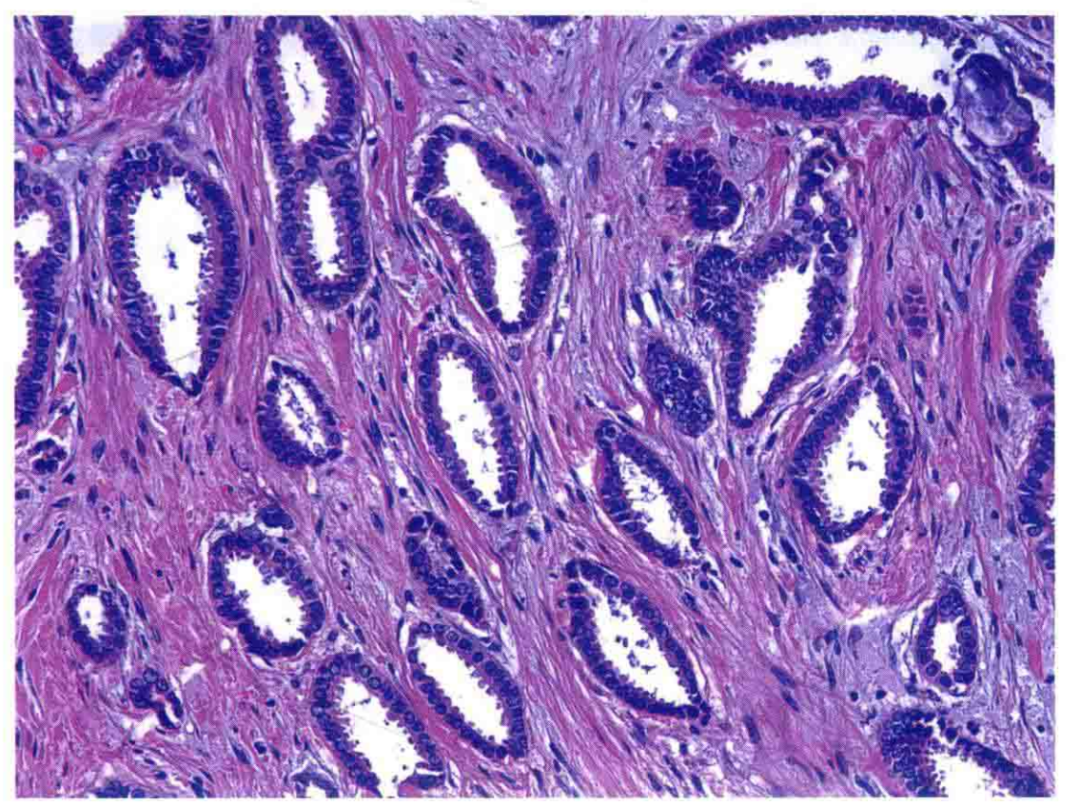
图11:小管癌。形成小管的细胞可见顶泌胞质突起,细胞核呈低级别
3、硬化性腺病
-
呈小叶中心性生长模式
-
间质含有致密的胶原
-
小腺泡/腺管常被间质胶原压缩或扭曲(中央最明显)
-
上皮细胞缺乏异型性
-
存在肌上皮和基底膜
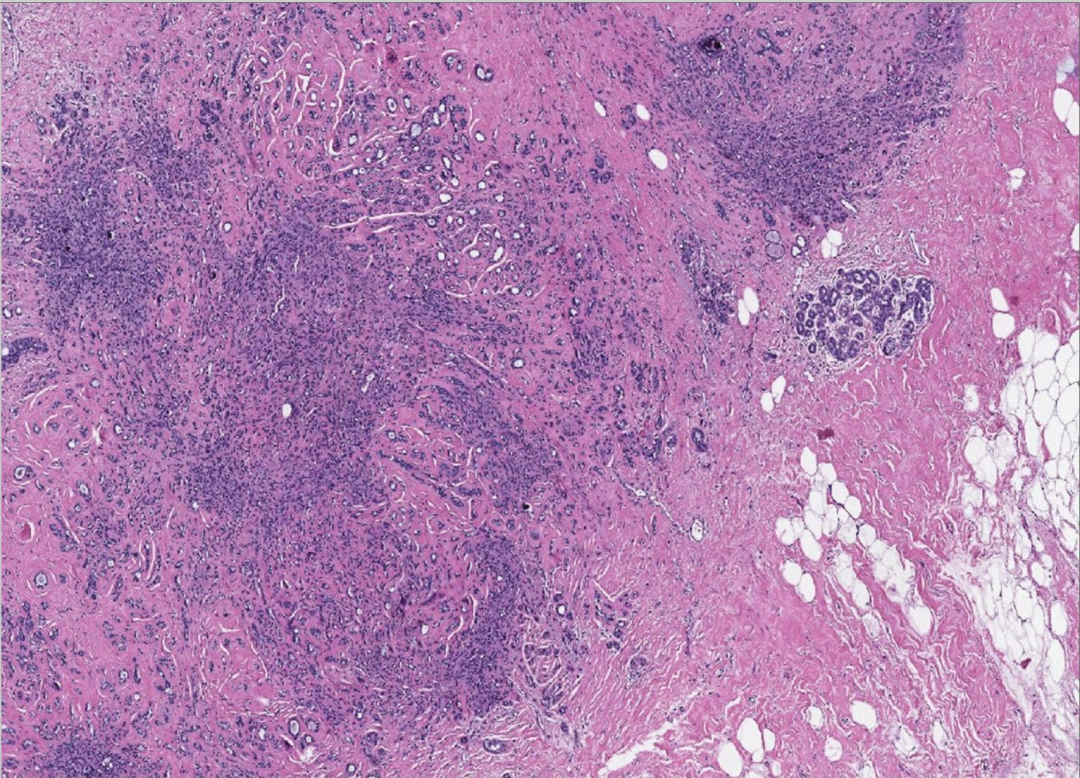
图12:硬化性腺病。低倍镜下显示具有圆形边缘的小叶结构。胶原增生导致小管被压缩,甚至可能无腺腔,呈实性或索状,类似浸润性癌的生长模式
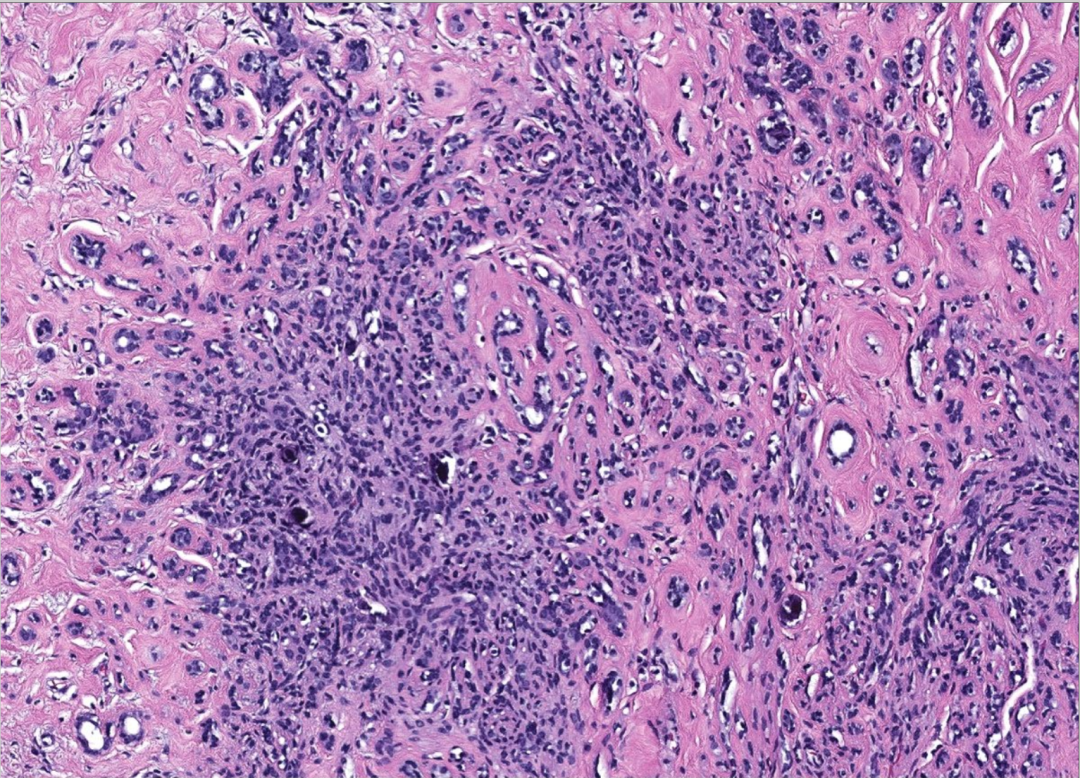
图13:硬化性腺病。腺腔常被小叶内纤维间质化、压缩或闭塞。常伴微钙化
4、腺泡细胞癌
-
罕见,中度侵袭性的三阴性乳腺癌
-
胞质常呈嗜酸和嗜碱性颗粒,类似小肠潘氏细胞;胞浆也可透明
-
细胞核圆形,偏位,一般为低级别
-
S100阳性,ER、PR、Her2阴性
-
EMA、溶菌酶、α-抗糜蛋白酶、淀粉酶阳性
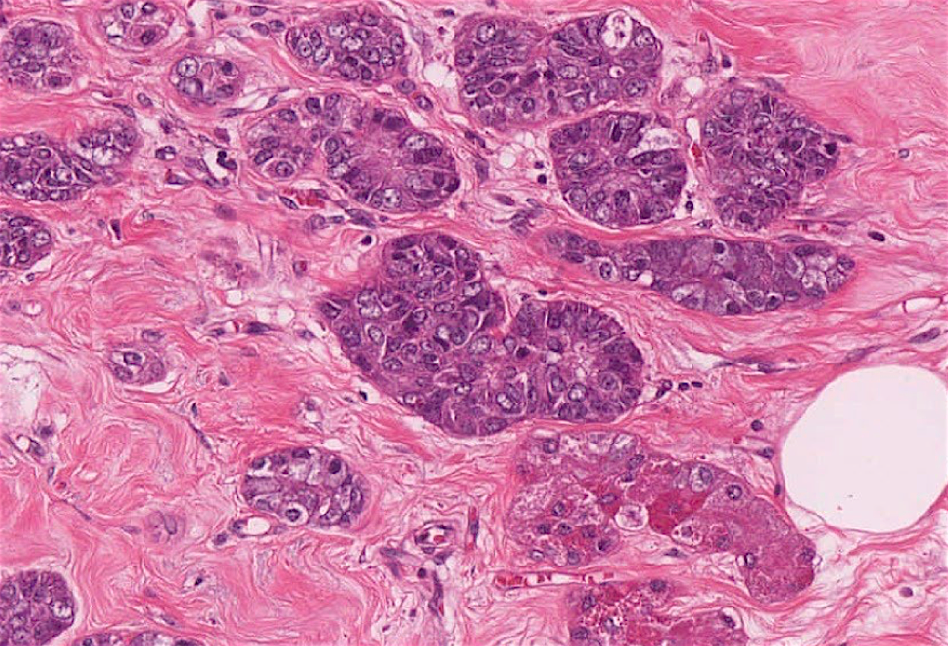
图14:腺泡细胞癌。肿瘤细胞有不典型性,胞浆呈颗粒状,部分细胞可见粗大的嗜酸性颗粒
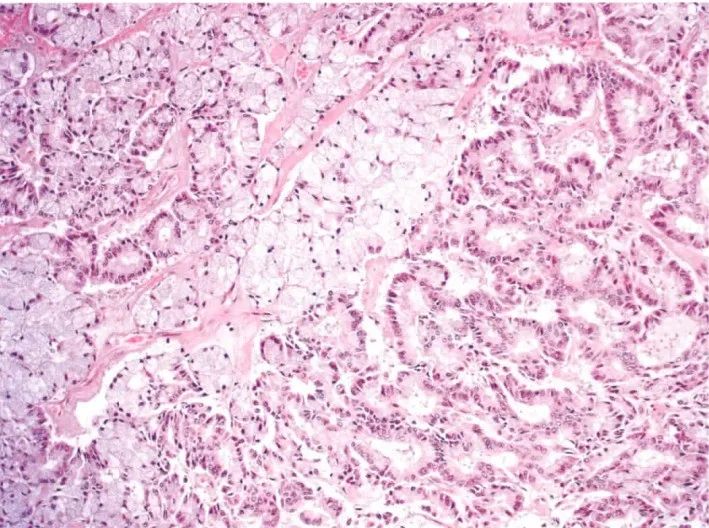
图15:腺泡细胞癌。肿瘤细胞胞浆透明
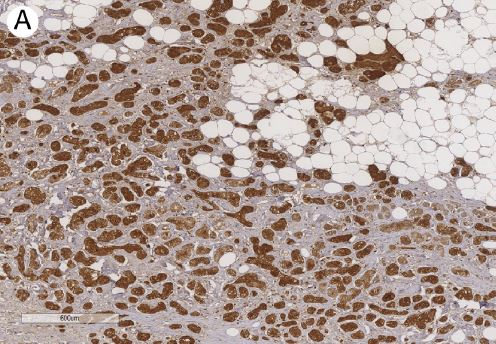
图16:腺泡细胞癌。溶菌酶弥漫强阳性
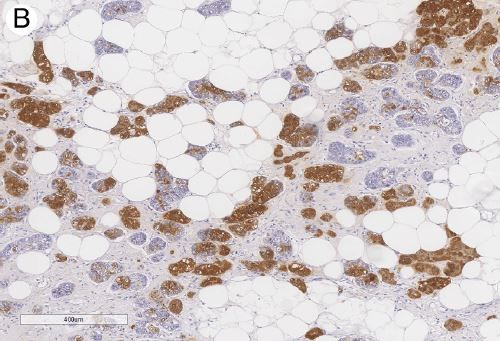
图17:腺泡细胞癌。EMA染色阳性
5、不典型微腺体腺病
在微腺体腺病的基础上出现结构与细胞的不典型
(1)结构不典型:
小管大小不一,形状不规则,排列紧密且相互连接,内衬细胞可呈复层,拥挤、可充满管腔,管腔内少或缺乏嗜酸性分泌物
(2)细胞不典型:
核增大,核形不规则,核染色质呈粗颗粒状,核仁明显,可有核分裂象
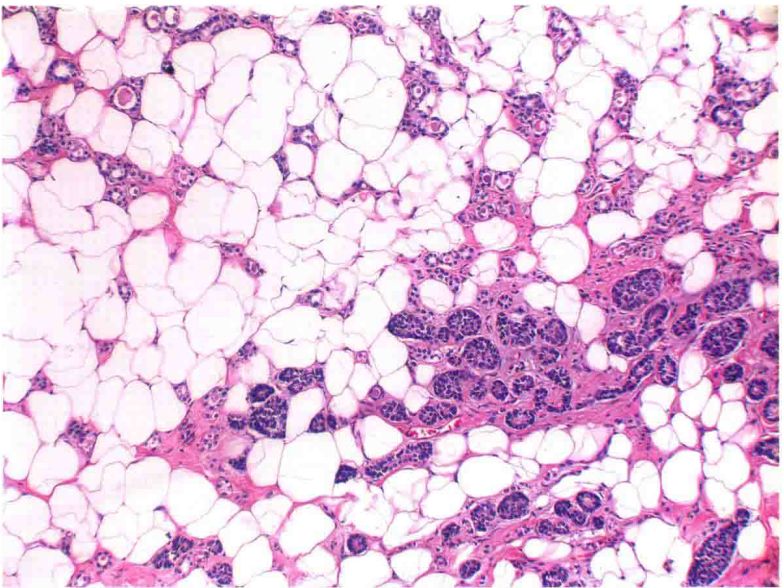
图18:不典型微腺体腺病。低倍镜下显示典型的微腺体腺病区域(上方和左侧)和非典型微腺体腺病,后者腺体内细胞增生使大多数腺腔闭塞
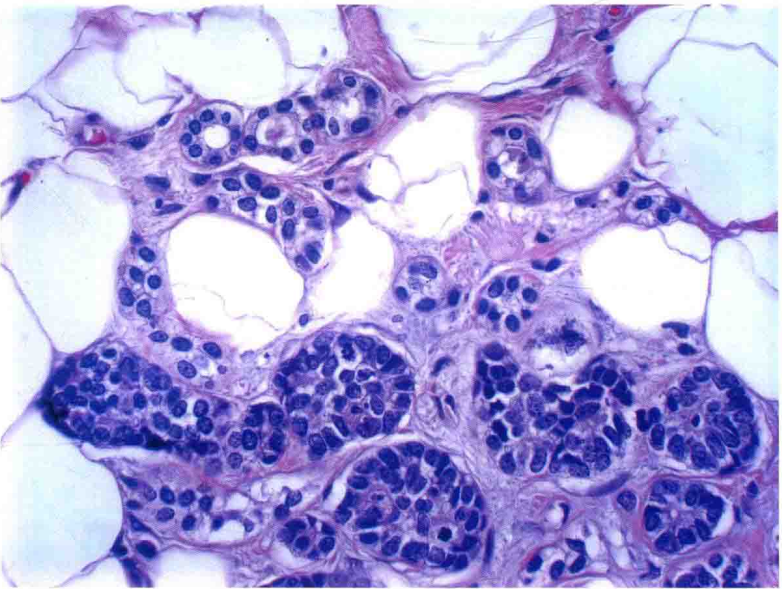
图19:不典型微腺体腺病。高倍镜下,非典型细胞充满腺体。
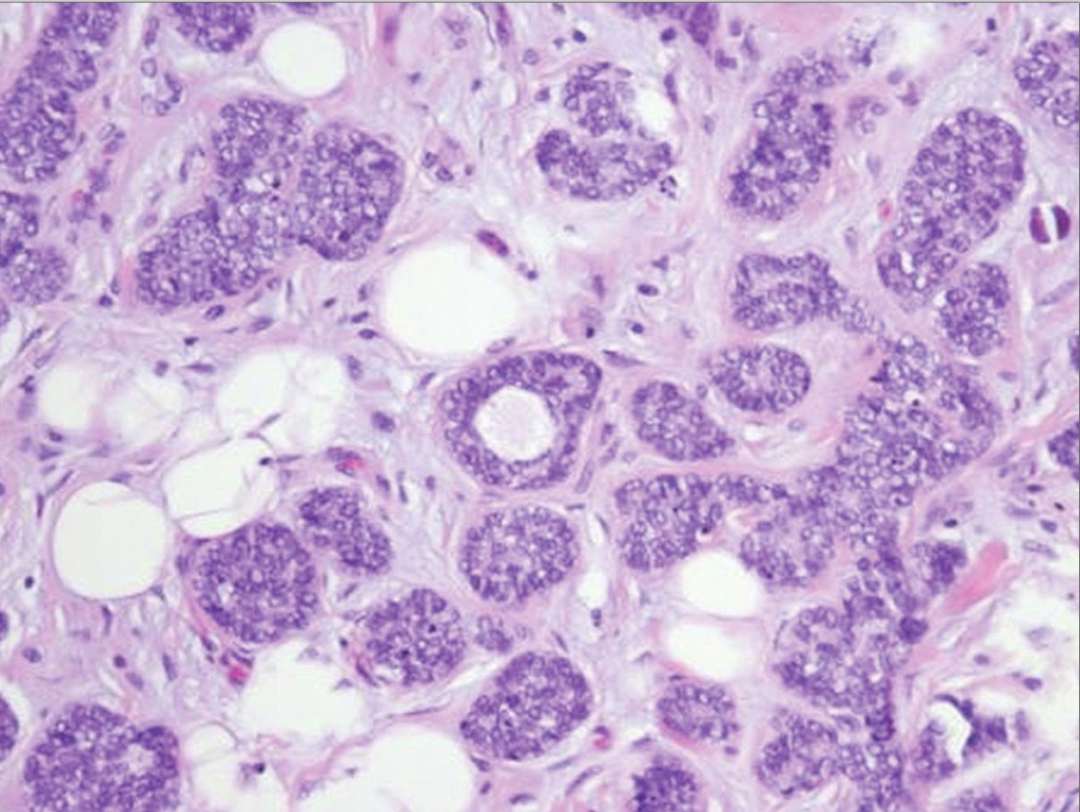
图20:不典型微腺体腺病。管腔不规则,小管内衬复层细胞,甚至充满管腔
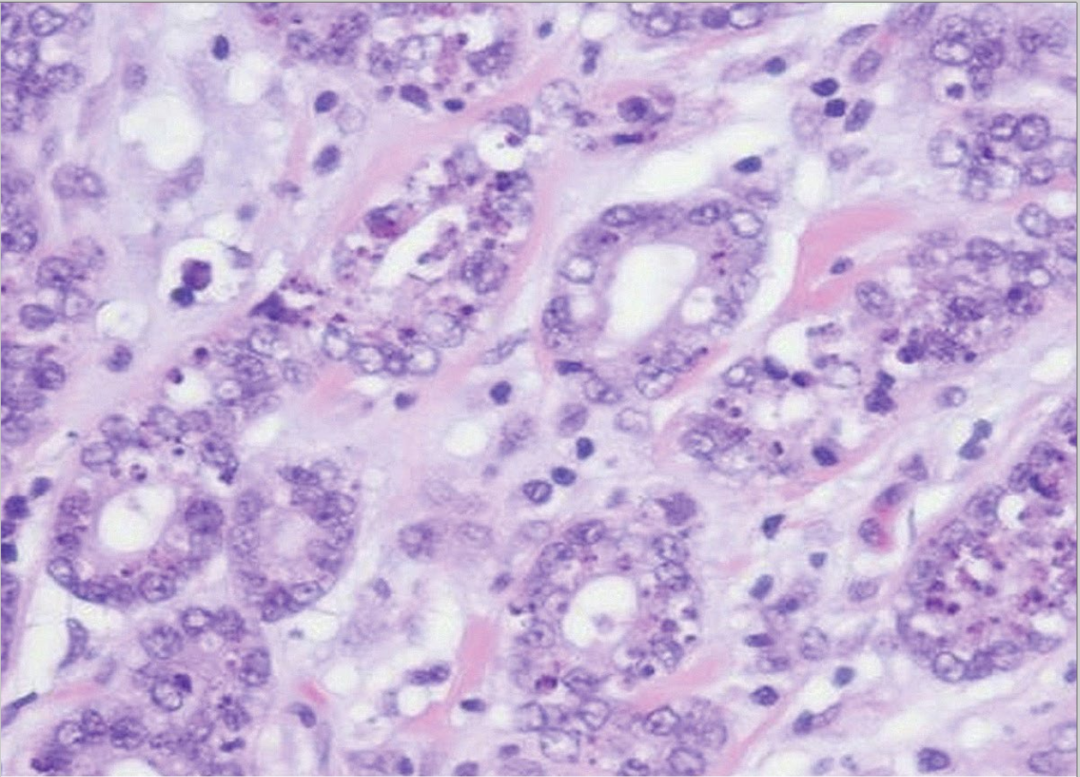
图21:不典型微腺体腺病。高倍镜下细胞核增大,呈泡状、拥挤,核仁明显,极向紊乱,腔内嗜酸性分泌物减少或消失
6、微腺体腺病相关癌
研究发现27%的病例由微腺体腺病或不典型微腺体腺病发展为癌,良性到恶性组织学形态可有移行
(1)导管原位癌:
管腔增大,呈筛状或实性增生,细胞异型性明显增大,核分裂象增多,缺乏肌上皮,但基底膜存在!
(2)浸润性癌:
非特殊类型浸润性导管癌(最常见)、少部分化生性癌、基底细胞样癌、腺样囊性癌、腺泡细胞癌等
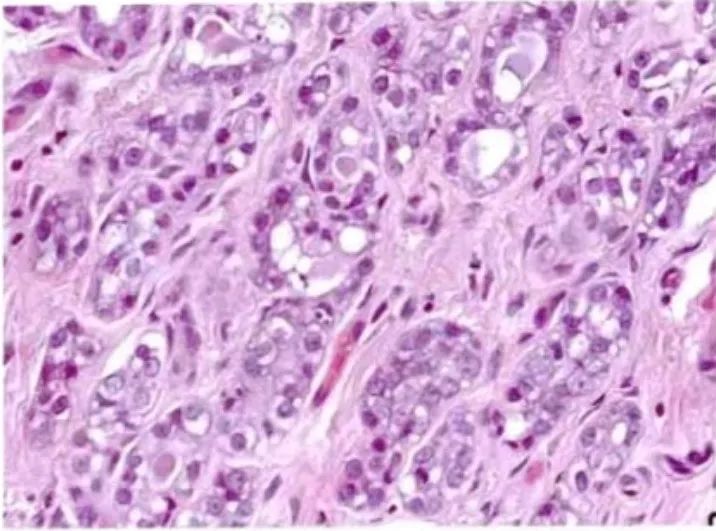
图22:不典型微腺体腺病。腺管不规则,出芽排列较紧密,彼此相互连接。有些腺管内衬单层细胞,有些腺管上皮呈复层,细胞核质比增大,核深染,染色质变粗,核仁明显。腔内少或无嗜酸性分泌物
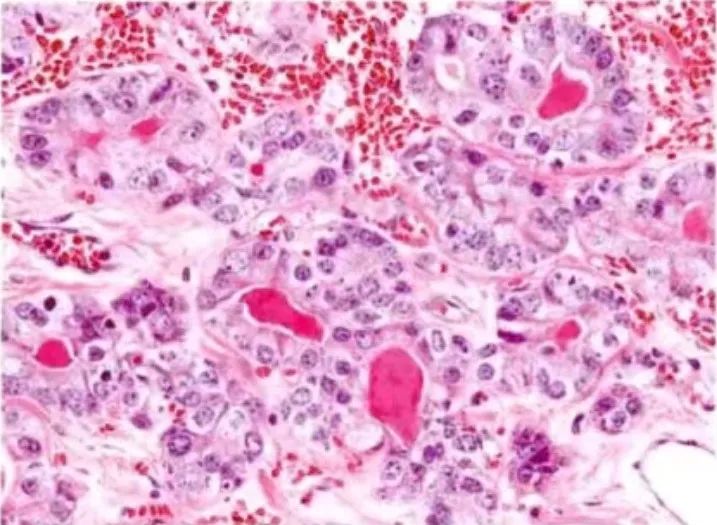
图23:不典型微腺体腺病。腺管增大,形状不规则,细胞极性消失,细胞异型性显著,核呈高级别,细胞核显著增大,核膜粗糙,染色质不规则,核仁突出,一到多个核仁,胞质宽,淡染-嗜酸性,管腔内有红染浓缩物
免疫组化
-
同微腺体腺病,ER、PR、Her-2阴性,S100阳性!!
-
Khalifeh(2008年)研究发现Ki67和P53在微腺体腺病中小于3%,不典型微腺体腺病为5%-10%,而微腺体腺病相关癌大于30%
-
EMA可弱阳或阳性
分子遗传学
1.研究发现从微腺体腺病、不典型微腺体腺病到微腺体腺病相关癌的病变谱系改变有一致性;
2.最常见的显示频发性染色体5q缺失及8q获得;
3.研究发现相同的TP53的突变,均提示微腺体腺病可能是三阴性乳腺癌的非特异性前驱病变。
治疗和预后
1.良性病变,但有发展为癌的潜能!
2.穿刺标本:需切除活检
3.切除标本:保证切缘阴性
4.密切随访!
参考文献及书籍
1.WHO Classification of Breast Tumours.5th Edition
2.Diagnostic Histopathology Of Tumors.
3.乳腺病理活检解读第三版
4.Guerini-Rocco E, Piscuoglio S, Ng CK, Geyer FC, De Filippo MR, Eberle CA, Akram M, Fusco N, Ichihara S, Sakr RA, Yatabe Y, Vincent-Salomon A, Rakha EA, Ellis IO, Wen YH, Weigelt B, Schnitt SJ, Reis-Filho JS. Microglandular adenosis associated with triple-negative breast cancer is a neoplastic lesion of triple-negative phenotype harbouring TP53 somatic mutations. J Pathol. 2016 Apr;238(5):677-88.
5.Wen YH, Weigelt B, Reis-Filho JS. Microglandular adenosis: a non-obligate precursor of triple-negative breast cancer? Histol Histopathol. 2013 Sep;28(9):1099-108.
6.Kravtsov O, Jorns JM. Microglandular Adenosis and Associated Invasive Carcinoma. Arch Pathol Lab Med. 2020 Jan;144(1):42-46.
7.Ajkunic A, Skenderi F, Shaker N, Akhtar S, Lamovec J, Gatalica Z, Vranic S. Acinic cell carcinoma of the breast: A comprehensive review. Breast. 2022 Dec;66:208-216.
8.Sen R, Bhutani N, Kamboj J, Dahiya S. Primary acinic cell carcinoma of the breast: A case report with a clinicopathological and immunohistochemical study of a rare breast cancer subtype. Ann Med Surg (Lond). 2018 Sep 27;35:137-140.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#免疫组化# #乳腺活检# #组织形态学# #微腺体腺病#
64