Lancet:肺癌治疗的新靶点
2016-08-17 filiancy 肿瘤资讯
尽管非小细胞肺癌(NSCLC)及小细胞肺癌(SCLC)的致病驱动基因谱不同,但越来越多的证据表明两者均有潜在的治疗靶点。携带EGFR突变或ALK重排的腺癌患者,一线靶向治疗已成共识,然而,在SCLC的靶向治疗药物大都仍未见曙光。大量的临床前期研究及临床试验进一步探讨肺癌的特性,如致癌基因,DNA损伤修复,血管生成以及肿瘤干细胞的适应性等。备受关注的免疫治疗目前也致力于研发个体化的免疫疗法。在该
尽管非小细胞肺癌(NSCLC)及小细胞肺癌(SCLC)的致病驱动基因谱不同,但越来越多的证据表明两者均有潜在的治疗靶点。携带EGFR突变或ALK重排的腺癌患者,一线靶向治疗已成共识,然而,在SCLC的靶向治疗药物大都仍未见曙光。大量的临床前期研究及临床试验进一步探讨肺癌的特性,如致癌基因,DNA损伤修复,血管生成以及肿瘤干细胞的适应性等。备受关注的免疫治疗目前也致力于研发个体化的免疫疗法。在该综述中,来自新加坡国立肿瘤中心的Wan-Ling Tan等教授讨论了尚在早期研发阶段的新的肺癌靶向治疗药物。
背景:
大多患者诊断肺癌时即为晚期,尽管早期肺癌可切除,但90%患者最终会复发。过去的十年靶向药、化疗药及抗血管生成药物的飞速研发(下图一),晚期NSCLC总生存期已延长至12月(小编的话:EGFR突变患者总OS达30月)。最重要的治疗策略进展是靶向药物及早期成功的免疫治疗。这些方案同时提示检测基因组学及蛋白组学的生物标记物应用于临床治疗,有助于促进个体化方案的选择。国际数据库如TCGA和ICGC等,联合二代测序的结果,使得患者初诊及进展时治疗靶点选择及分层将成为可能。基因组学的应用在发现NSCLC和SCLC的特性上,起到了重要作用。临床医生、科研家、公司及管理当局等越发紧密的合作,使得药物的研发步伐加快。本文探讨肺癌靶向药的最近进展,及在更深入理解肿瘤异质性的基础上,设计未来临床研究。

图一:晚期肺癌重要治疗药物进展
1 什么是理想的靶点
理想靶点的简单定义是可以在高效治疗指标及广泛治疗窗口下,达到消灭肿瘤细胞的一个靶点。然而在细胞株及种植动物模型上有效的靶点,在体内并不一定能得到预期疗效。目前NSCLC的预测生物标记物大都已成功应用靶向治疗。主导的肿瘤特性随着时间推移会发生改变,当前研究中再活检意义重大。
2 基因组学靶点的确定
大多治疗靶点是由基因功能的丢失而导致结构重构及旁路激活,包括点突变、染色体重排及基因区域的扩增。肺癌的靶点见表一。
表一:肺癌靶点列表
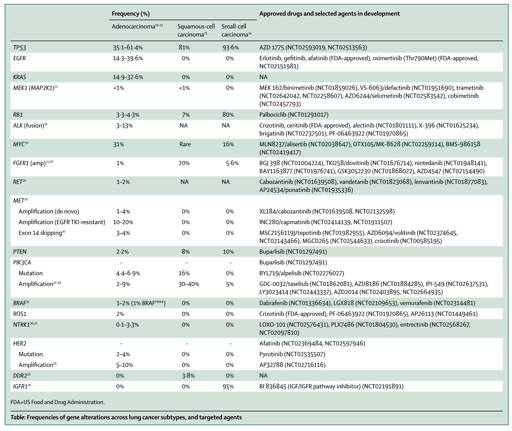
2.1靶向肿瘤驱动基因:临床视野
NSCLC两个最常见的驱动基因:EGFR突变和ALK重排,已被多项3期研究证实可获得高达70%的缓解率。而未来最大的挑战是普遍出现的耐药,多为出现二次突变影响药物结合或是旁路激活。如在一代EGFR-TKI的常见耐药机制是T790M突变,旁路激活(如MET扩增)以及转化为其他病理类型等。在AURA两项研究证实,为克服EGFR T790M而设计的AZD9291也就osimertinib可获得59%的总体缓解率,且美国FDA也在2015年11月通过osimertinib上市。然而,C797S突变的出现,影响了osimertinib的疗效,发展至耐药。而ALK-TKI耐药机理则较复杂,L1196M突变是克唑替尼常见耐药基因,且二代TKI alectinib 及色瑞替尼可克服,然而二代TKI则会因G1202A突变的产生而发生耐药。新一代TKI直接应用于一线,能否会更大获益,一线alectinib(NCT02075840) 应用于ALK重排患者及一线osimertinib (NCT02296125)应用EGFR突变患者的临床研究正在进行中。而少见基因变异包括BRAFV600E,NTRK,ROS1,PIK3CA等也同样引起重视,对应的靶向药物目前正研发中。
2.2其他驱动基因新兴的靶点
KRAS突变在NSCLC(腺癌)中是一个常见突变之一,以往认为非可治疗的靶点,而目前几个新治疗策略正在进展中,期望有所突破。靶向其下游通路的MEK抑制剂( 如selumetinib 及trametinib)显示令人兴奋的结果,正开展的NCT01933932研究,在KRAS突变患者中selumetinib与多西他赛结合获得36%的缓解率,而多西他赛单药缓解率为0%. 更多尝试靶向RAS GTP键特别是KRAS G12C的研究也陆续在开展。
而在鳞癌和小细胞肺癌中的靶点驱动基因是更加局限的;更多靶点已被发现研究,如MET/HGF包括MET扩增和14突变在腺癌、鳞癌和大细胞癌。MET扩增的在未治疗NSCLC中约占2-4%,而EGFRTKI耐药患者的发生率则高达20%;而MET14突变在(非亚裔人群)腺癌发生率3-4%。MET抑制剂仍需更多研究报道。
HGF信号通路的另一FGFR旁路的激活,特别是FGFR1在早期鳞癌中的作用也已有不少研究。FGFR1在鳞癌中发生率约占9.7-21.1%(SNP数列)而22.2%(by FISH),然而在腺癌中仅为3%。尽管选择性治疗FGFR 1–3的抑制剂,如 BGJ398, AZD4547及PD173074的临床正进展中,并看到可喜结果,但FGFR抑制剂的发展仍面临不少挑战,包括FGFR激活的筛选策略的矛盾,合适的扩增截点的定义,药物的不良反应等。
MYC家族的变异在SCLC中发生率高达20%,高特异性靶向aurora 激酶A 抑制剂alisertib,在I期研究中,在化疗失败后的SCLC中可获得21%的缓解率,而更多结果启动II期研究(NCT02038647).
2.3 靶向肿瘤抑制基因
TP53是最常见的抑癌基因,其在靶向治疗中的作用仍未能验证。临床前期的动物模型中靶向TP53基因进行了探索,并无激动结果;目前也无在研的TP53靶向治疗相关研究。
2.4 靶向表观遗传学机制
表观遗传学机制是基因变异导致相应的DNA及组蛋白学的改变,如甲基化及乙酰化作用等,其突变是挺常见的,包括SWI/SNF 复合体的SMARCA4/BRG1及 ARID1A突变在腺癌的发生率分别是8% ,10% ;而MLL2在鳞癌的发生率19%,且CREBBP/CBP及EP300 hist组蛋白变异在SCLC约占18%。临床前期研究取得一定成果,但应用于临床仍需更多的证据。
3 肺癌治疗相关的靶点
3.1 DNA损伤修复的研发
吸烟与肺癌的发生关系密切,且肺癌可在铂为基石的化疗中获益,DNA损伤修复引起了极大的重视。DNA损伤修复是一个非常复杂的过程包括多种DNA修复蛋白,细胞周期关卡的协同作用及细胞调节因子等。着重研究DNA修复蛋白RRM1及ERCC1基因的表达水平的临床试验并无取得预期结果。PARP1 及 E2F1 抑制剂 (如EZH2 及talazoparib)在临床前期实验中体外实验有一定疗效,且在I期研究中PARP抑制剂talazoparib在SCLC中2/11(18%)获得缓解。DNA损伤修复治疗的最大挑战是如何确认存在DNA损伤并能从DNA修复通路获益的这部分患者。
3.2 靶向细胞周期及关卡激酶
细胞转移的关卡激酶抑制剂如CDK4/6抑制剂在肺癌中已被研究。在经治疗的晚期NSCLC中,一项2期研究中可沉默CDKN2A的palbociclib (PD0332991),8/16(50%)获得疾病稳定(SD)。另一项1期研究CDK4/6 抑制剂abemaciclib (LY2835219)中,1/49(2%)患者获得部分缓解,总的疾病控制率是51%,且在KRAS突变患者中似乎更加(疾病控制率54% vs. 37%)。而palbociclib与MEK抑制PD0325901的联合应用,目前正在LUNG-MAP研究进行中。其他细胞周期靶向药如LY2606368,Chk1抑制剂LY2603618及AZD7762,ATR 抑制剂VX-970 ,PLK1-3 抑制剂BI2536及BI6727等单药或与传统化疗相结合的临床研究也已开展,疗效需要更多大型临床研究证实。
3.3 靶向肿瘤干细胞样细胞
由靶向药耐药患者中观察到的小细胞转化提出猜想,罕见的肿瘤干细胞样细胞具备自我更新的能力,并能分化成不同的细胞类型;但这仍存在很多挑战。在大标本中已检测到干细胞标记如CD133, CD166, CD44, ALDH1 以及信号通路如Hedgehog, Notch及Wnt通路标记物。而肿瘤异质性也可能是细胞转化耐药的一个重要因素。医药公司已在致力开发干细胞治疗药物,临床实验正在开展中如napabucasin (BBI608)联合免疫治疗,defactinib (VS-6063)在KRAS突变NSCLC,及demcizumab (DLL4抗体)应用在晚期SCLC等。
而在近期的一项1期研究中,DLL3抗体抑制剂 rovalpituzumab在复发SCLC中,10/29(34%)患者获得部分缓解(PR),31%获得SD;而SCLC中高达70%患者可检测出DLL3表达,这个令人期待的研究正在进行2期研究中。
而靶向于信号通路是肿瘤干细胞样细胞治疗的另一个重要途径,RO4929097 是靶向应用于Notch通路,在NSCLC小鼠模型上有一定抗肿瘤效果,但在临床研究中因疗效欠佳提前终止了。而另一个notch通路抑制剂BMS-906024在实体瘤中的作用正在进行中。
肿瘤干细胞靶向药与化疗的联合治疗也引起关注,如在肺鳞癌Ib临床研究中,demcizumab联合培美曲塞,结果示可耐受,且1/40(3%)获得完全缓解,47%患者获得部分缓解。demcizumab联合培美曲塞+卡铂应用于一线肺鳞癌患者的研究(DENALI)也已启动。
3.4 靶向肿瘤新陈代谢
越来越多的研究阐述到肿瘤细胞与正常细胞新陈代谢的差异性,主要集中于Warburg效应的重新激活,以及肿瘤细胞依赖的丝氨酸、谷氨酰胺及甘氨酸,这对于深入理解高度差异细胞类型的肿瘤转移具有重大意义。代谢酶GLDC在肺癌干细胞特异性增高并在分化中起作用,其是丝氨酸-甘氨酸通路的关键酶,影响碳代谢周期。而其他丝氨酸-甘氨酸通路酶如 SHMT2 及PHGDH也在其他肿瘤中见特异改变。靶向于这些代谢酶的研究,如靶向GLDC和PHGDH(anti-serine biosynthesis), 及SHMT2 (anti-glycine biosynthesis)的药物正在临床前期研究中。
3.5 免疫系统的治疗
免疫治疗包括PD-1及PD-L1抗体在肺癌中的作用是不容置疑的,免疫治疗在大多患者中获益,联合治疗的研究正在开展以期获得更长的持续有效时间。免疫治疗主要可分为以下两种策略:一是靶向宿主策略,二是肿瘤细胞策略(见下图二)。
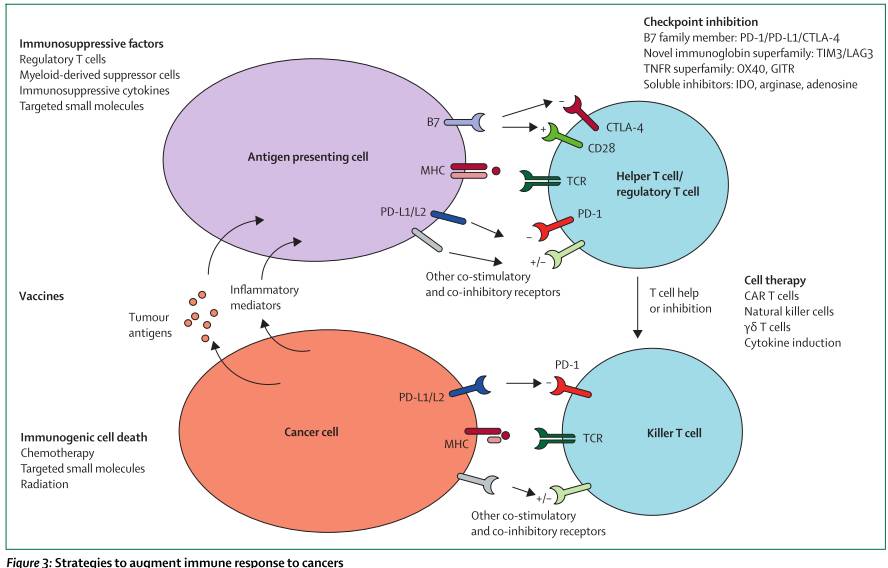
图二:肿瘤免疫应答策略
3.5.1靶向治疗关卡抑制位点及其上游
PD-1抗体nivolumab 及 pembrolizumab已在2015被批应用于NSCLC二线治疗,而其在一线用药研究正在开展中((NCT02041533, NCT02477826, NCT02142738, NCT02220894)。而免疫治疗联合其他治疗策略也日益显示其优势,CTLA-4抗体Ipilimumab 及tremelimumab,与PD-I/PD-L1抗体联合治疗的研究正在进行中(CheckMate 227, NCT02477826; MYSTIC, NCT02453282; NEPTUNE, NCT02542293)。其他联合用药临床研究也如火如荼中,包括:LAG-3抗体 BMS-986016 及LAG525联合anti-PD-1 药(nivolumab [NCT01968109] 及PDR001 [NCT02460224]的I期,抗TIM3抗体MBG453与PDR001,以及抗KIR抗体联合nivolumab等。
肿瘤治疗性疫苗旨在激活免疫应答对抗肿瘤共享及特异性抗原,几项研究也进入临床研究中,如GV1001,TG4010, DRibble (DPV-001), CV9201(靶向MAGE-C1, MAGE-C2, NY-ESO-1, surviving及 5T45个肿瘤相关抗原)等疫苗正在进行I-IIB期临床研究,疗效仍需待进一步验证。
3.5.2 直接增强肿瘤免疫反应
肿瘤细胞的凋亡可以是免疫原性介导也可以非免疫,前者可导致促验证因子的释放及免疫细胞的回收,而这也是免疫治疗与化疗、小分子靶向药及放疗联合治疗的理论基石。几项细胞疗法的临床也在进行中,如识别NY-ESO-1的T细胞(NCT01697527),肿瘤浸润相关的球细胞(NCT02133196);及多种识别NY-ESO-1的Tcells (NCT01967823) 及其分别与ipilimumab (NCT02070406), VEGFR2 (NCT01218867), MAGE-A3 (NCT02111850), mesothelin (NCT01583686, NCT02414269)等联合治疗的临床也正在开展,更多的疗效证据仍需进一步等待结果公布。
单克隆抗体的作用现再度引起关注,如西妥昔单抗直接抑制EGFR通路,同时具备潜在靶向抗体而独立细胞毒性及补体激活功能。而更多的单克隆抗体 如bavituximab (SUNRISE, NCT01999673), patritumab (NCT02134015), rilotumumab (NCT02154490, NCT01233687),以及IMMU-132, (NCT01631552)等研究也在开展中。
3.6 肿瘤的适应性可以靶向?
肿瘤耐药的发生如EGFR-TKI耐药后出现T790M突出了肿瘤克隆进化的重要作用,其机制主要有两方面:预先适应(耐药前即存在)及用药后适应(直接选择作用下的适应性),而前一理论更多证据支持,即大多突变在耐药前已存在,只是丰度低而当前测序技术的局限性并未能检测出来。大规模测序逐渐呈现肿瘤进化过程的异质性;而肿瘤进化树更能形象化。理论上,靶向治疗主要的驱动基因即可获得高疗效,但此起彼伏,同时居于系统治疗的ecological 理论及game 理论可能会为肿瘤治疗提供思路。TRACERx及DARWIN (NCT02314481)两项试验均旨在明确可切除NSCLC患者复发时主导克隆(或亚克隆)优势变化及其无进展生存期的关系,其将一步明确克隆异质性的进化及耐药发生机制。
4.药物研发方法及未来展望
未来药物研发将应更加注重精准治疗,更多的选择性生物标记物将确定(如下图)。而连续动态检测,特别是液体活检对深入肿瘤耐药继续发挥重要作用。

5.结论
当前可靶向治疗的基因变异当前研究火热,基因组学及表观遗传学在非编码基因组、染色体及微环境下作用可能会成为新的治疗靶点及当前治疗策略新的预测因子。
原始出处:
Tan W, Jain A, Takano A et al. Novel therapeutic targets on the horizon for lung cancer. The Lancet Oncology.August 2016.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#Lancet#
78
#肺癌治疗#
78
不错哦继续关注
125
值得学习
119
学习了,好
125
好文,学习了
118
这篇资讯带给我们新知识,启发新思维,不论是科研还是临床工作都有很大的帮助。。。
127
好好学习一下
73
理论综合而全面,既增加知识储备有可开阔视野,学习了
67
继续关注
74