中原纳米酶实验室(郑大)阎锡蕴/高利增/江冰《自然·通讯》:具有选择性过氧化物酶样活性的仿生硫-铁-血红素纳米酶用于增强肿瘤化疗
2024-12-10 BioMed科技 BioMed科技 发表于陕西省
本文介绍纳米酶领域背景及关键问题,阐述阎锡蕴等团队开发仿生硫 - 铁 - 血红素纳米酶 HCFe,说明其合成、特性、克服肿瘤顺铂耐药机制及体内外效果,展望其应用前景。

【研究背景】
纳米酶(Nanozyme)是一类具有酶学特性的纳米材料,是我国科学家原创和引领的新领域。纳米酶集合了酶与化学催化优势,可以在温和条件甚至低温环境下催化酶的底物,具有催化活性高、性质稳定、成本低、易于改造和大规模生产等特点。这些特性使纳米酶在多个领域成为天然酶的强大替代品,包括疾病诊断和治疗、分析化学、生物传感和环境修复等。然而,与天然酶不同,纳米酶往往对底物和反应途径缺乏特异性。如何调控纳米酶的催化选择性成为了纳米酶研究领域关键科学问题之一。以铁基纳米酶为例,其通过类过氧化物酶(Peroxidase,POD)活性催化过氧化氢(H2O2)生成羟基自由基(•OH),可高效杀伤肿瘤细胞,在肿瘤催化治疗中展现出潜力。然而,铁基纳米酶同时具备过氧化氢酶(Catalase,CAT)活性,能够将肿瘤组织中的H2O2转化为氧气和水,削弱了羟基自由基的形成效率,从而潜在限制了其抗肿瘤效果。因此,如何通过设计有效提升铁基纳米酶的催化选择性,抑制不必要的CAT活性,从而增强其POD活性并提高•OH的生成效率,成为待解决的关键科学问题。
【文章要点】
中原纳米酶实验室(郑州大学)阎锡蕴/高利增/江冰团队在最新研究中开发了一种具有选择性过氧化物酶样活性的仿生硫-铁-血红素纳米酶(HCFe),并验证了其在增强肿瘤化疗中的显著作用。相关工作以题为“A Bioinspired Sulfur-Fe-Heme Nanozyme with Selective Peroxidase-like Activity for Enhanced Tumor Chemotherapy”的论文发表在《Nature Communications》上。
研究者利用超分子组装策略,通过半胱氨酸在血红素平面FeN4结构的轴向引入Fe-S配位结构,整合了血红素和铁硫簇这两种天然氧化还原酶的关键活性中心辅因子,成功设计了具有FeN4S催化中心的HCFe纳米酶。这种新型纳米酶通过S原子向Fe原子的电子转移,显现出独特的单一过氧化物酶(POD)活性,能够选择性催化过氧化氢生成羟基自由基(•OH),而非分解为水和氧气,从而实现底物过氧化氢反应路径的定向控制(图1)。此外,HCFe纳米酶能够与顺铂(CDDP)协同作用,显著克服顺铂化疗耐药问题,为纳米酶催化选择性研究提供了全新思路。
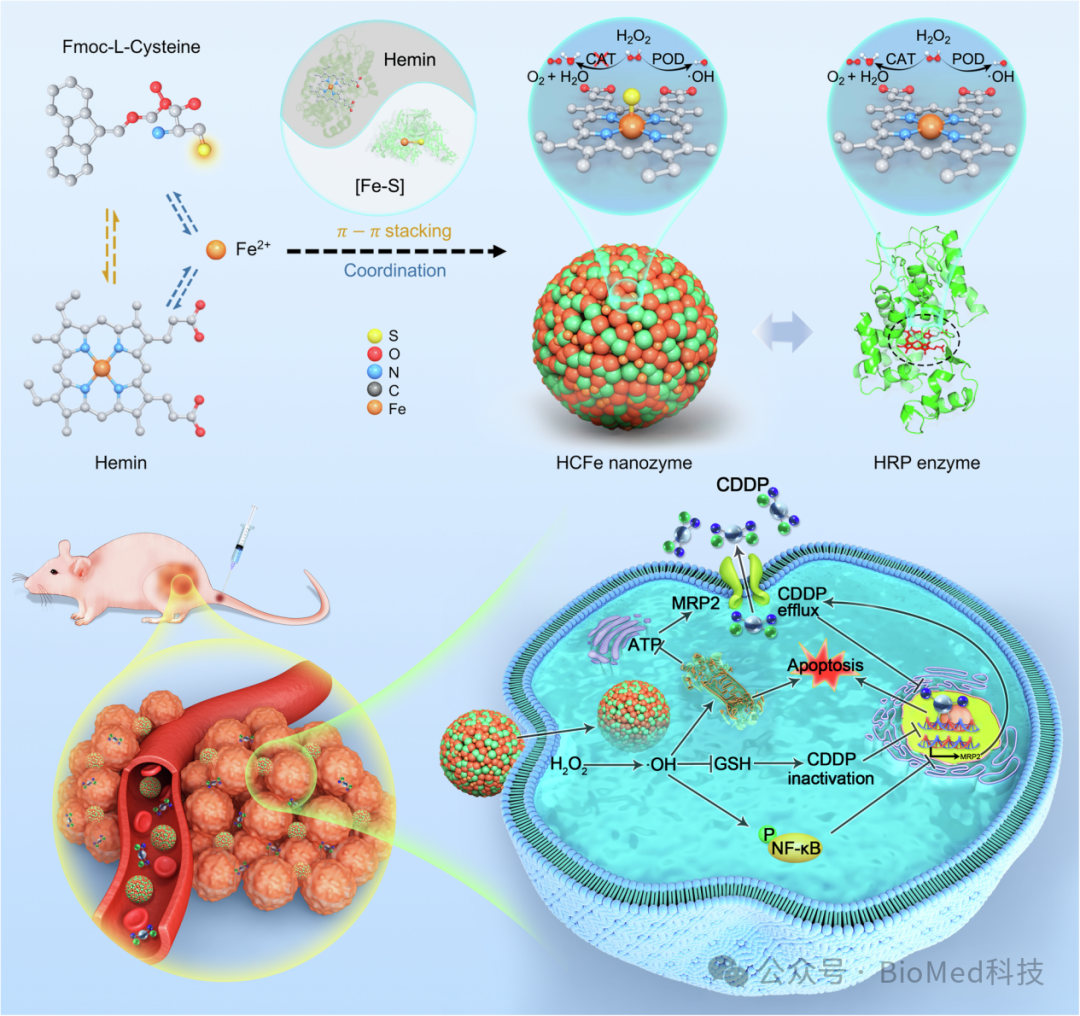
图1:HCFe纳米酶的合成、筛选及其在食管鳞状细胞癌化疗中克服顺铂耐药的应用示意图。
研究团队受天然辣根过氧化物酶(HRP)中的血红素以及醛氧化酶中的Fe-S结构启发,利用Fmoc-L-cysteine和血红素(Hemin)之间的π-π堆积相互作用,以及Fe2⁺与Fmoc-L-cysteine和Hemin中的羧基的配位作用,合成了仿生铁基纳米酶HCFe纳米酶。并利用另外19种Fmoc修饰氨基酸,以同样的方法合成了19种仿生铁基纳米酶作为对照。与19种对照纳米酶以及Hemin和HRP相比,只有HCFe纳米酶表现出了单一的POD活性(图2)。
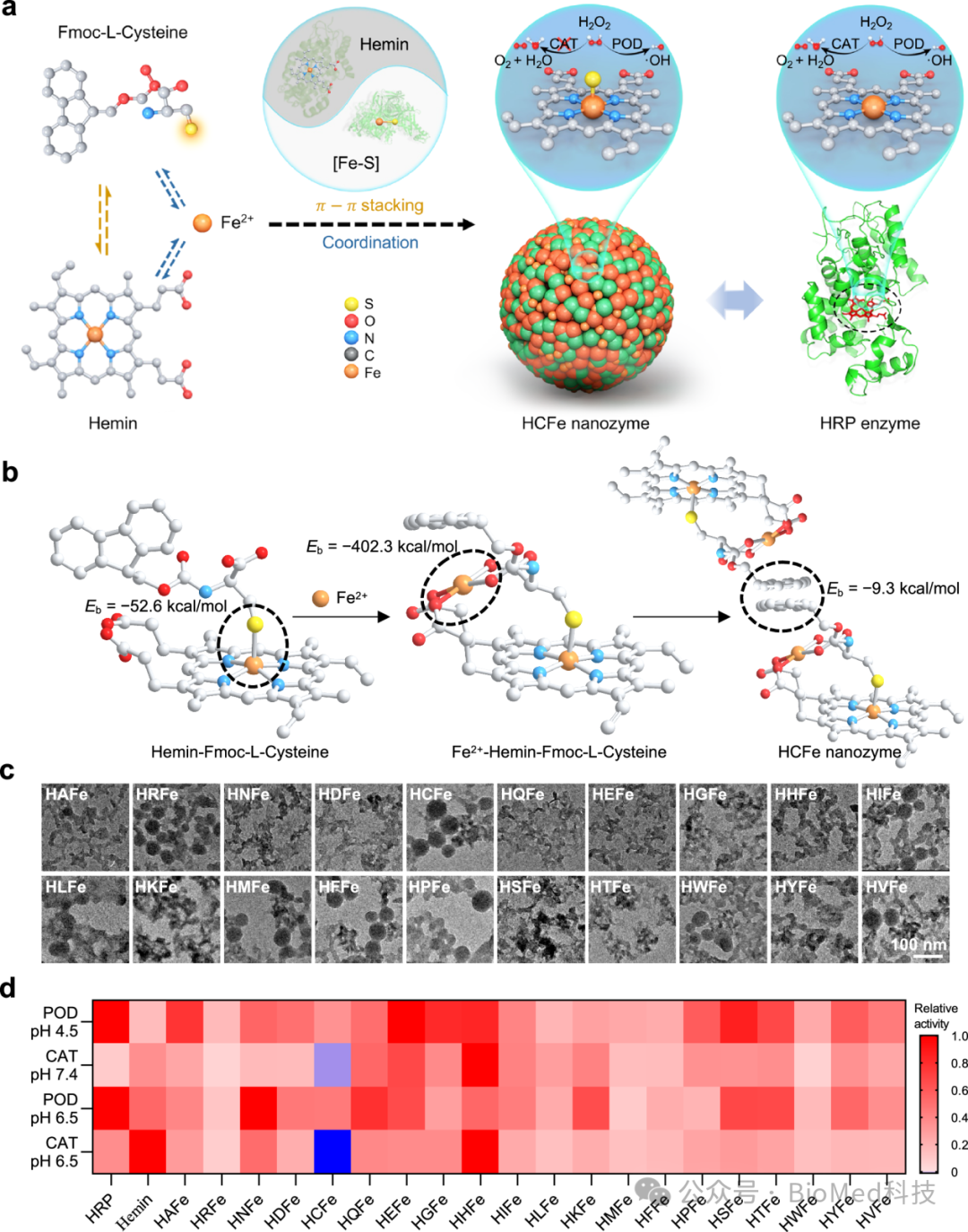
图2:仿生铁基纳米酶文库的构建及铁基单过氧化物酶纳米酶的筛选。
X射线光电子能谱、57Fe穆斯堡尔谱和同步辐射分析证明了HCFe纳米酶中FeN4S催化中心的成功构建(图3)。
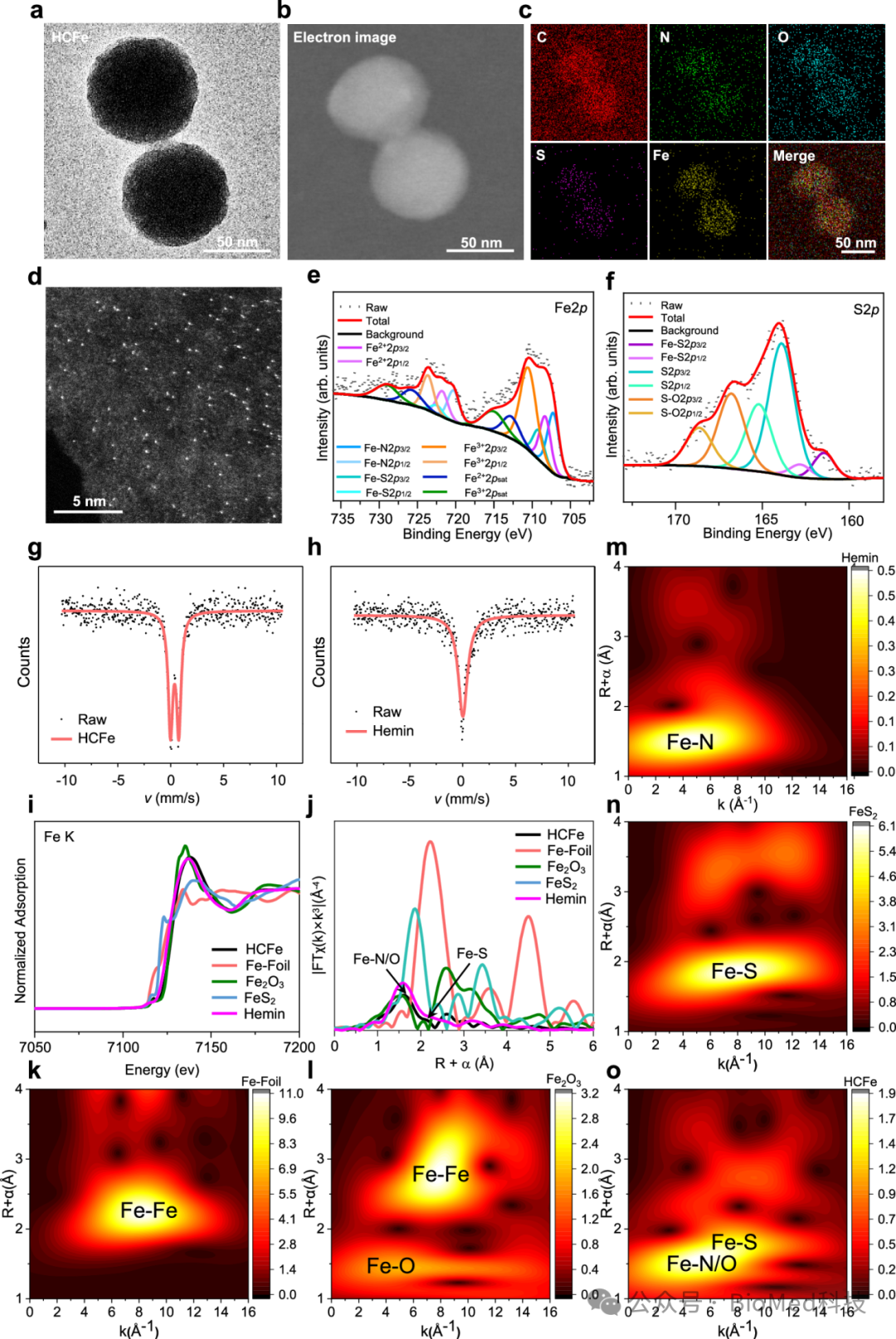
图3:HCFe铁基单过氧化物酶纳米酶的结构表征。
HCFe纳米酶独特的单POD样活性不是源于某一个单一组分,而是源于各组分之间的相互作用形成的独特结构。值得注意的是,HCFe纳米酶在pH7.4的正常生理环境下呈现一种惰性状态,只有在pH6.5的肿瘤酸性微环境下才表现出类POD活性,催化H2O2产生•OH。与同时具备较高类POD活性和类CAT活性的仿生铁基纳米酶HHFe相比,HCFe纳米酶可以更有效地诱导肿瘤细胞产生ROS,进而更有效地杀伤肿瘤细胞(图4)。
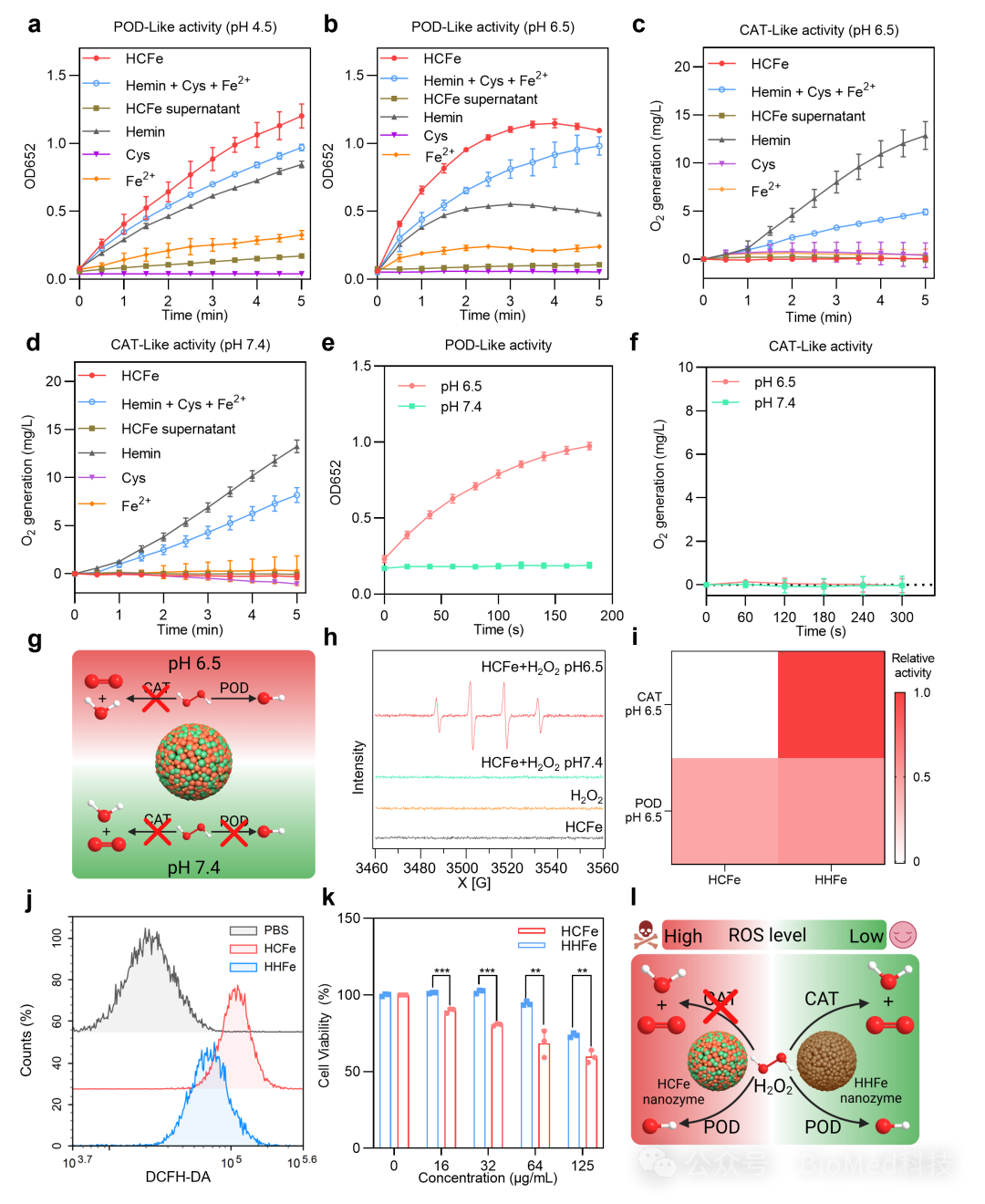
图4:HCFe单过氧化物酶纳米酶的催化性能。
理论计算分析显示,从Cysteine的S原子到Hemin的Fe原子的电子转移提升了Hemin的最高占据分子轨道(Highest occupied molecular orbital,HOMO),使其还原电位降低到0.27 V。该值低于催化过氧化氢分解为水和氧气所需的第二个半反应电位φ(O2, H+/H2O2) 0.29 V,阻碍了第二电子转移步骤,导致了HCFe纳米酶CAT活性的缺失(图5)。
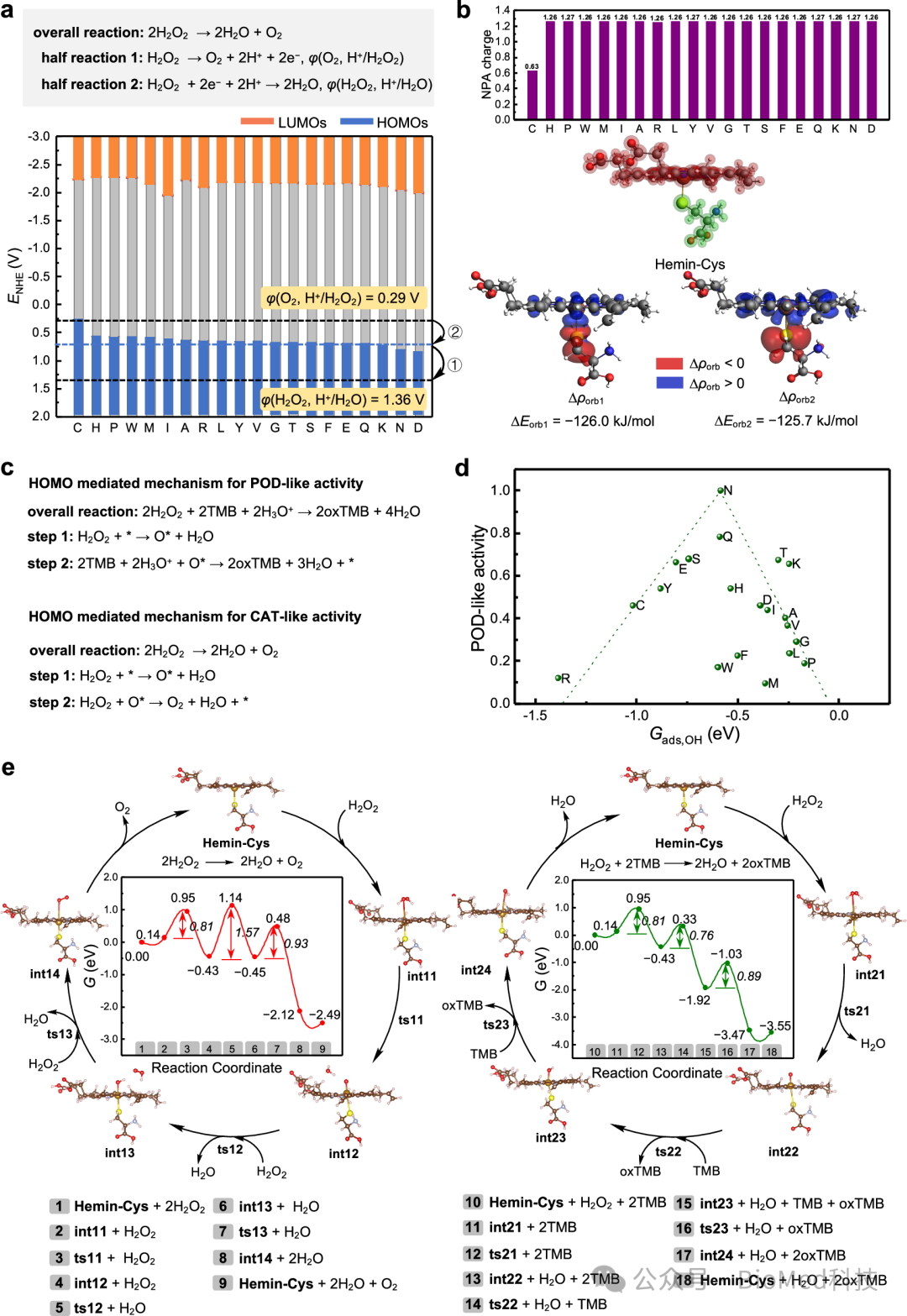
图5:HCFe纳米酶的选择性催化机理。
研究团队利用食管鳞癌细胞系EC109、EC9706和TE1诱导建立了3个顺铂耐药细胞系(EC109DDP、EC9706DDP和TE1DDP)。通过比较亲本细胞和耐药细胞,发现耐药细胞中与铂外排(ABCC2和ABCC3)和谷胱甘肽介导的解毒(Nrf2, GPX4, GST)相关的基因过表达;顺铂处理后耐药细胞内铂含量显著低于亲本细胞,而谷胱甘肽显著增加。因此,食管鳞癌顺铂耐受性的增强可能是铂外排增强、谷胱甘肽介导的解毒增强和抗氧化防御增强等共同作用的结果(图6)。
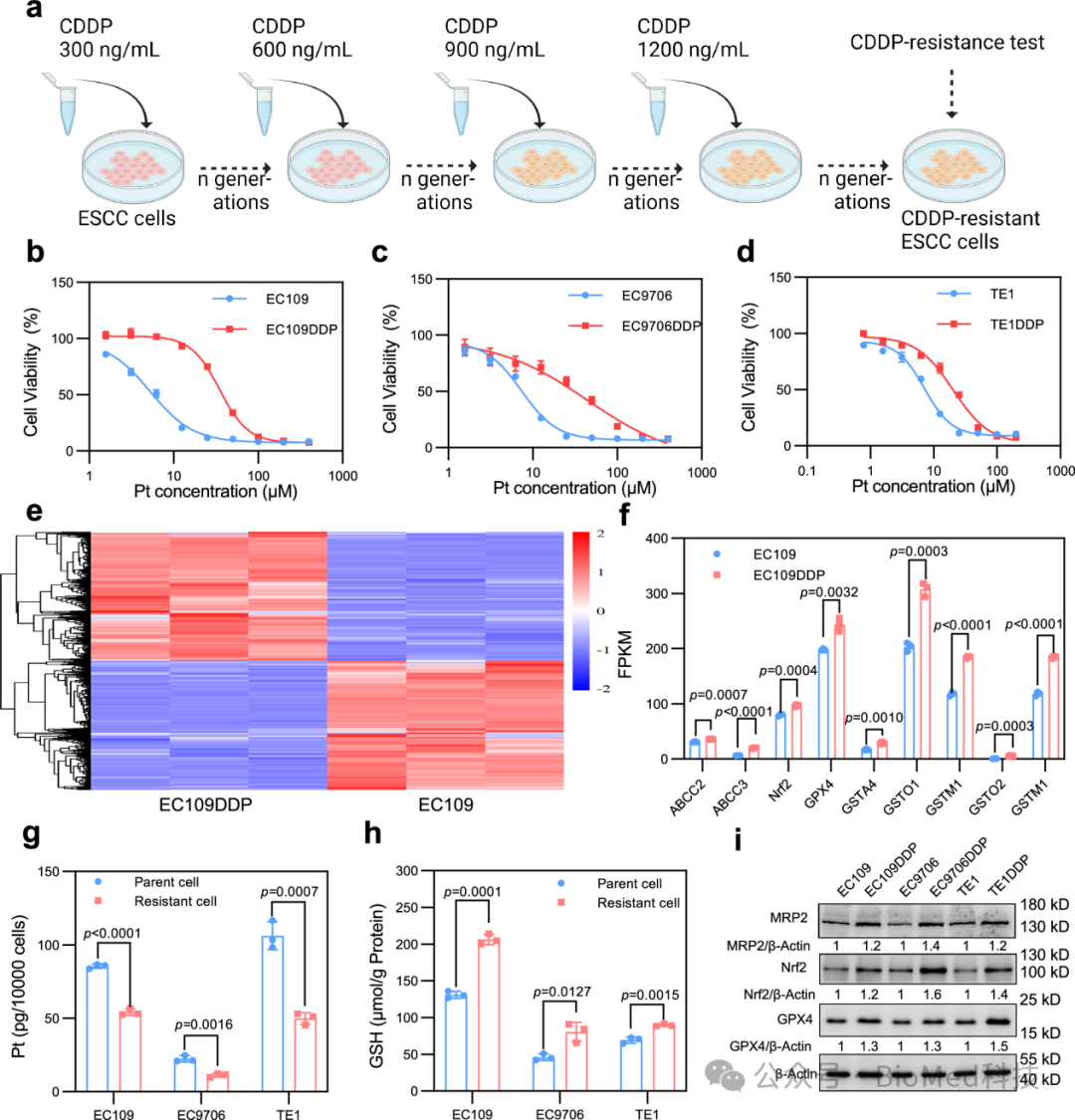
图6:食管鳞状细胞癌CDDP耐药细胞的特点。
HCFe纳米酶联合CDDP可以有效杀伤食管鳞癌顺铂耐药细胞,联用指数小于1,表现为1+1>2的协同相互作用。进一步实验表明,在顺铂耐药细胞内诱发过量ROS可以增强NF-κB的表达以及激活,从而引起MRP2表达下调,减少CDDP外排。并且过量ROS可以有效降低顺铂耐药细胞内GSH水平,减少CDDP的失活。最终导致食管鳞癌顺铂耐药细胞DNA损伤和凋亡水平显著升高,有效地克服了食管鳞癌顺铂耐药(图7)。
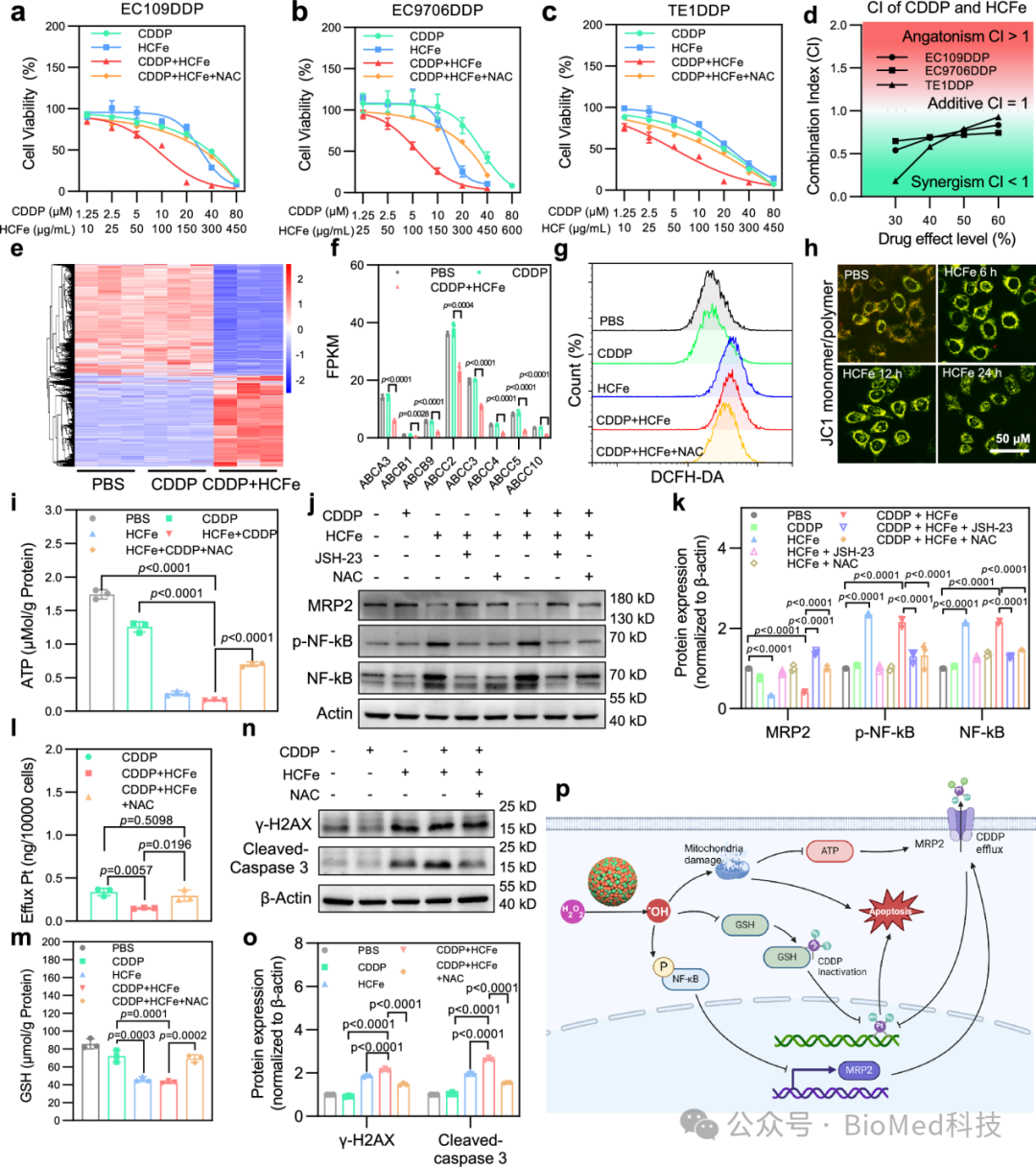
图7:HCFe纳米酶联合CDDP克服了食管鳞癌细胞对CDDP的耐药。
体内实验也表明,HCFe纳米酶联合CDDP可以有效抑制食管鳞癌顺铂耐药细胞移植瘤的生长,显著延长荷瘤小鼠的生存期。肿瘤组织切片H&E和TUNEL染色显示HCFe纳米酶与CDDP联合治疗可以诱发食管鳞癌顺铂耐药细胞移植瘤组织坏死和细胞凋亡(图8)。
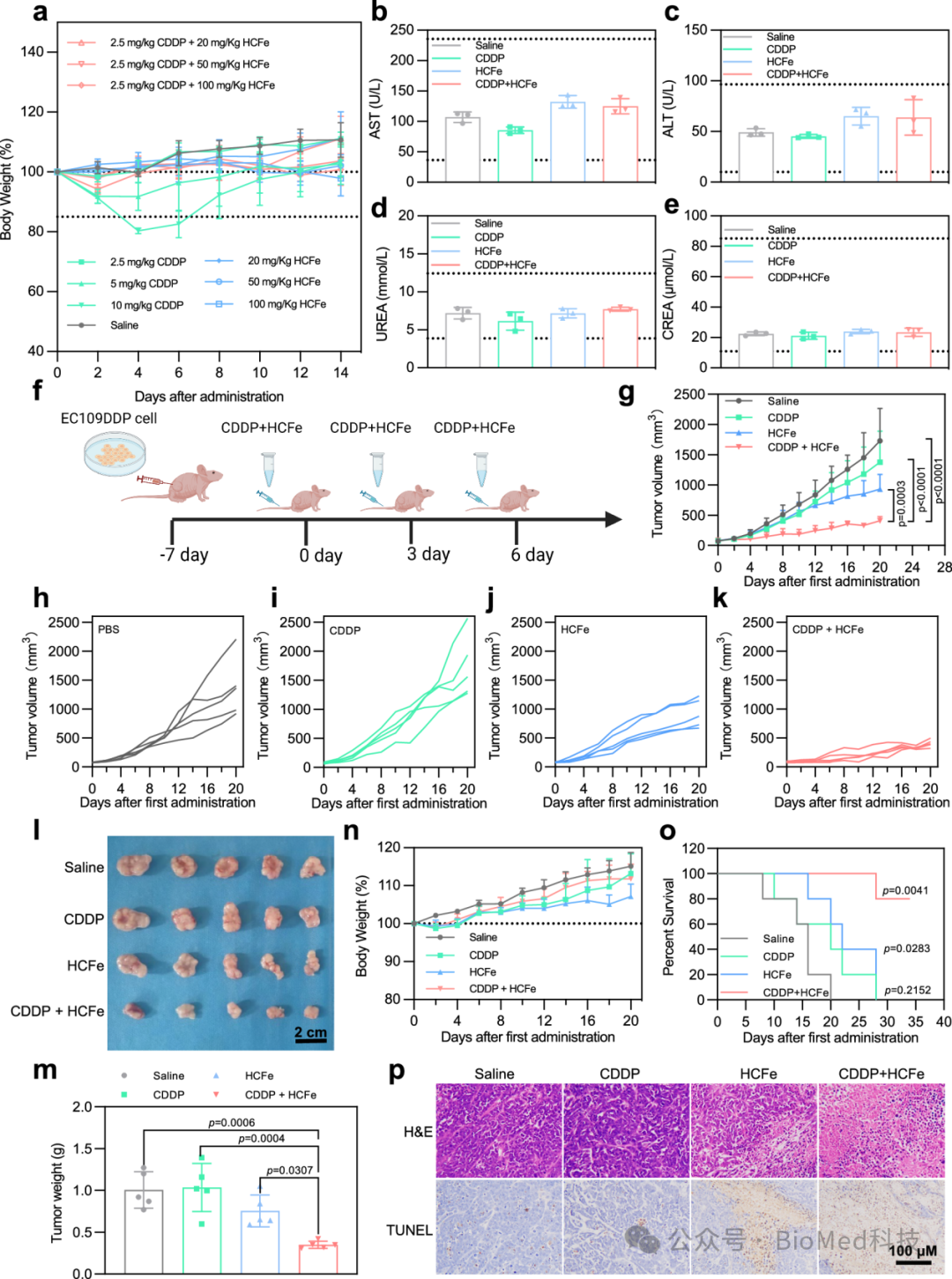
图8:HCFe纳米酶联合CDDP在体内治疗顺铂耐药食管鳞癌移植瘤。
【结论与展望】
通过仿生设计策略,研究团队成功整合了天然氧化还原酶两种常见辅因子(血红素和[Fe-S]),设计并筛选出具有单一过氧化物酶活性的HCFe纳米酶,实现了底物过氧化氢反应路径的精准调控,为纳米酶催化选择性研究提供了创新思路。同时,研究进一步解析了食管鳞癌顺铂耐药的分子机制,并在体内外验证了HCFe纳米酶联合顺铂的协同增效作用。此项研究为克服肿瘤化疗耐药提供了新策略,也为纳米酶在精准医学中的应用拓展了新方向。
原文链接:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#纳米酶# #肿瘤化疗耐药#
0