Cell Stem Cell:李懿臣等发现缓解肌萎缩侧索硬化模型神经退化的新机制
2023-03-05 brainnews brainnews 发表于上海
肌萎缩侧索硬化(Amyotrophic lateral sclerosis,ALS)是一种进展迅速的神经退行性疾病,运动神经元的凋亡致使大部分病人只能在发病后存活2-5年。
肌萎缩侧索硬化(Amyotrophic lateral sclerosis,ALS)是一种进展迅速的神经退行性疾病,运动神经元的凋亡致使大部分病人只能在发病后存活2-5年。目前该疾病仍然缺乏有效疗法,而针对少数遗传型ALS的新疗法并不能治疗遗传学因素复杂的散发型ALS。因此,治疗ALS的关键在于找到可以适用于多种类型ALS的通路。
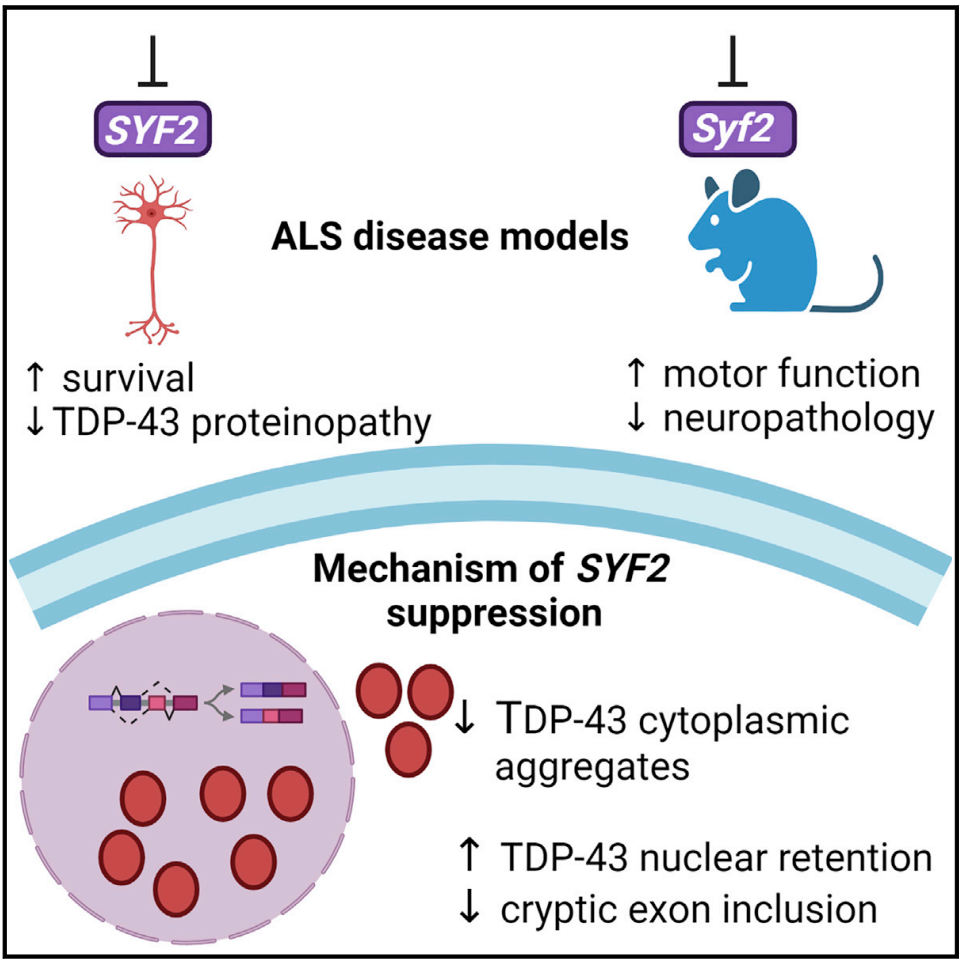
2023年2月2日,南加州大学Justin K. Ichida团队(共同一作为Gabriel R. Linares和李懿臣)在Cell Stem Cell上发表了文章SYF2 suppression mitigates neurodegeneration in models of diverse forms of ALS。作者开发了一个基于多个ALS病人诱导运动神经元(iMN)的体外存活表型筛选平台。相比于需要基因编辑单个病人人工诱导干细胞系的CRISPR筛选策略,该平台更适合于小分子筛选。作者进一步利用connectivity map分析找到与筛选到的小分子产生高度相似转录组的基因靶点,然后用ASO抑制该靶点。这样做可以把被筛选的靶点扩增到整个基因组。利用这个方法,作者发现抑制SYF2基因在多种ALS模型中均可减缓神经退化过程。

该研究通过过表达转录因子Ngn2, Isl1, Lhx3, Ascl1, Brn2, Myt1l和NeuroD1来获得iMN。在过量谷氨酸盐和缺乏神经生长因子的刺激下,针对单个Hb9::RFP+神经元追踪的延时成像技术显示ALS病人的体外iMN存活时间少于健康人体外iMN。基于这一表型,该研究从家族性ALS中占比最大的C9ORF72型开始,寻找可以将病人iMN存活天数延长至健康人组天数的小分子。并用来自8个散发性ALS(sporadic ALS)病人的iMN验证这些小分子。结果表示,鲜有分子可以同时在所有iMN上都有效果。这也再次显示了开发一款对ALS病人具有广泛保护意义的疗法意义重大。
基于每个小分子在每个病人iMN上的保护作用(通过从iMN存活曲线中计算风险比hazard ratio得出),未加监督分级的聚类分析表明最多有较广泛保护意义的小分子作用于雄激素受体通路(androgen receptor pathway)。Connectivity map分析表示抑制SYF2基因可产生类似添加这些小分子所在细胞内产生的信号改变(基于转录基因组数据)。SYF2蛋白存在于剪接体中的19复合体(nineteen complex),该蛋白在过去的研究中从未与ALS联系,因此该研究发现了一个ALS的潜在新靶点。
反意寡核酸(antisense oligonucleotides, ASO)在神经退行性疾病的新疗法开发中已显现出对病人的保护作用。为了防止长期调节雄激素受体通路所可能带来的安全隐患,作者设计并筛选出三款抑制SYF2的ASO并进一步在多种ALS病人iMN(包括27个散发性ALS)上验证其对iMN存活的保护作用。结果表明SYF2 ASO对所试验的家族性C9ORF72 ALS,家族性TARDBP-ALS和散发性ALS iMN存活有保护作用,而对家族性FUS-ALS与SOD1-ALS没有保护作用。
进一步的机制研究表明,抑制SYF2增强了神经元核内TDP-43蛋白信号,削弱了TDP-43在细胞内的沉积。超过95%的ALS病人中存在TDP-43在神经元内的异常聚合与沉积,这导致了TDP-43在核内正常功能的降低。因此,抑制SYF2帮助了有TDP-43病理的神经元存活而对不通过TDP-43病理发病的FUS-ALS和SOD1-ALS没有存活的帮助作用。该研究进一步证实,抑制SYF2不仅加强了核内TDP-43染色信号,也增强了TDP-43在核内的功能。TDP-43最被学界所认知的功能是抑制隐匿外显子(cryptic exon)进入成熟的mRNA。
在ALS神经元中,TDP-43功能的降低所引发的STMN2 mRNA中隐匿外显子的增加导致了正确的STMN2 mRNA下降。STMN2对神经突的生长与维持起着关键作用。作者通过qRT-PCR证明抑制SYF2在不改变TDP-43表达量的前提下,抑制了家族性C9ORF72 ALS与散发性ALS iMN中的STMN2隐匿外显子,提高了STMN2正确mRNA的表达量,增强了STMN2蛋白信号。作者还利用对iMN的延时成像技术证明抑制SYF2确实加快了ALS iMN神经突的生长速度与轴突切断术后的恢复速度,使两个速度到达了健康人组iMN的程度。
体内研究表明,抑制Syf2在ALS小鼠模型中也降低了多种神经退化指标。为针对TDP-43这一广泛病理,该研究使用了过表达人类TDP-43的小鼠模型。在小鼠P1 ICV注射的Syf2 ASO可以在小鼠成年时降低其皮层与脊椎内运动神经元中的TDP-43聚集,增强核内TDP-43信号,提高神经肌肉接头数量,促进体内运动神经元的存活,改善小鼠模型的多种运动功能。接受了Syf2 ASO的小鼠中未见CNS免疫反应与明显器官毒性。
增强雄激素信号通路曾在过去的研究中被和对ALS的保护作用联系在一起。而长期刺激激素信号可能带来临床上的安全隐患。该研究通过connectivity map analysis把小分子药物筛选转换成了新的基因靶点-SYF2,并且在多种ALS模型中验证了抑制SYF2的保护作用。
总之,该研究从人工诱导运动神经元的体外存活出发,从多个和ALS已知发病机制相关的角度验证了SYF2对ALS神经元的保护作用。这一研究挑战了神经退行性疾病新疗法开发中,因遗传因素的复杂性而造成的难以找到有广泛保护意义疗法的难题。我们至今尚不完全了解TDP-43的跨核膜运输方式。过去数十年的研究表明,简单的提高或降低TDP-43表达量都会造成神经元的加速凋亡,而多种尝试改变TDP-43向核内运输的研究均以失败告终。因此,该研究第一次提出了一个可以调节TDP-43功能而增强ALS运动神经元存活的方法,这样的方法对缺乏改变疾病过程疗法的散发性ALS尤其意义重大。
原始出处:
Gabriel R. Linares, et al. SYF2 suppression mitigates neurodegeneration in models of diverse forms of ALS. Cell Stem Cell, 2023.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言