天津大学刘哲教授《Biomaterials》:基于“热电材料-医用激光-微电场”药械场整合的线粒体功能失常及肿瘤治疗研究
2024-12-11 BioMed科技 BioMed科技 发表于陕西省
通过分析线粒体复合物和基质金属蛋白酶(MMP)的特异标志物,阐明了线粒体功能紊乱与免疫激活的抗肿瘤机制,发展了药械场整合肿瘤治疗的新策略。
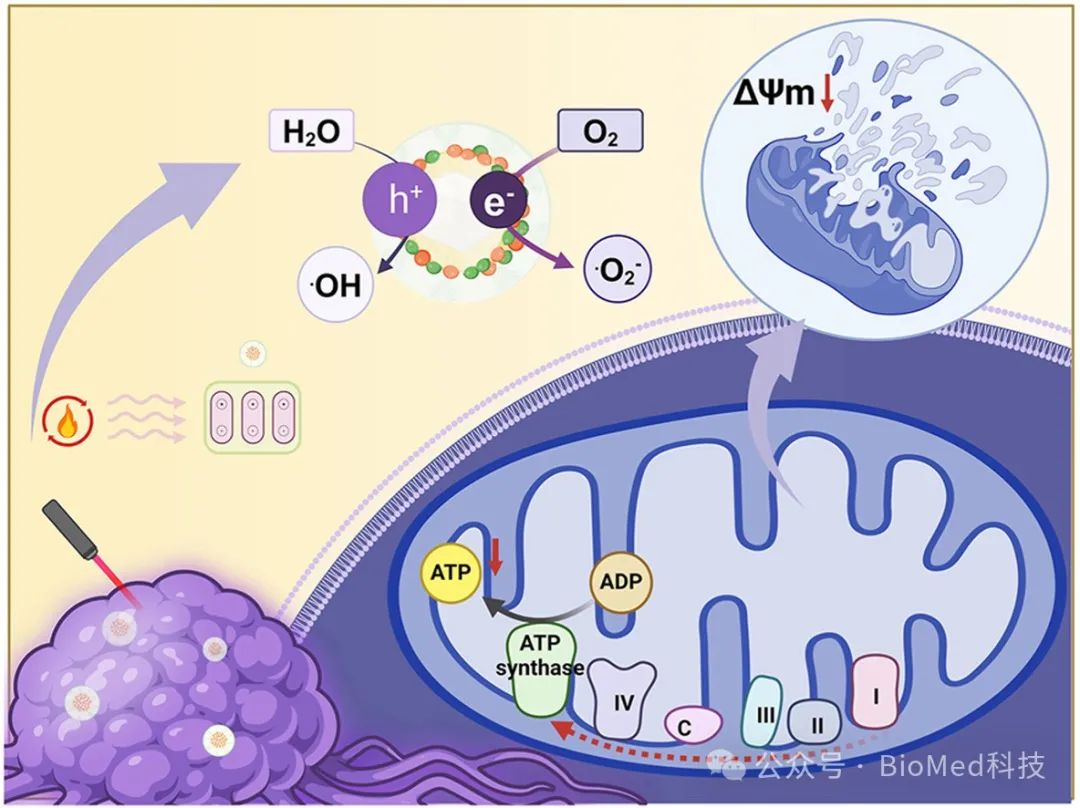
线粒体作为一种产能细胞器,在细胞存活、程序性凋亡和肿瘤发生发展过程中起着关键作用。经由氧化磷酸化产生三磷酸腺苷(ATP),并通过电子传递链(ETC)消耗葡萄糖为合成生物大分子提供能量来源。因此,线粒体电子传递链的特殊存在可引发线粒体功能失常,从而为诱导肿瘤细胞凋亡提供新靶标。绿茶中含有表没食子儿茶素-3-没食子酸酯(EGCG)这一生物活性物质,联合阿霉素(DOX)作为抗肿瘤药物,能够协同阻断线粒体电子传递链,显着降低细胞耗氧量,不仅有利于改善缺氧的肿瘤微环境,提高抗肿瘤疗效,也有利于降低常见的肿瘤治疗多药耐药性(MDR)。长期以来,药械结合(Drug-device Combination)一直是创新药物与医学设备的有效策略。我们将药物/生物材料、现有医疗器械与物理场结合,提出了药械场整合(Drug-device-field Integration)的疾病干预与治疗的新范式。场作为联结药物/生物材料与医疗器械的重要枢纽,不仅可捕捉生理变化的重要指标,而且能即时实施有效干预,关联生命元素与器械硬件双向通讯,以更便捷的方式实现生命信号的高灵敏捕获与远程无线传输。
近日,天津大学刘哲教授课题组构建了负载表没食子儿茶素-3-没食子酸酯 (EGCG)、阿霉素(DOX)的新型热电纳米复合物(BTO@PDA-FA-DOX-EGCG),用于肿瘤细胞线粒体靶向的功能失常与肿瘤治疗。同时,通过分析线粒体复合物和基质金属蛋白酶(MMP)的特异标志物,阐明了线粒体功能紊乱与免疫激活的抗肿瘤机制,发展了药械场整合肿瘤治疗的新策略。相关工作以“Drug-device-field integration for mitochondria-targeting dysfunction and tumor therapy by home-tailored pyroelectric nanocomposites”为题发表在Biomaterials。

【文章要点】
本课题组通过钛酸钡改性,制备了热电纳米复合物(BTO@PDA-FA-DOX-EGCG),由于热传导和温度变化,带正电的空穴和带负电的电子分离,原位产生微电场。在非中心对称的钛酸钡晶体中,自发极化导致表面累积大量电荷产生电流(图 1a)。通过电化学工作站,我们分析了纳米复合物 BTO@PDA-FA-DOX-EGCG 的热电效应,由电化学阻抗谱 (EIS) 和Nyquist图表征了温差-电能的转化能力。在激光照射下,温度波动导致自发极化,由于内阻降低导致电势发生变化(图1b)。与对照组相比, BTO@PDA-FA-DOX-EGCG 的存在下测得较强且可重现的热释电流,证明了纳米复合物BTO@PDA-FA-DOX-EGCG 通过高效光热转换呈现优异的热电效应(图 1c)。在周期性的温度变化中,温差导致电子-空穴分离,产生氧化还原反应,诱导产生羟基自由基 (•OH) 和超氧阴离子 (•O2−)等活性氧(ROS)(图 1d-f)。
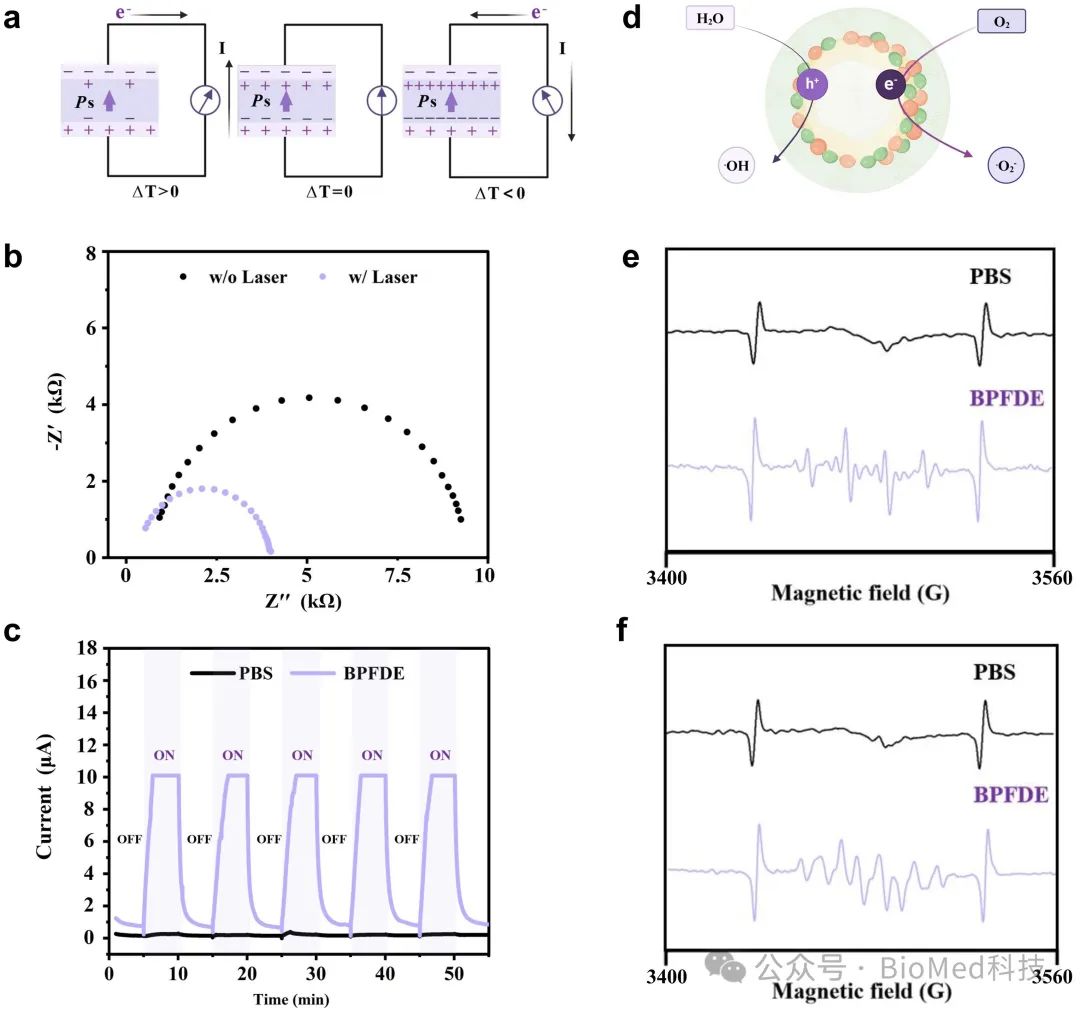
图1.纳米复合物(BTO@PDA-FA-DOX-EGCG)的热电效应与活性氧产生能力评价。
线粒体是最重要的细胞器之一,负责能量分子ATP的合成,以支持细胞生化反应及超过 95% 的能量需求。在线粒体内膜上,线粒体呼吸和电子转移链起着关键作用。我们推测,利用EGCG作为有效的线粒体靶向分子以及ETCs干扰物,可减缓或抑制ATP的生成,从而降低细胞氧气的消耗,导致肿瘤细胞线粒体功能失常,并有效改善肿瘤乏氧微环境,能够有效提高肿瘤疗效(图 2a)。将纳米复合物BTO@PDA-FA-DOX-EGCG与HepG2细胞共孵育 4 小时,发现纳米复合物内化并靶向累积于线粒体,相比之下,非靶向纳米复合物BTO@PDA-FA-DOX的累积较差(图 2b 和 c)。更为重要的是,纳米复合物BTO@PDA-FA-DOX-EGCG破坏了电子传递链,显著降低了线粒体膜电位(ΔΨm)(图 2d 和 e)。由JC-1检测线粒体膜电位,观察到BTO@PDA-FA-DOX-EGCG处理的HepG2细胞显示较强绿色荧光,表明线粒体膜电位明显下降,线粒体呼吸受阻,大大抑制了细胞耗氧量。此外,分析培养基中的葡萄糖含量和HepG2细胞的ATP水平,进一步验证了肿瘤细胞中的葡萄糖消耗受到显著抑制,细胞ATP水平明显下调(图 2f 和 g)。以上数据有力支持了纳米复合物BTO@PDA-FA-DOX-EGCG经激光照射导致线粒体功能失常,并有效抑制了肿瘤细胞HepG2的增殖活性。
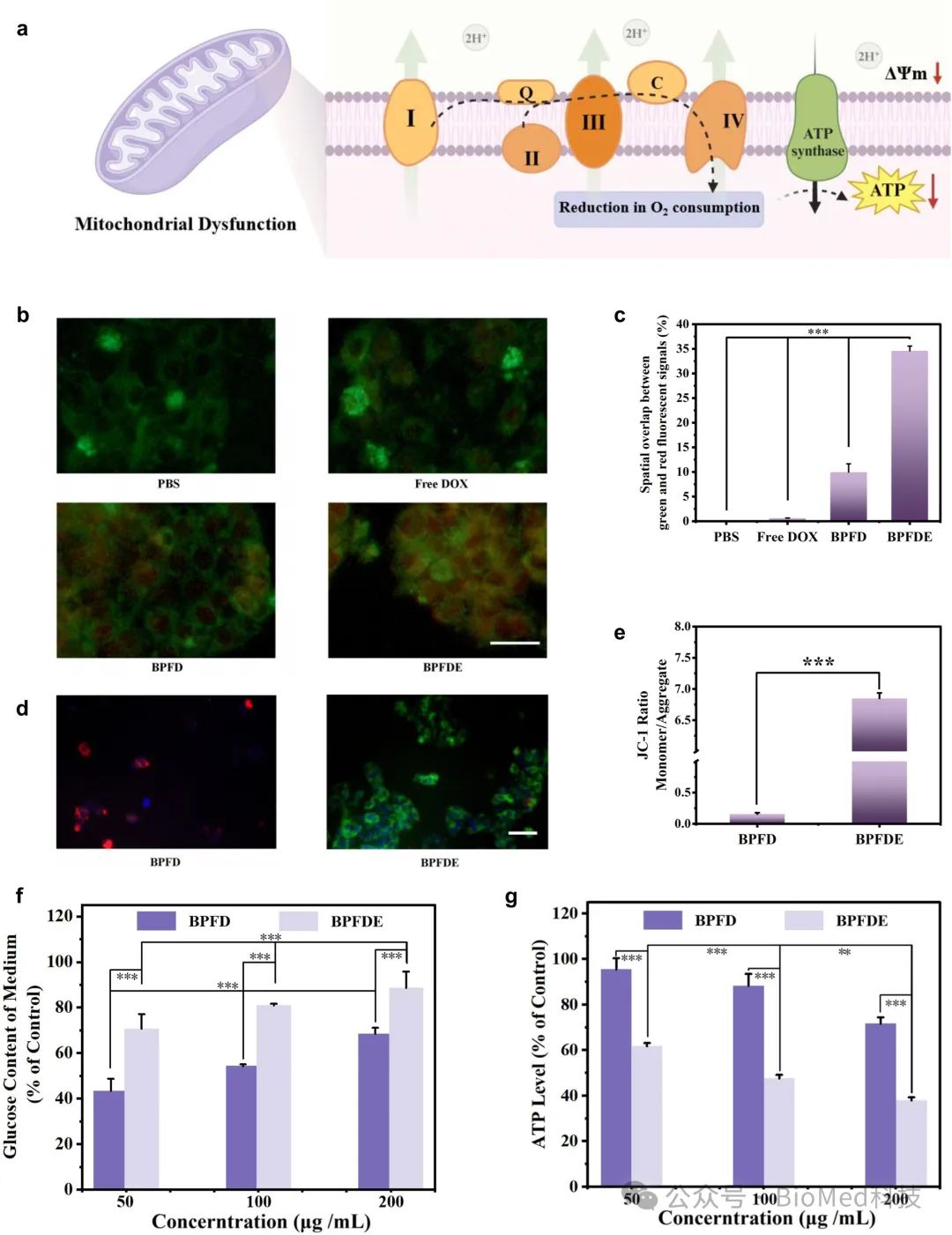
图2.纳米复合物BTO@PDA-FA-DOX-EGCG 诱导线粒体失常的机制与效应研究。
为了评价该策略对活体动物肿瘤治疗的有效性,我们将吲哚菁绿(ICG)标记的纳米复合物BTO@PDA-FA-DOX-EGCG尾静脉注射于HepG2细胞接种的裸鼠,经活体荧光成像评价其体内生物分布,选择适当的治疗窗口。与游离ICG相比,ICG 标记的BTO@PDA-FA-DOX-EGCG在注射后1 小时后快速聚集于肿瘤区域,病灶处显示高强度荧光(图3a)。注射3 小时后大部分纳米复合物清除体外,从而证实了叶酸与EGCG对肿瘤的级联靶向性。同时,红外热成像证明纳米复合物BTO@PDA-FA-DOX-EGCG经激光照射,与对照组相比呈现良好热效应(图 3b)。在此基础上,选择注射后3小时作为治疗时间点,记录15天治疗期间裸鼠的肿瘤体积与体重变化,发现BTO@PDA-FA-DOX-EGCG+激光组明显抑制了肿瘤生长,肿瘤抑制率高达98.2%,从而有力证明了这一肿瘤治疗策略的有效性、可行性(图 3c-h)。
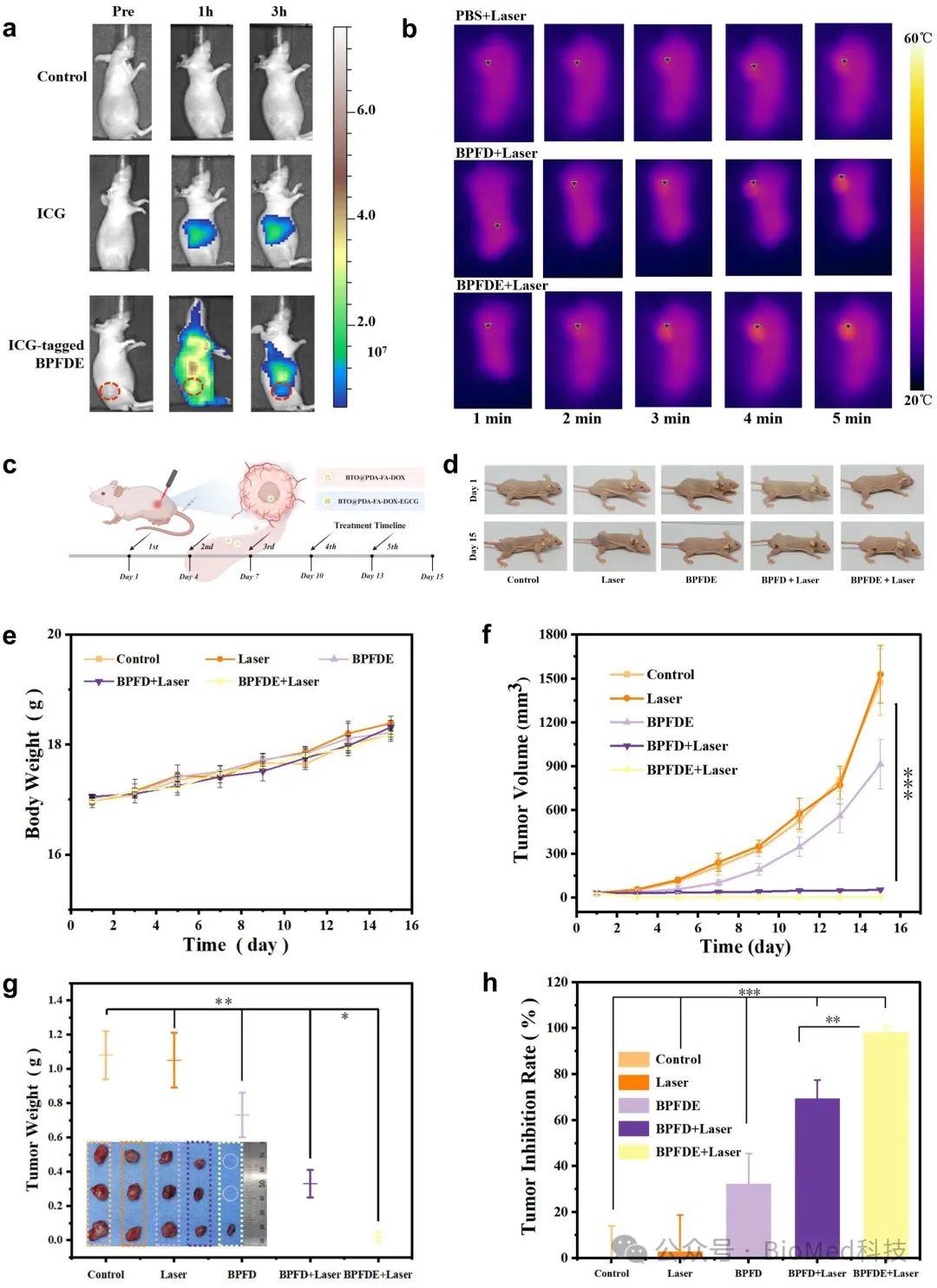
图3.纳米复合物BTO@PDA-FA-DOX-EGCG用于活体动物的药械场整合治疗研究。
此外,为了阐明这一策略的抗肿瘤机制,我们测量了不同实验组治疗后肿瘤细胞线粒体呼吸链复合物II的活性。如图4a所示,BTO@PDA-FA-DOX-EGCG+激光组线粒体呼吸链复合物II的活性急剧下降至对照组的28.8%,而BTO@PDA-FA-DOX+激光组和BTO@PDA-FA-DOX-EGCG组活性分别下降了69.5%和65.0%。这些数据表明,治疗导致线粒体电子转移链受阻,线粒体功能失常。对乏氧诱导因子1α(HIF-1α)的分析表明,BTO@PDA-FA-DOX-EGCG+激光组HIF-1α明显下调,与对照组相比下降了21.5%,表明这一治疗策略在相当程度上缓解了肿瘤乏氧微环境,通过降低线粒体活性达到消除肿瘤细胞及抑制肿瘤增殖的目的(图 4b)。
为了评价这一治疗策略的生物安全性,我们评价了治疗后肿瘤组织的病理损伤,H&E染色发现BTO@PDA-FA-DOX-EGCG、BTO@PDA-FA-DOX+激光和BTO@PDA-FA-DOX-EGCG+激光组存在明显的肿瘤细胞核浓缩、碎裂和裂解,而对照组肿瘤细胞仅略微堆积。TUNEL染色显示BTO@PDA-FA-DOX-EGCG+激光组显示HepG2细胞凋亡最为明显。Ki67和Caspase-3染色表明BTO@PDA-FA-DOX-EGCG+激光组导致大量肿瘤细胞凋亡与增殖抑制(图 4c)。纳米复合物的生物相容性与安全性则通过常规血相数据及健康器官的H&E染色来评估。血相指标均处于正常范围内,治疗后健康器官如心、肝、脾、肺、肾等未见显著损伤或潜在风险(图 4d 和 e)。通过 Western blot 分析基质金属蛋白酶MMP的表达,结果显示肿瘤组织MMP-3和MMP-9的水平清楚地反映了分化的肿瘤转移抑制,BTO@PDA-FA-DOX-EGCG+激光组的MMP-3和MMP-9灰度比BTO@PDA-FA-DOX+激光组分别降低了24.3%和20.2%,与体外MMP-3表达结果吻合, 证明EGCG在抑制肿瘤细胞增殖、外周浸润和潜在转移中起到了关键作用(图 4f)。
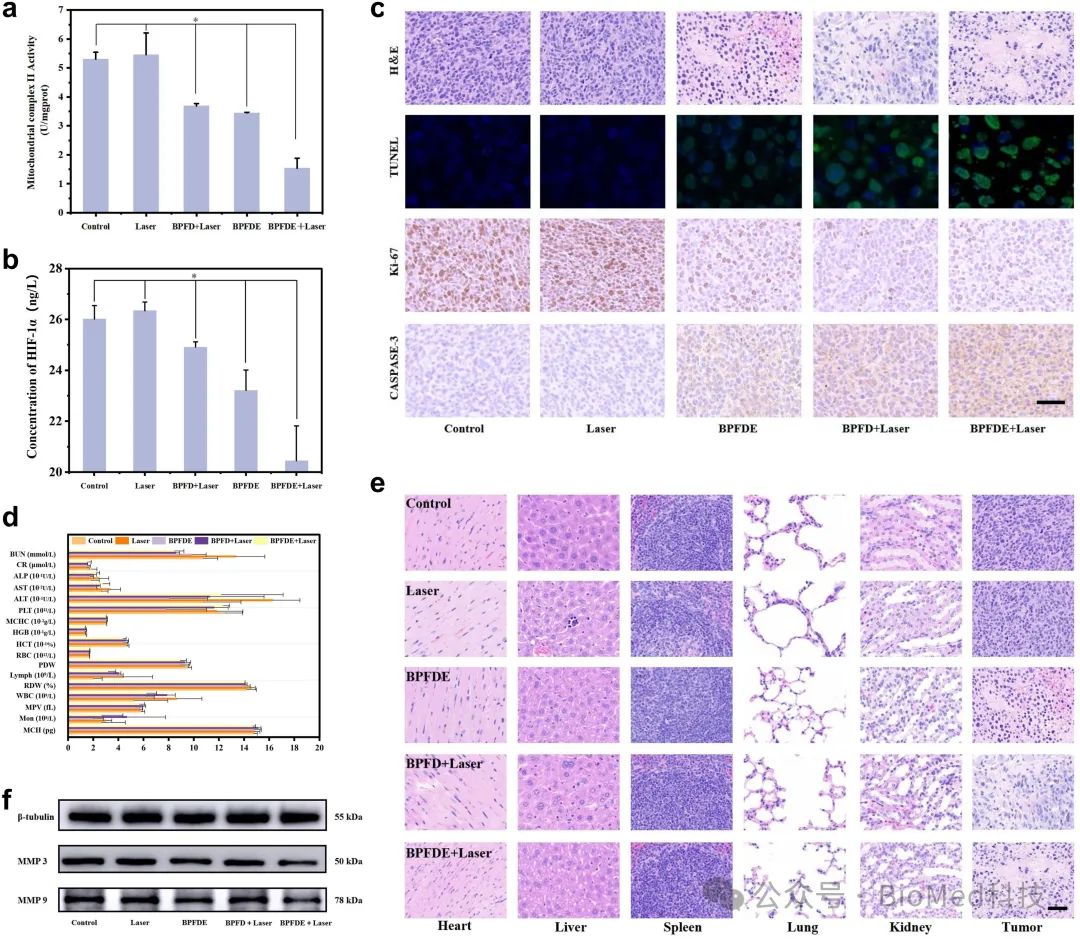
图4.不同实验组生化与免疫组化分析及抗肿瘤机制研究。
【结论与展望】
纳米复合物(BTO@PDA-FA-DOX-EGCG)实现了叶酸与EGCG对肿瘤线粒体的级联靶向(Cascade Targeting)。在近红外光照射下,聚多巴胺涂层触发钛酸钡的热电效应、实现阿霉素与EGCG对肿瘤细胞的共递送,导致细胞线粒体电子传递链的功能失常,降低了基质金属蛋白酶的表达,有效抑制了肿瘤转移。这一机制在体外细胞与活体动物等实验中得到了有效验证。该药械场整合策略融合了药物分子(DOX和EGCG)、纳米复合材料(BTO@PDA-FA-DOX-EGCG)、医用激光、原位微电场等要素,为创新疾病诊疗提供了新的研究范式,为肿瘤及其他重大疾病的治疗干预提供了温和、微创的有效途径。
【课题组简介】
天津大学刘哲教授:天津大学“北洋英才”长聘教授、博士生导师、英国皇家医学会会士(FRSM)、英国皇家化学会会士(FRSC),本科毕业于四川大学化学学院应用化学系,2007年于中国科学院化学研究所获得博士学位,后在美国斯坦福大学医学院分子影像研究中心(MIPS)、德国亚琛工业大学亥姆霍兹生物医学工程研究所从事博士后研究,聚焦智能疾病诊疗、可视化医学、影像导航手术等方向,开展基于智能医学材料的疾病干预与治疗新方法、新策略研究,主编中、英、德文学术专著6部(Springer Nature、Elsevier、化学工业出版社),参编中国肿瘤整合诊治技术等临床医学指南三项,兼任Intelligence-Based Medicine(Elsevier)、VIEW(Wiley)、Cancer Letters、BIO Integration等国际学术期刊编委。
原文链接:
https://www.sciencedirect.com/unsupported_browser
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#肿瘤治疗# #药械场#
14