2020年1-10月FDA批准的41款新药,信息大汇总
2020-10-31 网络 网络
当提到新药和治疗性生物产品的开发创新时,FDA的药物评估和研究中心(CDER)在这个过程的每一步都为制药业提供支持。凭借其对用于创造新产品的科学、测试和制造过程以及新产品旨在治疗的疾病和条件的了解,C
当提到新药和治疗性生物产品的开发创新时,FDA的药物评估和研究中心(CDER)在这个过程的每一步都为制药业提供支持。凭借其对用于创造新产品的科学、测试和制造过程以及新产品旨在治疗的疾病和条件的了解,CDER提供将新疗法推向市场所需的科学和监管建议。
新药和生物制品的上市往往意味着患者的新的治疗选择,也意味着美国公众健康护理的进步。因此,CDER支持创新,并在帮助推进新药开发方面发挥关键作用。
2020年新冠(COVID-19)肺炎疫情席卷全球,严重威胁着人类的健康和生命安全,也给经济带来了极大损失,但今年第一到第三季度,FDA的药物评价和研究中心CDER已经批准了40个新分子实体(NME)和新治疗性生物制品,不包括疫苗、过敏性产品、血液和血液(衍生)制品、细胞和基因治疗产品,比2019年同比增加48%,与2018年同比持平,见下图,推测今年全年CDER批准的新分子实体药物数量可能类似2018年,达到60个左右(见下图)。
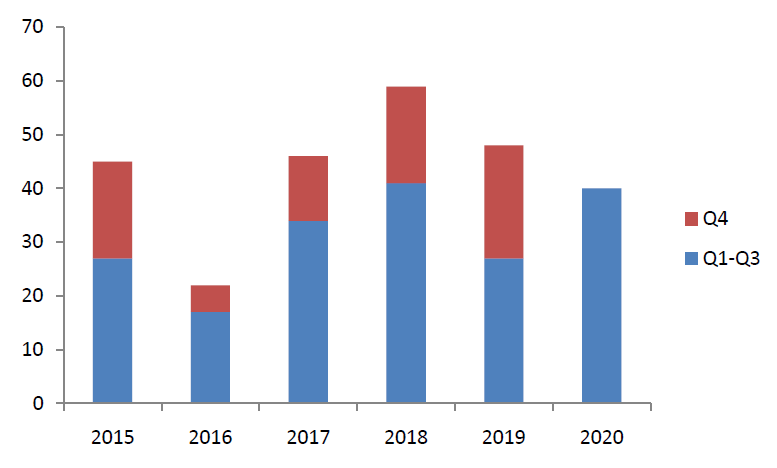
每年,CDER都会批准多种新药和生物制品。其中一些产品是从未在临床实践中使用过的创新新产品。
以下是CDER在2020年批准的新分子实体和新的治疗性生物产品的清单。该列表不包括疫苗、过敏原产品、血液和血液制品、血浆衍生物、细胞和基因治疗产品,或生物制品评估和研究中心在2020年批准的其他产品。此前信息:FDA:2020年一季度批准11款新药信息汇总
其他产品与之前批准的产品相同或相关,它们将在市场上与这些产品竞争。有关CDER批准的所有药物和生物制品的信息,请参见Drugs@FDA。
某些药物在FDA审查中被归类为新分子实体("NMEs")。这些产品中的许多含有的活性基团以前未被FDA批准,无论是作为单一成分药物还是作为组合产品的一部分;这些产品经常为患者提供重要的新疗法。有些药物出于行政管理的目的被定性为NMEs,但其含有的活性基团与FDA以前批准的产品中的活性基团密切相关。例如,CDER将根据《公共卫生服务法》第351(a)条提出申请的生物制品归类为NMEs,以便FDA进行审查,而不管FDA以前是否批准过不同产品中的相关活性基团。食品和药物管理局为审查目的将药物归类为 "NME",这与食品和药物管理局确定药物产品是否为《联邦食品、药物和化妆品法》意义上的 "新化学实体 "或 "NCE "不同。
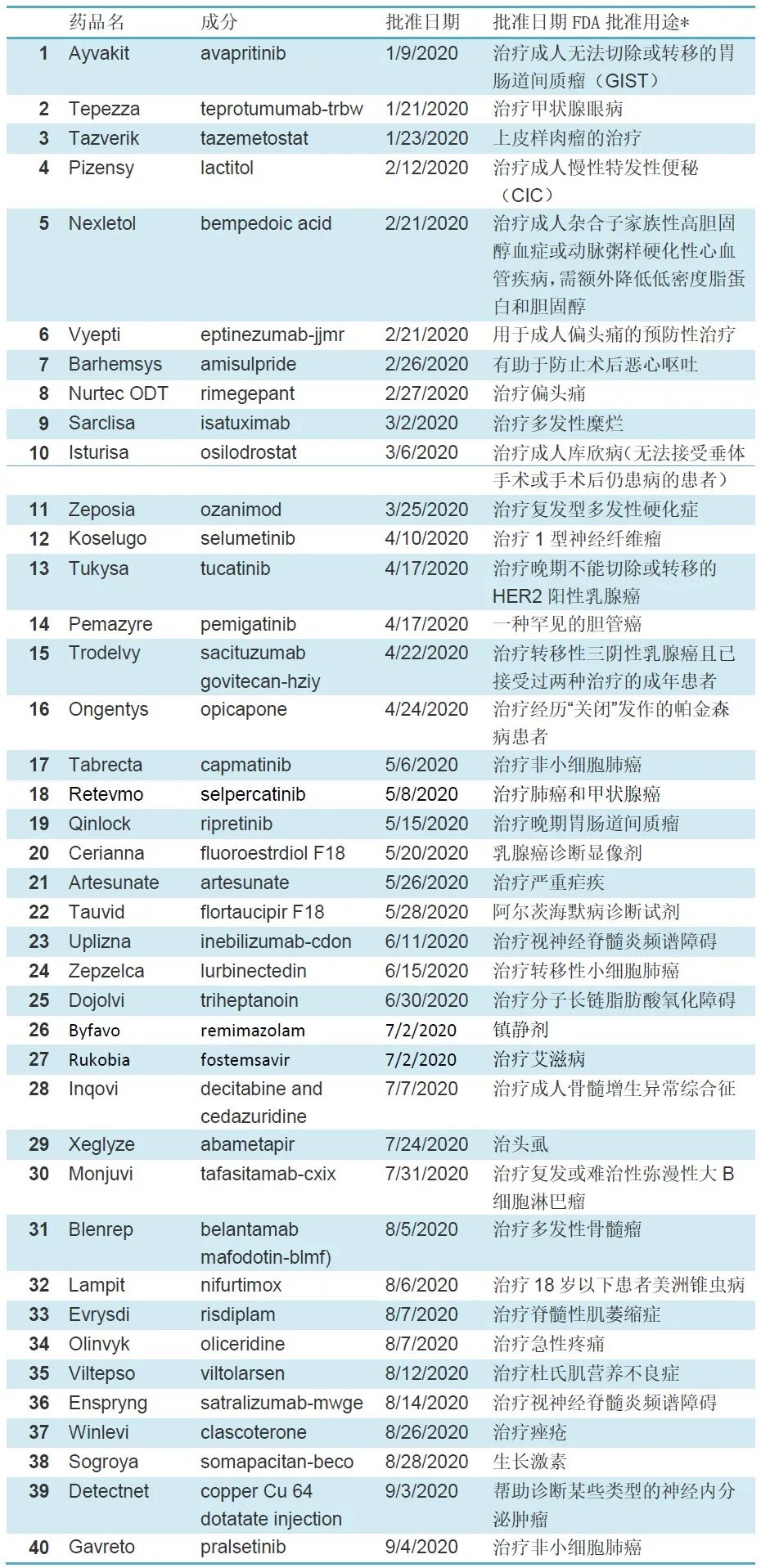
补,最新FDA又批准了一个:
再生元(Regeneron)近日宣布,美国食品和药物管理局(FDA)已批准Inmazeb(atoltivimab、maftivimab、odesivimab-ebgn,前称REGN-EB3),该药是一款三抗体鸡尾酒疗法,用于治疗由扎伊尔型埃博拉病毒(Zaire ebolavirus)引起的感染,该药可用于成人和儿童感染者,包括感染检测呈阳性母亲的新生儿。
Inmazeb是美国FDA批准的第一个用于治疗埃博拉病毒感染的药物。Inmazeb是由3种全人IgG1单抗组成的混合物,由再生元利用专有的VelociSuite®快速反应技术开发,目前该技术正被应用于开发针对新型冠状病毒肺炎(COVID-19)的新型抗体鸡尾酒疗法。
其中,最受瞩目的是以下几款药物:
1、罗氏的Evrysdi (risdiplam)
调节运动神经元2(SMN2)RNA剪接的小分子调节剂,对该药的批准标志着脊髓型肌肉萎缩治疗方式的转变。像该领域目前的市场领导者,渤健(Biogen)的Spinraza一样,Evrysdi治疗患者不需要考虑年龄或是否残疾,不同的是它是口服药物。Evrysdi另一个优势是它的价格,Evrysdi治疗成本需要参考患者的体重,一旦患者体重到达44镑,每年治疗费用上限为34万美元,这意味着对于儿童治疗费用会低得多。分析师认为这种定价差异会削弱Spinraza在市场上的竞争优势。
2、葛兰素史克公司的Blenrep (belantamab mafodotin)
该药到2026年可能达预测的12.6亿美元销售额。虽然该药是第一个靶向BCMA治疗复发/难治性多发骨髓瘤的药物,但该药有1个严重眼部毒性的黑匣子警告。此外,一些还未被批准的CAR-T疗法显示了更好的疗效,以及百时美施贵宝此前被推迟上市的 idecabtagene vicleucel即将在2021年3月获批,该领域竞争非常激烈。
3、肿瘤药物Monjuvi(tafasitamab)
在其治疗领域则竞争较少,它是目前治疗复发性/难治性弥漫大B细胞淋巴瘤的唯一二线用药,该药与Revlimid联用预计将被获批在CAR-T三线之前使用。
4、耐药型HIV患者的药物Rukobia(fostemsavir)
该领域有着巨大的市场。Rukobia是一种first-in-class HIV-1 gp120直接附着抑制剂(gp120-directed attachment inhibitor),曾获得突破性疗法、快速通道和优先评审。该药物被批准与其他抗逆转录病毒药物(ARVs)联用治疗多重耐药的HIV-1感染成人患者。其他在评审过程中获得加速通过的药物包括Viltepso (viltolarsen),治疗杜氏营养肌不良中,确诊外显子53跳跃突变患者;Olinvyk (oliceridine)治疗急性疼痛;Lampit (nifurtimox)治疗儿科Chagas疾病。
在该季度正常流程通过批准的药物,包括在家口服治疗骨髓增生异常综合症的Inqovi (cedazuridine和decitabine)和Xywav(钙,镁,钾和羟丁酸钠),后者是Jazz Pharmaceutical嗜睡症药物Xyrem的后续产品,该产品预计2023年将面对同类竞争。雄激素受体抑制剂Winlevi (clascoterone) 的获批则是痤疮治疗40年来1个新的治疗机制。反之,Enspryng (satralizumab)作为第3个获批治疗视神经脊髓炎光谱病的药物,可能很难获得可观的销售额。而Byfavo (remimazolam) 在内镜和支气管镜治疗中短期镇静的获批也伴随着1个黑匣子警告。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#FDA批准#
91
积分
131
不错
141
了解
186