Blood Cancer J:新药治疗未改善伴t(11;14)多发性骨髓瘤的结局
2023-03-22 聊聊血液 网络 发表于上海
t(11;14)可能是 IMID/PI 疗效不佳的标志。
约60%的新诊断多发性骨髓瘤 (NDMM) 患者中可检测到14号染色体易位,包括免疫球蛋白重链基因 (IGH),最常见的易位是t(11;14)(q13;q32),有15-20%的骨髓瘤患者携带。有学者假设t(11;14) 可定义具有独特生物学特征的 MM 患者亚群,包括淋巴浆细胞形态、循环浆细胞数量增加、肿瘤浆细胞中 CD20 表达、IgGλ和本周同种型、寡分泌型(≤1 g/dL M蛋白)和不分泌型。此外该 MM 患者亚组中的克隆浆细胞表现出较高水平的抗凋亡蛋白 BCL-2 表达和较低水平的促凋亡蛋白 MCL-1/BCL-XL 表达,使其易受 BCL-2 抑制。
t(11;14) 对 NDMM 患者预后的影响仍不清楚,在新药时代前后开展的几项研究结果表明,与该易位相关的预后正在逐步变化。在新药前时代,很多学者认为伴t(11;14) MM 患者具有有利的结局,然而在新药时代,尽管蛋白酶体抑制剂 (PI) 和免疫调节剂 (IMID) 等治疗改善了大多数 MM 患者的生存期,但尚不清楚t(11;14) 患者是否有相同获益。
近日《Blood Cancer Journal》发表的一篇回顾性研究中,作者估计了伴t(11;14) NDMM 的发病率,证实携带该易位的患者具有独特生物学和临床特征的亚组,并研究了化疗和新药是否影响伴t(11;14) MM的结局。


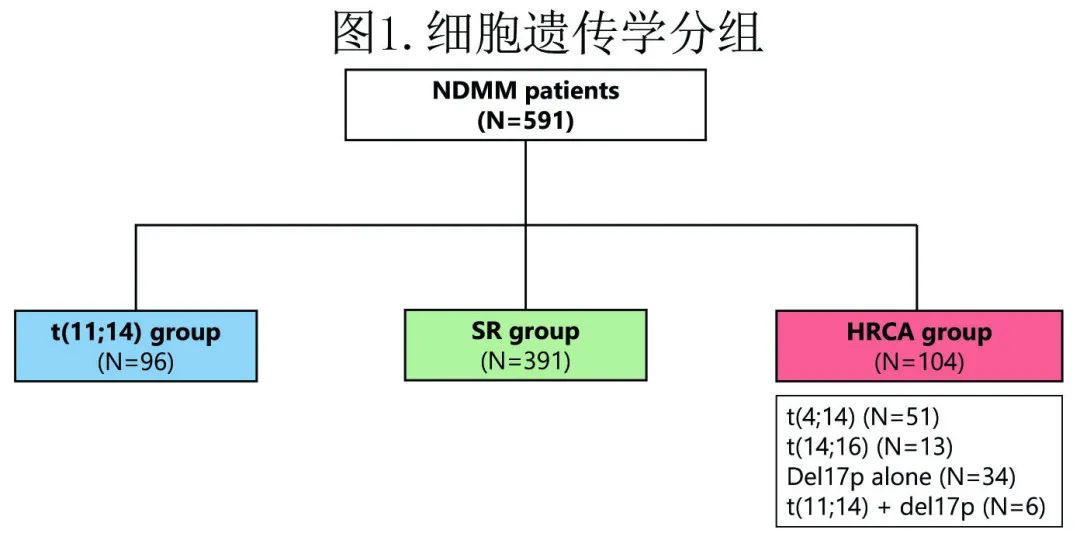
该研究为回顾性观察性研究,入组了1998年至2018年间萨拉曼卡大学医院和莱昂大学医院的MM 的患者,其中有591例患者评估了是否存在t(11;14) 易位。将患者分为3个细胞遗传学组:(1) t(11;14) 组,包括存在该染色体异常而无 del17p 的患者;(2) 高危染色体异常 (HRCA) 组,包括t(4;14)、t(14;16) 和 del17p 的患者,包括 del17p伴t(11;14) 的患者; (3) 标危 (SR) 组,包括无上述任何细胞遗传学异常的患者(仅有1号染色体异常的患者也纳入该组)。
采用的治疗策略分为新药治疗策略,包括PI、IMID和抗 CD38 单克隆抗体,以及基于常规治疗的治疗策略,如化疗(美法仑或环磷酰胺联合地塞米松/泼尼松)和综合化疗(例如长春新碱、卡莫司汀、美法仑、环磷酰胺和泼尼松;VBCMP)
患者
591例患者中有102例 (17.3%) 携带t(11;14) 易位。96例 (16.2%) 属于t(11;14) 组,391例 (66.2%) 属于 SR 组,104例 (17.6%) 属于 HRCA 组。在 HRCA 组中,51例 (8.6%) 携带t(4;14),13例 (2.2%) 携带t(14;16),34例 (5.8%) 仅携带del17p;同时携带 del17p 和t(11;14) 的6例患者分配到 HRCA 组(图1)。
总体队列诊断时的中位年龄为67岁, 344例 (58.2%) 为男性。研究中 MM 患者的临床和生物学特征总结见表1。与 SR 组相比,t(11;14) 组中 IgA 亚型(12.6 vs. 24.7%;P=0.012)或轻链κ型(51.6 vs. 63.6%;P=0.032)的患者更少,而非分泌性的患者比例显著更高(10.5 vs. 1.6%;P=0.000),寡分泌疾病的患者更多但不显著(23.6 vs. 15.2%;P=0.088);此外在t(11;14) 组中,骨髓中浆细胞≥60% (31.3 vs. 14.2%;P=0.000)的患者比例高,血清钙水平较高 (9.97 mg/dL ±1.36 vs. 9.62 mg/dL ±1.37;P=0.035),浆细胞瘤(包括骨旁和髓外)发生率较低 (17.2 vs. 38.6%;P=0.002)。与 HRCA 组相比,t(11;14) 组的 IgA 患者也较少 (12.6 vs. 30.8%;P=0.002),非分泌型患者较多 (10.5 vs. 2.9%;P=0.028);t(11;14)患者诊断时浆细胞瘤的发生率 (17.2 vs. 37.5%;P=0.011)较低,β2微球蛋白水平低于 HRCA 组 (4.49 mg/L±3.08 vs.6.44 mg/L±5.03;P = 0.002),而血红蛋白水平较高 (11.1 g/dL ±1.88 vs. 10.6 g/dL ±1.87;P=0.046)。t(11;14)、SR和 HRCA 细胞遗传学组相比,未观察到基线特征的其他统计学显著差异
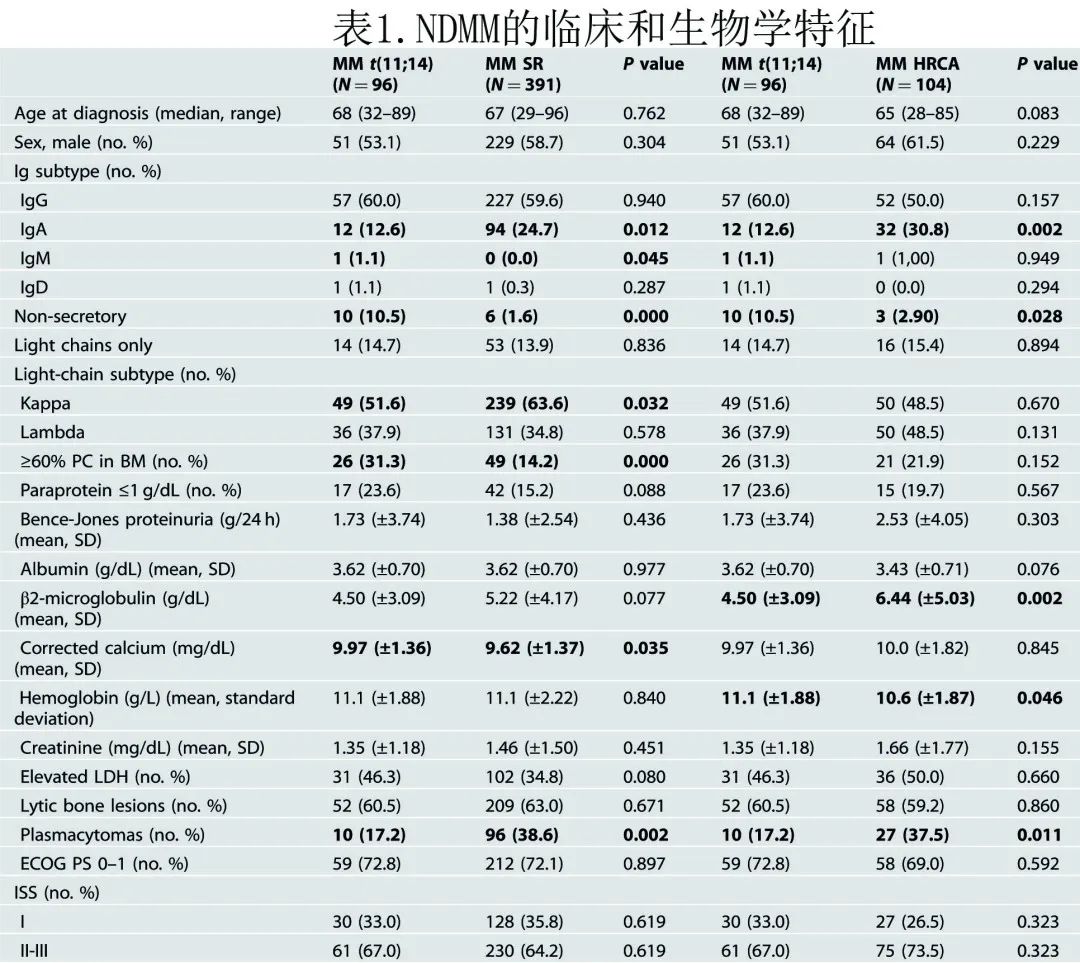
作为诱导治疗,357例患者 (63.6%) 接受新药治疗,204例患者 (36.4%) 接受常规治疗(表2)。4例患者未接受任何治疗,26例患者的治疗未知。总体而言,269例 (45.6%) 患者接受了 ASCT。
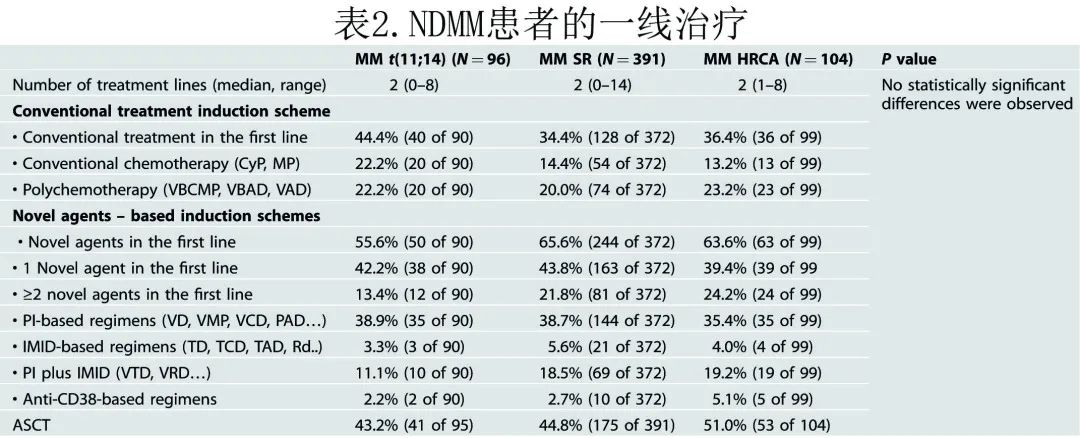
伴t(11;14) MM患者的PFS和OS
中位随访80.1个月,末次联系时239例 (41.1%) 患者仍存活,整个队列的中位 PFS 和 OS 分别为28.7个月和72.5个月,而t(11;14) 患者分别为35.3个月和75.8个月。计算了与诊断时年龄、基线特征、达到 ORR 和CR、在一线治疗中接受新药和接受 ASCT 结局的单变量相关性,然后在多变量模型中考虑显著变量。对于t(11;14) 组,诱导后未达到 CR 和β2微球蛋白≥5.0 mg/dL是PFS 的不良预后因素,未接受 ASCT 是PFS 和 OS 的不良预后因素,诊断时年龄≥65岁和诱导后未达到 ORR 为 PFS 和 OS 的独立不良预后因素。
t(11;14) 患者与 SR 组的PFS(35.3 vs. 31.1个月; HR=1.0;P=0.959)或OS(75.8 vs.87.2个月;HR=1.1;P=0.438)均无统计学显著差异,但t(11;14) 组的中位 PFS 和 OS 显著长于 HRCA 组:分别为35.3 vs. 25.4个月 (HR=1.4;P=0.030)和75.8 vs. 48.7个月 (HR=1.5;P=0.020)(图2, 3).
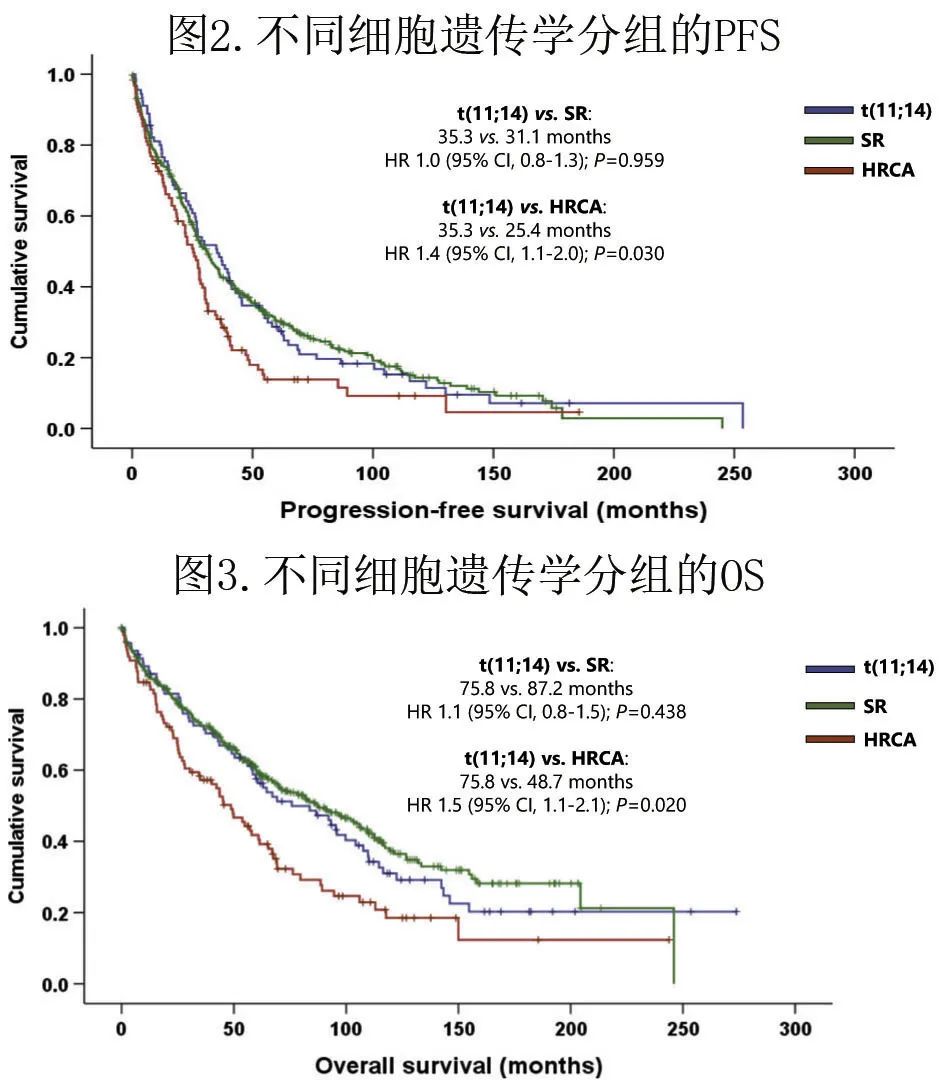
新药治疗的反应和对伴t(11;14) MM生存期的影响
整个队列和t(11;14) 患者的 ORR 分别为84.5和83.7%,CR率分别为27.0和18.6%。由于在t(11;14) 和 SR 组之间未发现 PFS 或 OS 的差异,作者进一步探索了两组中诱导治疗的潜在影响。
一线治疗中使用新药在t(11;14) 组中达到更好反应但趋势不显著,接受新药 (87.2%) 或传统 (79.5%) 药物的患者之间未观察到显著差异(比值比 (or)=1.8;P=0.336),CR 率也无显著差异 (23.4% vs. 12.8%;OR=2.1;P=0.215)。但SR组使用新药获得的缓解显著优于常规治疗:ORR为89.8% vs. 78.5% (OR=2.4;P=0.004),CR率为31.9% vs. 19.0%(OR=2.0;P=0.011)。在 HRCA 组中,尽管新药治疗的患者有缓解更好的趋势,但在ORR (86.4% vs. 72.7%;OR=2.4;P=0.110) 或CR(39.0% vs. 24.2%;OR=2.0;P=0.155)均无统计学差异(图4)。
整个队列中新药一线治疗的患者的生存期显著优于常规治疗患者,分别为PFS 31.1个月vs. 27.3个月 (HR=1.3;P=0.010) 和OS 93.2个月vs. 66.6个月 (HR=1.4;P=0.003)。与之相反,尽管新药治疗的t(11;14) 患者的 PFS 和 OS 长于常规治疗的患者,但差异均无统计学显著性(PFS 39.6 vs. 30.0个月;HR=1.2;P=0.450。OS 107.6 vs. 75.7个月;HR=1.4;P=0.175)。
随着新药逐渐纳入治疗,作者评估一线治疗中一种药物与≥两种新药相比的结局是否有差异。591例患者中有357例在一线接受新药治疗,其中67.2%接受一种新药联合治疗(通常为二联治疗),32.8%接受≥两种新药联合治疗(通常为三联治疗)(表2)。在整个队列中,接受≥两种新药的患者 (N=117) 的PFS(48.7个月)和OS(143.3个月)均显著优于接受单一新药联合治疗的患者 (N=240)(分别为25.7和67.0个月)(HR=1.7,P=0.000;HR=1.7,P=0.003)。
对于t(11;14) 组患者,在诱导期接受≥两种新药(N=12) 治疗的患者生存期更好(PFS 41.3个月,OS 143.3个月),但与接受单一新药 (N=38) 的患者相比没有显著延长(PFS 35.3个月,HR=1.1,P=0.721;OS 93.2个月,HR=1.5,P=0.413)。接受≥两种新药治疗的 SR 患者 (N=81) 的中位 PFS 和 OS 分别为54.5个月和121.5个月,显著优于接受单一新药治疗的患者 (N=163)(中位PFS 26.4个月,HR=1.8,P=0.001。中位OS 82.4个月,HR=1.7,P=0.024)。在 HRCA 组中,接受≥两种新药的患者 (N=24) 的 PFS 和 OS 长于接受一种新药的患者 (N=39)(PFS 47.2 vs. 22.9个月,HR=2.1,P=0.018。OS 69.2 vs. 43.7个月,HR=2.1,P=0.047)(图5, 6).
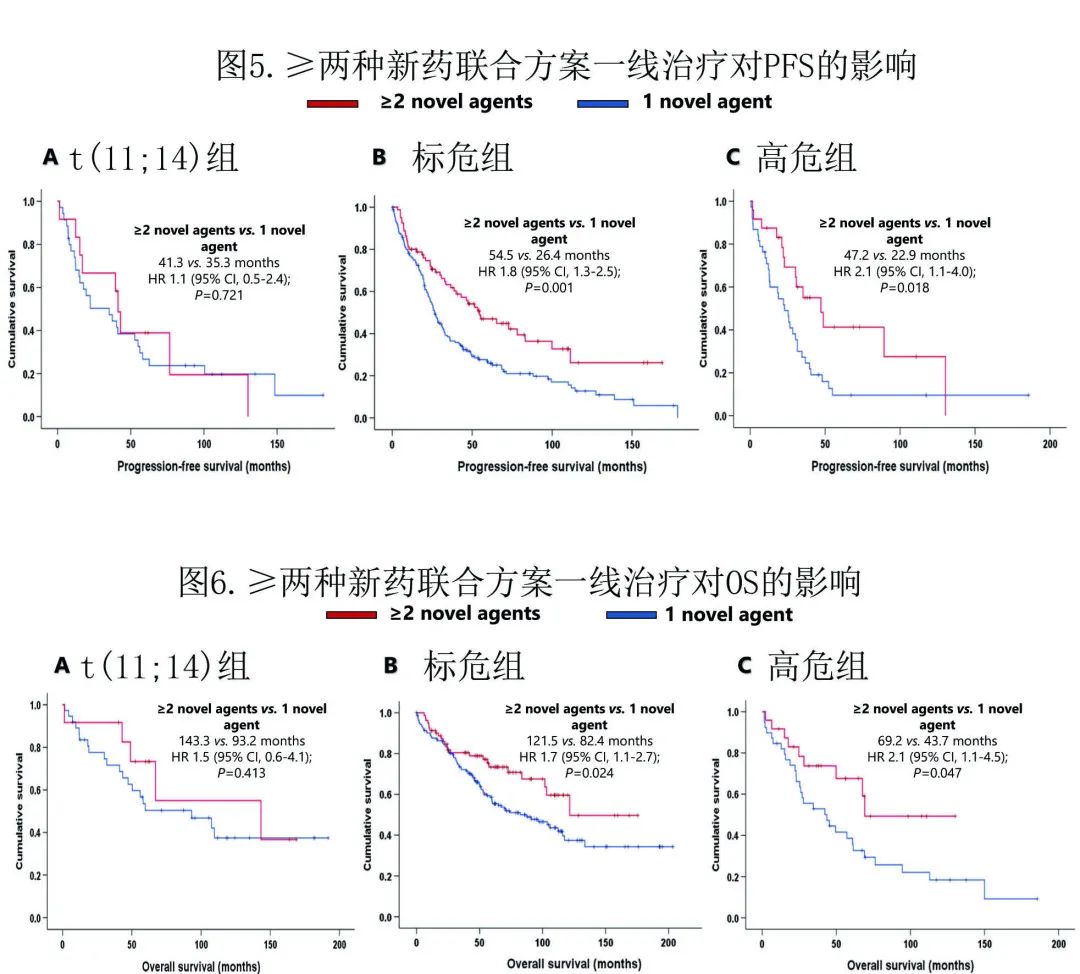
相对于其他细胞遗传学亚组,在一线治疗中引入新药并未使t(11;14) 患者获得显著更好的缓解和生存期,其生存期与 SR 组患者无差异。这就提出了一个问题,即携带这种易位的患者是否对化疗更敏感。通过测量 ASCT 后第100天的CR率和移植后反应优于移植前反应的患者比例,在适合移植的患者中分析了大剂量美法仑的作用;但排除移植前达到 CR 的患者,因为没有检测MRD。与 SR 组 (24.3%) (P=0.663) 或 HRCA 组 (41.4%) (P=0.277) 相比,t(11;14) 患者 (28.1%) ASCT后第100天的 CR率无统计学显著差异。同样,移植后缓解改善的患者比例也无差异:t(11;14) 组50.0%、SR组46.8% (P=0.753) 和 HRCA 组51.7% (P=0.893)。

该回顾性研究纳入二十年来诊断的591例 NDMM 患者,发现t(11;14)的发病率(17.3%)与其他研究一致。此外该组患者时具有独特生物学和临床特征的 MM 亚组(诊断时骨髓浸润更多,蛋白分泌更少,浆细胞瘤更少),其结局与 SR 组相似但优于HRCA组,然而一线新药治疗的缓解和生存获益不如其他细胞遗传学亚组,因此t(11;14)可能是 IMID/PI 疗效不佳的标志。
参考文献
Borja Puertas,et al. Multiple myeloma with t(11;14): impact of novel agents on outcome.Blood Cancer J . 2023 Mar 20;13(1):40. doi: 10.1038/s41408-023-00807-9
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言