如何制备一个人类胰岛类器官?
2023-11-09 干细胞者说 干细胞者说 发表于上海
本文综述了细胞起源、生物材料和用于制造人类胰岛类器官的先进技术的最新进展,并讨论了它们的优点、缺点和未来的挑战。作者望这篇综述能为构建人类胰岛类器官提供一个跨学科的视角,并为组织工程和再生医学提供见解
目前全球有约4.6亿糖尿病患者,每年有420万人死于糖尿病,我国有近1.3亿糖尿病患者。在 1 型糖尿病中,胰岛β细胞遭到机体免疫系统无情地破坏,部分或完全失去了分泌胰岛素的功能,造成体内胰岛素绝对缺乏,引起了血糖水平持续升高,于是糖尿病出现了。胰岛移植虽可以改善患者的胰岛素不足问题,但是供源不足,临床上无法大规模开展。
近年来,蓬勃发展的干细胞技术解决了一部分细胞来源问题,但也存在局限性——胰岛β细胞的转化率低、稳定性差等。因而建立一个稳定高效的胰岛β细胞制备方案很重要。
本文综述了细胞起源、生物材料和用于制造人类胰岛类器官的先进技术的最新进展,并讨论了它们的优点、缺点和未来的挑战。作者望这篇综述能为构建人类胰岛类器官提供一个跨学科的视角,并为组织工程和再生医学提供见解。
1 胰岛β细胞是目标
人类胰岛
人体的胰岛素来源胰岛,胰岛是许多大小不等和形状不定的细胞团,散布在胰腺的各处。胰岛中的细胞主要由α细胞,β细胞,δ细胞和pp细胞组成。
1型糖尿病是由胰岛β细胞受损,导致胰岛素分泌绝对不足造成的。
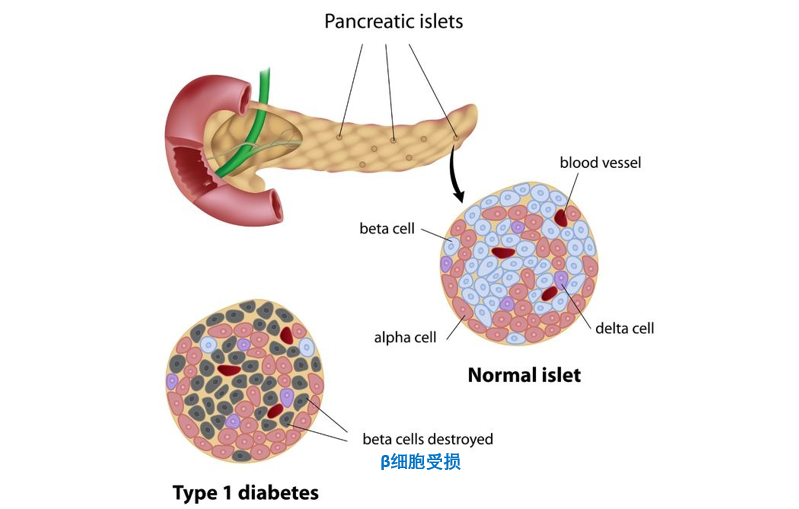
1型糖尿病发病机制
胰岛素是机体内唯一可以降低血糖的激素,由胰岛β细胞分泌而来。针对 1 型糖尿病,想要拯救分泌不足的胰岛素,生产源源不断的可分泌胰岛素的 β细胞是目标。
类器官
类器官(Organoid),最早定义是通过细胞分离和重聚来模拟器官发生。自2009年,荷兰科学家Clevers团队开发小肠类器官以来,类器官的定义变成了由器官特异性细胞组成的三维(3D)结构,其来源于多能干细胞(PSC)或成人干/祖细胞。
类器官organoid被描述为“体外微型器官”或某种程度上的“人造器官”,可模拟体内器官景观,展示体内发现的一系列细胞类型,并展示器官功能的某些方面。Organoid技术已经成为一种工具,可弥合细胞和组织/器官水平的生物模型之间的差距,在保留某些生理功能的同时,更真实地描述体内组织的空间组织以及细胞和细胞外环境之间的相互作用。
在过去的十年中,胰岛类器官作为一种很有希望的糖尿病模型引起了越来越多的关注,它可以揭示胰岛相关疾病的机制,并且是一个测试药物效力和毒性的良好平台。例如,胰岛类器官可以填补我们有关早期(8周妊娠)和晚期妊娠人类胰腺组织(妊娠22周)的人类胰腺发育知识的空白,有望成为糖尿病治疗中移植的新胰岛资源。
2 制造人类胰岛类器官的细胞
构建胰岛类器官,需要胰腺内分泌细胞。适合构建胰岛类器官的细胞类型,包括:1)人类多能干细胞来源的胰岛细胞;2)通过去分化和再分化在成人胰岛中富集的胰腺内分泌细胞;3)非胰岛谱系细胞(如导管、腺泡细胞和肝细胞)。
不同方案制备胰岛类器官,在结构和功能上存在显著差异。同时,辅助细胞(包括内皮细胞和间充质细胞)在胰岛类器官形成过程中有促进作用(图1)。
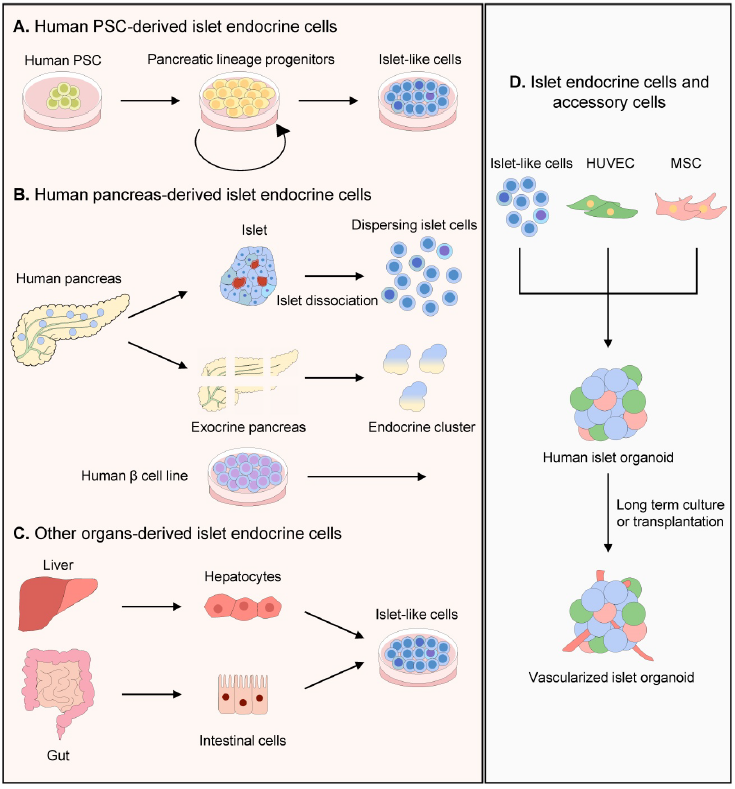
PSC衍生的胰岛细胞系
多能干细胞(PSC),包括胚胎干细胞(ESC)和诱导性多能干细胞(iPSC),都是理想的胰岛细胞来源。
从PSC获得β细胞是一种很常见的方法,利用PSC衍生的胰岛内分泌细胞制造3D人类胰岛类器官。早在2001年,hESC系H9通过悬浮培养中形成了类胚体的形态。在分化19天后,这些类胚体平均有1–3%的胰岛素阳性细胞和更复杂的结构(如上皮或内皮样细胞结构)。随后,从PSC中提取的胰腺内分泌细胞可以体外培养富集,形成簇状结构。
人ESC来源的胰岛素生成细胞也可以自我聚集成胰岛素阳性簇,并通过移植或与人脐静脉内皮细胞(HUVECs)混合实现血管化。
除了PSC衍生的内分泌细胞外,内胚层祖细胞也可能是胰岛类器官生成的一种有希望的资源,这可能会大大缩短体外培养时间并降低经济成本。
来自人类胰岛或非胰岛谱系的胰岛内分泌细胞
人类胰岛细胞也是胰岛类器官的一种细胞来源。在研究中,人类胰岛被制成单个细胞,并重新聚集成具有标准尺寸的小胰岛类器官,也被称为假胰岛。重新聚集的人类胰岛的形态与天然胰岛相似,可以改善糖尿病小鼠的糖尿病逆转。
由于成熟胰岛内分泌细胞的增殖能力有限,替代方案可能是制备大量的胰岛素生成细胞。在这些研究中,通过扩张成人胰腺组织或从胎儿胰腺消化的胰腺祖细胞成功生成了人类胰岛类器官。
此外,来自β细胞去分化的内分泌祖细胞可以分化为NGN3阴性、激素阳性的β(胰岛素)、α(胰高血糖素)和δ(生长抑素)类细胞。另一项研究说明了利用仿生支架构建细胞间和细胞-基质连接,以诱导β细胞去分化,从而进行再分化。或者,内胚层来源的分化细胞的反式分化也应用于胰岛类器官的生成,例如肝脏、胃肠道上皮和外分泌胰腺细胞。然而,脱分化和再分化的不同培养效率因情况而异,胰岛的扩增也存在很多争议,这限制了从成人组织中提取胰岛类器官的发展。因此,人们一直致力于寻找具有向内分泌细胞扩张和分化能力的成年胰岛内分泌祖细胞。有报道在成年小鼠胰腺中发现的新的PRORC阳性内分泌祖细胞可以在成年体内平衡期间生成新的内分泌细胞。
在体外,这些PROCR阳性的前体细胞可形成以β细胞为主的功能性胰岛类器官,并被α、δ和PP细胞包围。然而,人类胰岛是否包含对应的祖细胞群仍不清楚。与PSC衍生的内分泌细胞相比,利用成人组织中的细胞可以避免移植后形成畸胎瘤的风险,糖尿病患者的胰腺细胞可以成为生成人类胰岛类器官的更自然的来源。
胰岛类器官的辅助细胞
内皮细胞和间充质细胞等也对胰岛的存活和功能起支持作用。胰岛有丰富的血管供应,为人类胰岛提供充足的氧气、营养供应、微调血糖传感和调节。内皮细胞可以产生多种因子,如结缔组织生长因子、骨形态发生蛋白2(BMP-2)和BMP-4,可增加人ESC衍生的胰腺祖细胞贴壁培养中胰岛素的表达,并介导胰岛特异性成熟。例如,HUVEC或内皮细胞已与人类胰腺祖细胞或内分泌βH1β细胞混合,以促进胰岛类器官的自我聚集、成熟和血管化[35、39、57]。除了外源性添加内皮细胞外,内皮生长因子还可以诱导人胰岛类器官的血管生成。
血管生成素-2已被证明在胰岛类器官内诱导VE钙粘蛋白+内皮细胞和NG2+周细胞的广泛传播。此外,血管生成素-2可以部分补充内皮细胞对β细胞的体内旁分泌刺激,通过促进F-肌动蛋白重塑和调节钙离子内流动力学,使人类胰岛类器官具有天然的葡萄糖刺激胰岛素分泌水平。
MSC也参与胰岛样类器官的构建,包括自组织、血管网络的构成和旁分泌功能:
(a)间充质细胞触发自凝,这种由肌动球蛋白细胞骨架轴产生的牵引力导致细胞群的定向和剧烈运动。
(b) 在肌内人胰岛移植模型中,除了触发自凝聚外,间充质细胞还支持内皮细胞相互作用:人胰岛内皮细胞从移植中心迁移到周围组织,与受体内皮细胞形成嵌合血管;
(c) 据报道来自骨髓的大鼠间充质细胞通过释放HGF和TGFβ等营养因子,在水凝胶环境中支持包裹的小鼠胰岛,葡萄糖激发后胰岛素分泌增加。
3 制造人类胰岛类器官的材料
人胰岛类器官中的生物材料可以为细胞提供3D结构的支持、细胞外环境(ECM)的模拟以及在移植后的隔离保护。
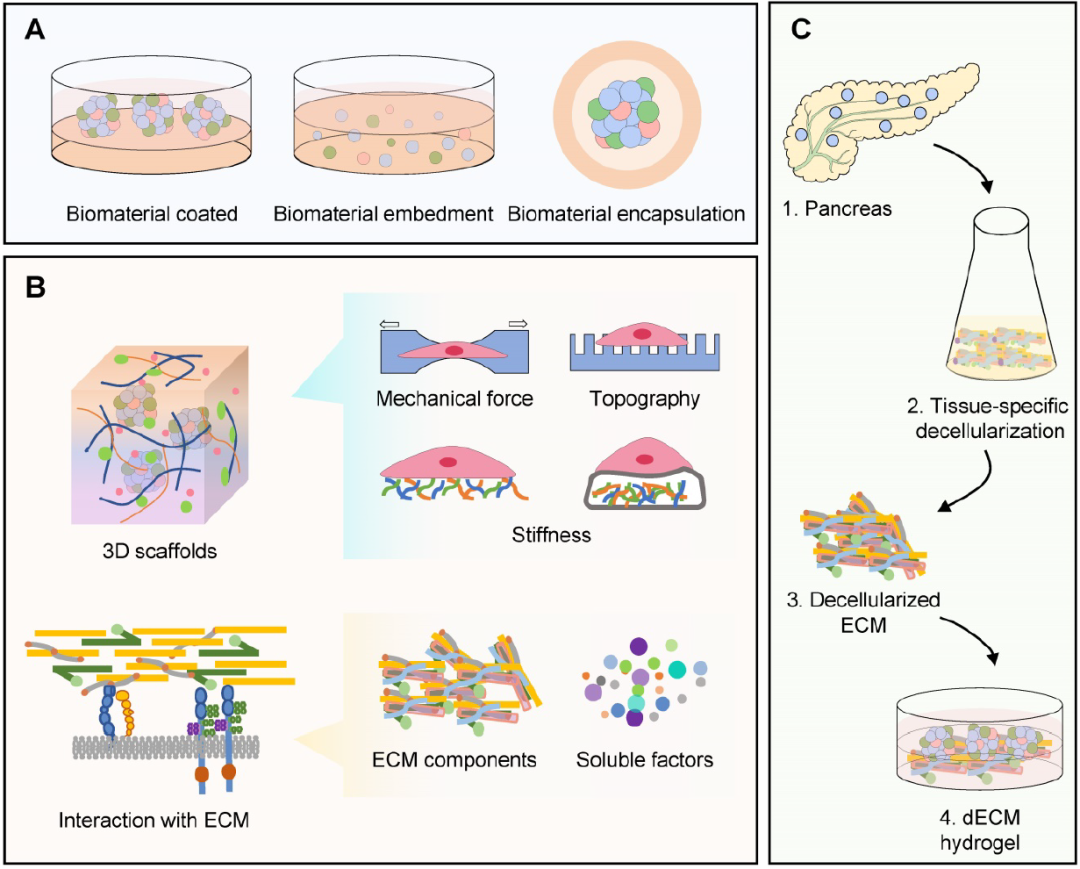
用于人胰岛类器官构建的天然基质
天然基质是细胞外基质(ECM)衍生物或类似物,可模拟体内组织或器官的天然ECM。天然基质分为三大类:多糖材料、蛋白质/肽基材料(如胶原蛋白、明胶、弹性蛋白和纤维蛋白)和脱细胞ECM材料。
多糖材料
多糖材料由于具有快速凝胶特性,适合在体外制造3D支架。
1980年,首次将海藻酸钠应用于生物人工内分泌胰腺的胰岛微囊化。海藻酸钠可以保护胰岛细胞在移植后免受炎症反应的影响。海藻酸钠还可以通过包裹来源于PSC的胰腺内分泌祖细胞,用于生成人类胰岛类器官。缺点是海藻酸钠细胞粘附和细胞相互作用能力较低,无法提供细胞存活所需的细胞锚定。
2020年,海藻酸钠和壳聚糖组成的胶囊,用于生成人类胰岛类器官。该胶囊具有高度的均一性,通过包封来自iPSC的胰腺内分泌细胞,为人类胰岛类器官提供3D培养。基于多糖材料在体外支持3D支架和模拟ECM生成人类胰岛类器官方面显示出巨大潜力。
蛋白质/肽基材料
蛋白质/肽基材料由存在于天然ECM中的基质蛋白制成,包括胶原蛋白、明胶、层粘连蛋白、纤维连接蛋白和弹性蛋白。在这些蛋白质中,胶原蛋白是种类最丰富的结构蛋白,已被广泛用于三维干细胞培养。除了为胰岛类器官构建人工3D结构外,基于蛋白质的材料还将增强胰岛类器官的功能和成熟度。
如I型胶原和IV型胶原的高表达被证明有助于人类胰腺的发育,I型胶原和IV型胶原的结合将导致培养的人类胰岛中胰岛素基因的表达高于纤维连接蛋白或层粘连蛋白。V型胶原基质的存在促进了人类胰岛类器官的再生和葡萄糖反应性激素的产生。
脱细胞ECM材料
脱细胞ECM(dECM)材料从脱细胞组织/器官中获得。dECM材料可以更好地模拟体内组织或器官的生态位。
体内ECM具有组织特异性成分,包括特异性生长因子和大分子成分,以及机械性能。因此基于dECM的材料不仅可以作为支架,可用于在体外培养中确定特定的细胞命运。脱细胞胰腺ECM基材料成为改善胰岛细胞微环境的合适基质,并促进人PSC向胰岛细胞分化。在胰腺dECM材料上从PSC分化的细胞显示出与天然胰岛相似的细胞组成,并呈现出胰岛标志物表达增加和更多胰岛素分泌以响应葡萄糖刺激。
总的来说,dECM的材料为细胞提供了一个近乎自然的微环境,但有几个限制妨碍了它们的临床应用:
a)获得dECM凝胶的过程,包括脱细胞、提取和纯化,既耗时又昂贵;
b)原材料资源,尤其是生物质资源的批次间可变性;
c)几乎不可能控制生物物理性质和生化成分;
d)这些凝胶来自可能遭受细胞相容性和病原体传播的生物体。
用于人类胰岛类器官构建的合成基质材料
用于药物治疗的合成基质材料通常具有生物相容性和无毒性,具有可控性、再现性、降解性和良好的机械性能等优良特性。
常见的合成聚合物包括聚乙二醇(PEG)及其衍生物、聚乳酸(PLA)、聚乳酸-乙醇酸(PLGA)、聚乙烯醇(PVA)、聚己内酯(PCL)。根据具体应用,合成基质可以定制为不同的特性,例如,提供ECM特性以增强体外细胞间的相互作用,并模拟天然胰岛的硬度,这使得合成基质成为一种有前途的基质材料。
PCL是一种具有高机械稳定性的生物相容性和生物可降解聚酯,通过将PCL与价格合理、热稳定性高、亲水性强的PVA混合,可以改善其较差的细胞亲和性。基于PEG的基质也是一种多功能工具,用于模拟细胞微环境,并为人类胰岛类器官提供平台。
与悬浮培养相比,由PEG/胶原蛋白I混合基质制成的3D培养平台对人类胰岛类器官具有优势:
a)能够长期培养胰岛类器官
b)保持聚集大小和形态
c)不会对胰岛分化产生不利影响
d)提供聚集恢复的手段。
为了改善合成基质的低细胞-基质相互作用,科学家将天然成分与合成聚合物混合,例如明胶/PLGA和PEG/胶原I基质,它们也被定义为半合成基质材料。
4 人胰岛样类器官的制备方法
3D培养为类胰岛提供一个更真实的环境和结构组织,类似于天然人类胰岛。构建的标准方法包括传统的自聚集法、改良的自聚集法和水凝胶包埋法。还将讨论3D生物打印、脱细胞器官支架和芯片上器官等新出现的方法(图3)。
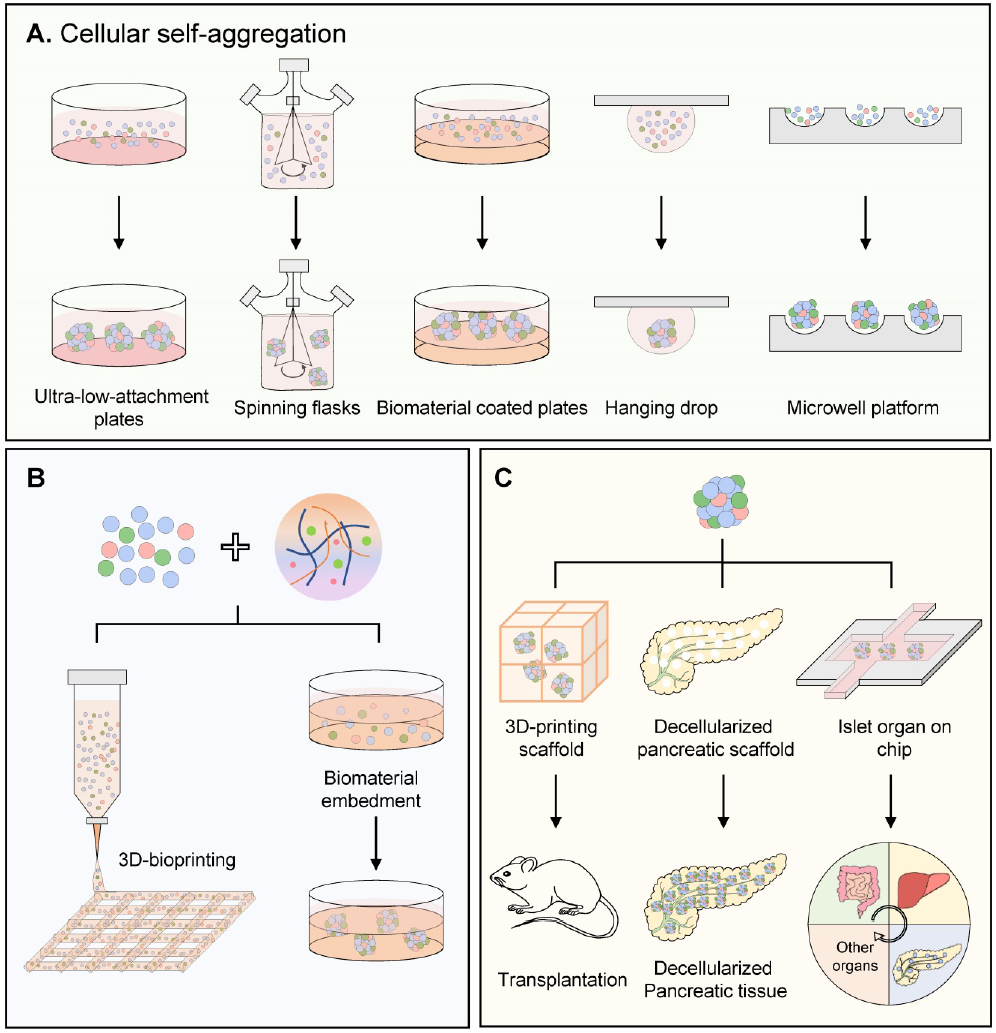
胰岛类器官三维结构的传统细胞自聚集
细胞自聚集(自组织),是一个分离的细胞可以自组装成组织样结构的过程。低粘附性培养材料、辅助细胞和软基质等因素,均可促进细胞自聚集。
例如,低附着板可以刺激人PSC衍生的游离胰腺祖细胞、内分泌细胞或人β细胞自发聚集成3D胰岛样器官。提供悬浮培养条件的旋转烧瓶可以诱导胰岛类器官的3D结构。将人胚胎干细胞悬浮在旋转瓶中形成类胚体,获得3D结构,然后进行逐步的胰岛内分泌分化。此外,间充质细胞可以帮助启动自我聚集,并改善聚集功能。MSCs触发的自组织胰岛样类器官被放置在3D打印的组织捕捉器中,并植入小鼠体内90天,具有检测血管、更多胰岛素阳性细胞和人类C肽分泌。软基质也有助于细胞的自聚集。
因此,传统的体外细胞自聚集可以产生令人印象深刻的类器官微观和功能复杂性。然而,由于缺乏预先定义的外部模式指示,传统的细胞自聚集总是会导致聚集维度变化很大的异质类有机物群体,每个聚集体的细胞数量被认为在细胞簇分化和功能性中发挥作用。
胰岛类器官三维结构的改良细胞自聚集
确定簇的大小对于人类胰岛类器官的生成非常重要。无论是体外培养还是植入,与小尺寸胰岛相比,大尺寸胰岛都会导致坏死增加和细胞活力降低。小型人类胰岛类器官(250个细胞)的细胞胰岛素含量比大型同类器官(1500个细胞)高2.8倍。
为了获得同质大小的类有机物,相应地开发了用于某种程度上受控的细胞自聚集的替代方法,例如悬滴、微接触打印和微孔平台。
悬滴法通过重力形成细胞团,通常用于胚状体的形成,完全不接触任何人工支持基质或表面。Montanari及其同事报道通过将单个人类胰岛细胞与悬挂的微滴中的MSC混合而生成胰岛类器官的方法,这些微滴在体内具有功能性胰岛素分泌。通过悬滴,可通过改变细胞悬浮液浓度、液滴体积和培养时间来调节胰岛类器官的大小。然而这种方法是劳动密集型的,不适用于大型工程。
Mendelsohn及其同事报告了一种微接触打印策略,通过在玻璃盖玻片上打印共价连接的细胞粘附蛋白层粘连蛋白斑点。这项技术提供了对细胞簇形状和大小的特殊控制,而高速打印使生产β细胞聚集体的高通量方式成为可能。然而,这些细胞簇只有两到三层细胞,甚至不能从基质上移除。因此,它们也不适用于胰岛模型、生物学试验或植入。
微孔可能是一种有希望的基于自组织的胰岛类器官生成方法。微孔由多个微米大小的腔室组成,通过光刻或微图案化产生,材料范围广泛,如聚二甲基硅氧烷(PDMS)、聚乙二醇和琼脂糖水凝胶。在琼脂糖微孔平台上,细胞被捕获并聚集成葡萄糖反应的“假胰岛”或大小稳定且均匀的胰岛素产生类器官,这提高了移植后胰岛细胞的存活率。此外,凹形微孔底部较薄,增强了大鼠胰岛球体的透氧性,因为在充足的供氧条件下,胰岛球体呈现出长期可持续性、增强的生存能力和增加的激素分泌。经证明,涂有组合ECM蛋白的薄膜微孔阵列支架可促进人类胰岛功能和存活率。然而微孔仍然存在局限性,例如细胞聚集体的尺寸范围狭窄、微孔制备所需的特殊程序以及细胞分布的低可控性。
此外,尽管带有悬浮液的自聚集类有机物显示出极好的营养扩散,但缺乏某些物理化学支持,如自然器官生态位,会降低胰岛类有机物的稳定性和细胞活力。
基于水凝胶的人胰岛类器官包埋和封装
除自聚集外,将细胞包埋在水凝胶基质中也是建立胰岛类器官三维结构的一种很有前途的方法。在这种方法中,分离的细胞颗粒通常悬浮在聚合物溶液中,直到细胞均匀分布,然后通过聚合物的交联形成水凝胶。水凝胶基质为聚集细胞提供初始指导,并作为胰岛类器官形成的后续物理支持和约束。
将人类ESC与I型胶原和基质凝胶溶液的混合物包埋,形成初始半径为8 mm、厚度为2.5mm的3D支架,可建立胰岛类器官。在另一份报告中,人类胎儿胰腺组织的小块被包裹在Matrigel中,并扩展成具有胰岛内分泌命运的类器官。
将细胞包埋在水凝胶中建立的胰岛类器官不仅可以形成胰岛细胞的三维结构,提供模拟胰岛自然生态位的细胞-细胞外基质相互作用,而且有助于其长期存活。为了维持移植后胰岛在体内的可持续性,“胰岛包裹”可能是一个很好的策略。包封方法就像一个胶囊,由被基质材料包围的胰岛组成。
Stock及其同事用聚乙二醇-马来酰亚胺(PEG-MAL)与二硫代PEG(SH-PEG-SH)交联制成的保形涂层,并辅以PepGel肽和PEG低聚乙硫醚(PEG-OES)纳米纤维,将源自人类干细胞的类胰岛有机物包裹起来。在这项研究中,胰岛样类器官在体外与未包封的胰岛保持相当的胰岛素分泌曲线和刺激指数长达7天,甚至可以防止在海藻酸钠和聚乙二醇-海藻酸钠较大微囊中包封的胰岛中可见的中央坏死。此外,将胰岛类器官移植到糖尿病小鼠体内,使糖尿病得以长期逆转,并在没有免疫抑制的情况下维持正常血糖80天以上。
但这种封装应用仍存在一些局限性:由于封装的胰岛较小,植入的胶囊无法固定在精确的位置,也不容易从患者身上完全取出;当包封在更大的配置中时,存在扩散问题,导致氧气扩散不良,严重损害胰岛的生存能力;封装后胰岛的寿命和扩展性仍不足以满足后续医学应用。
人胰岛类器官的三维生物打印
通过3D生物打印技术构建人体类器官受到了特别关注。通过模仿器官的自然异质结构,类器官形成有望在所需位置定位不同类型的细胞,或在特定位置诱导祖细胞成为所需类型,如打印。3D生物打印技术能够以高精度和可重复性将所有组件打印和模式化为3D结构,包括空间分布的细胞、生物材料(bioink)和生物活性因子。因此,3D生物打印提供了构建类器官的理想策略。
在胰岛方面,通过3D打印,PLA和纤维蛋白水凝胶被用于容纳人PSC衍生的β细胞簇。在移植到小鼠体内后,SC-β细胞嵌入3D打印设备可运行12周,可回收,并保持结构完整性。Duin及其同事通过3D挤压生物打印技术制作了具有嵌入大鼠胰岛的大孔水凝胶结构。这种大孔结构可以增加表面与体积的比率,并将胰岛与周围体液/血管之间的距离减少到几百微米以下。在培养过程中,检测到具有特定几何形状的嵌入bioink(褐藻酸盐和甲基纤维素)中的胰岛,其存活率约为80%,葡萄糖反应性长达七天。
此外,3D生物打印技术通过其重建复杂形态和多细胞环境的潜力,在制造具有血管结构的胰岛组织样结构方面发挥了独特的作用。基于3D海藻酸钠-明胶生物打印技术,制作了一种具有小鼠胰岛(核心)和内皮祖细胞(保护壳)的同轴结构。在这项工作中,3D生物打印被证明可以精确控制多种细胞类型的分布,这有可能改善血管重建和抑制免疫反应。通过制作微通道,3D生物打印模拟天然血管树,为胰岛灌注充足的氧气和营养供应。通过3D生物打印,胰腺的dECM被证明是一种很有前途的胰岛类器官生物墨水,并且dECM显示出剪切变稀的行为,这有利于嵌入细胞的存活,因为通过打印喷嘴时剪切应力被释放。
尽管采用了革命性的生物打印技术方法,人工胰腺制造的改进潜力巨大,但其技术开发的早期阶段阻碍了其生产准备过程。需要解决的是
a)合适的bioink:bioink材料的选择受到严格印刷条件的限制,几乎所有水凝胶都很脆弱,不稳定,无法保证胰岛的长期存活。具有良好的生物相容性、适当的生物和物理化学性质的现有标准或商业生物油墨很少
b)打印速度:在当前的生物打印技术中,人体大小的组织和器官需要太长的打印时间,从而影响打印细胞的细胞活力。
用于胰岛类器官的脱细胞器官支架
目前,体外建立的胰岛类器官受到毫米级大小的限制,限制了在移植中的直接使用。为解决这个问题,可以从人类尸体上制备脱细胞支架,并用分离的器官特异性前体或直接用含有实质、血管和其他辅助细胞类型的类器官进行接种。加上生理上合适的培养方法和生物反应器培养,这些支架可以在体外支持更大器官结构的生长。
人胰岛器官芯片
芯片上器官是一个新的概念。与微流控技术结合,类有机物在提供仿生细胞或组织微环境方面具有显著优势。与静态培养相比,微流控技术引入了一种可促进营养物质、氧气和废物运输的灌流,以模拟血液流动。已经开发了一种器官芯片微流控装置,以促进IPSC和3D胰岛类器官胚胎体的形成,这可以改善胰岛类器官的功能和成熟。
Walker及其同事通过悬滴分散人类胰岛细胞,制备了胰岛类器官,并在微流控系统中培养胰岛类器官以促进其存活。在接下来的研究中,Oxy芯片被用于支持具有更好的氧气利用率和胰岛功能的主要人类胰岛类器官,其中芯片孔的聚(甲基丙烯酸甲酯)基底被透氧全氟烷氧基(PFA)膜取代。微流控平台也可用于创建3D模型,不同类型的细胞保持在分离的隔间内,并通过微通道阵列连接。
与静态和常规模型(大小不一的天然胰岛)相比,动态条件下的胰岛类器官可能对药物(如甲苯磺丁脲和GLP-1)表现出更高的敏感性。总之,胰岛类器官与微流控系统相结合将是疾病建模、高通量药物分析和再生医学的完美平台。
机械刺激在人胰岛类器官构建中的作用
机械刺激对细胞的影响已引起广泛关注。据报道,机械信号可能会影响β细胞的分化和功能。
在人类胰岛类器官的构建中,机械刺激也起着重要作用。细胞聚集产生的几何结构被认为是胰岛类器官生成过程中最直接的机械刺激。Hogrebe及其同事发现,烧瓶3D旋转培养中的细胞骨架状态不同于2D贴壁培养,这严重影响了β细胞的定向分化。生物材料的存在会对人类胰岛类器官产生多种机械刺激,如硬度、地形和机械压力。生物材料的硬度(杨氏模量)可以调节细胞自聚集,用于人类胰岛类器官构建和β细胞分化。β细胞可以感知地形,并将其转化为生物信号,从而促进体外长期人类胰岛培养。
在微流控平台中,剪切应力由流速决定,并影响胰岛类器官的形态和功能。检测到灌注较慢的动态条件可改善大鼠胰岛类器官丰富的微绒毛、紧密的细胞连接和增强的葡萄糖反应性,而灌注较高或静态条件下则相反。
总之,细胞聚集、生物材料和构建人类胰岛类器官的技术都可以通过机械刺激影响类器官的存活、分化和功能。目前其机制主要集中在机械损伤引起的细胞死亡,调节YAP、整合素和细胞骨架动力学等机械信号。最适合人类胰岛类器官的最佳机械环境尚未确定。在人类胰腺中,胰岛被外分泌部分和丰富的血管组织包围,这些组织可以为胰岛提供刚度、地形和机械压力。
因此,未来人类胰岛类器官构建的研究不仅要关注类器官本身,还要了解天然胰岛的机械环境。
5 挑战和展望
目前人胰岛类器官的发展道路上还存在着三大挑战:类器官中胰岛细胞类型、比例以及空间位置错乱;类器官的批次、个体之间的巨大差异性;受到免疫排斥、缺氧等因素影响,移植后的胰岛类器官存活率低。
胰岛类器官可以促进人类胰岛的研究,尤其是在人类胰岛发育、糖尿病疾病模型和胰岛移植领域。自从埃德蒙顿方案首次获得成功以来,胰岛并不是移植的唯一来源。近年来,基于干细胞的糖尿病临床试验已经被提出并实施。2014年,ViaCyte提交了人类ESC源性胰腺祖细胞移植治疗T1D的首次试验(NCT02239354)。2021年1月,SEMMA启动了一项HESC来源的β细胞治疗T1D的临床试验。
蓬勃发展的人类胰岛再生无疑将使再生医学更接近糖尿病患者,并有望补充尸体胰岛的临床移植需求。
部分参考文献:
Liu Haisong et al., Chemical combinations potentiate human pluripotent stem cell-derived 3D pancreatic progenitor clusters toward functional β cells. Nature Communications, 2021
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







