Adv Sci:暨南大学靳艳丽等团队合作研究表明PRMT1通过调节蛋白质合成促进白血病干细胞的自我更新
2024-12-15 iNature iNature 发表于陕西省
该研究发现为组蛋白精氨酸甲基化修饰调节LSCs中的蛋白质合成提供了新的证据,并突出了PRMT1作为CML患者有价值的药物靶点。
酪氨酸激酶抑制剂(TKIs)的应用已经彻底改变了慢性髓性白血病(CML)的治疗。然而,疾病复发和进展,特别是由于持续性白血病干细胞(LSCs)仍然是临床的一大挑战。因此,迫切需要对LSCs的治疗易感性进行验证。
2024年12月12日,暨南大学靳艳丽,刘畅,中山大学潘景轩,Zou Waiyi,中国科学院鲍时来共同通讯在Advanced Science 在线发表题为“PRMT1 Promotes the Self-renewal of Leukemia Stem Cells by Regulating Protein Synthesis”的研究论文。该研究发现为组蛋白精氨酸甲基化修饰调节LSCs中的蛋白质合成提供了新的证据,并突出了PRMT1作为CML患者有价值的药物靶点。
研究证实了蛋白精氨酸甲基转移酶1 (PRMT1)在CML LSCs维持中的关键作用。研究发现,PRMT1可促进人原代CML LSCs的存活和连续镀能力。在BCR-ABL驱动的CML小鼠中,Prmt1基因缺失可显著延缓白血病发生并损害LSCs的自我更新。PRMT1通过其甲基转移酶活性调节LSCs和白血病的发展。MS023对PRMT1活性的药理抑制可显著消除LSCs,延长CML小鼠的生存期。机制研究表明,PRMT1通过催化组蛋白H4R3 (H4R3me2a)在其基因启动子区域的不对称二甲基化,促进核糖体蛋白L29 (RPL29)的转录激活。PRMT1通过RPL29在CML LSCs中增加了全局蛋白的合成。

慢性髓性白血病(Chronic myeloid leukemia, CML)是一种常见的由基因易位t (9;22) (q34;q11.2)产生BCR-ABL融合癌基因。这种融合癌基因编码具有组成型酪氨酸激酶活性的BCR-ABL癌蛋白,可以有效地将造血干细胞(HSCs)转化为白血病干细胞(LSCs)。一线药物,酪氨酸激酶抑制剂(TKIs),如伊马替尼、尼罗替尼、达沙替尼和奥利替尼,对大多数CML患者的治疗非常有效,导致正常的预期寿命。然而,可能由持续性LSCs驱动的疾病复发和进展仍然是临床的一大挑战。
LSCs被认为是一种罕见的具有自我更新能力(干性)、分化障碍和静止状态的细胞群体。越来越多的证据表明,LSCs的功能与BCR-ABL激酶活性无关。因此,TKIs可以有效控制CML,但不能治愈CML,因为TKIs不能根除LSCs。LSCs的持续存在是CML疾病发生、维持和复发的原因。因此,根除LSCs可能是根治CML的一种有希望的策略。目前,已经确定了几种维持LSCs的途径或调节因子,包括B细胞淋巴瘤2 (Bcl-2)和髓细胞白血病1 (Mcl-1), Wnt/β-catenin和Hedgehog途径,花生四烯酸5-脂氧合酶(Alox5)和硬脂酰辅酶A去饱和酶1 (Scd1), p53和c-Myc网络,以及造血微环境。然而,LSCs自我更新的精确调控仍未完全确定。
表观遗传修饰(DNA甲基化、组蛋白修饰和RNA甲基化)被认为是LSCs维持和自我更新的关键驱动因素。例如,过表达的组蛋白去乙酰化酶SIRT1对于CML CD34细胞的自我更新至关重要,抑制SIRT1通过激活p53来消除LSCs。zeste同源物2 (EZH2)的增强子是多梳抑制复合体2 (PRC2)的关键成分,是维持CML LSCs所必需的,EZH2的基因缺失可以阻断CML小鼠模型中白血病的发展。研究致力于探索LSCs调控的表观遗传途径,如蛋白质赖氨酸甲基转移酶G9A和蛋白质精氨酸甲基转移酶5和7 (PRMT5和PRMT7)。PRMT催化组蛋白尾部精氨酸残基或其他非组蛋白的甲基化,分为I型PRMT(如PRMT1-4、PRMT6和PRMT8)、II型PRMT(如PRMT5和PRMT9)和III型PRMT (PRMT7)。PRMTs在基因转录、RNA剪接、DNA损伤反应、干细胞生物学和肿瘤发生等众多生物学过程中发挥着重要作用。之前的研究证明了PRMT5和PRMT7通过不同的机制在CML LSCs的维持和自我更新中发挥关键作用。此外,PRMT4 (CARM1)对于混合谱系白血病(MLL)-AF9驱动的急性髓系白血病(AML)的启动至关重要。因此,靶向PRMTs是根除LSCs的潜在治疗策略。
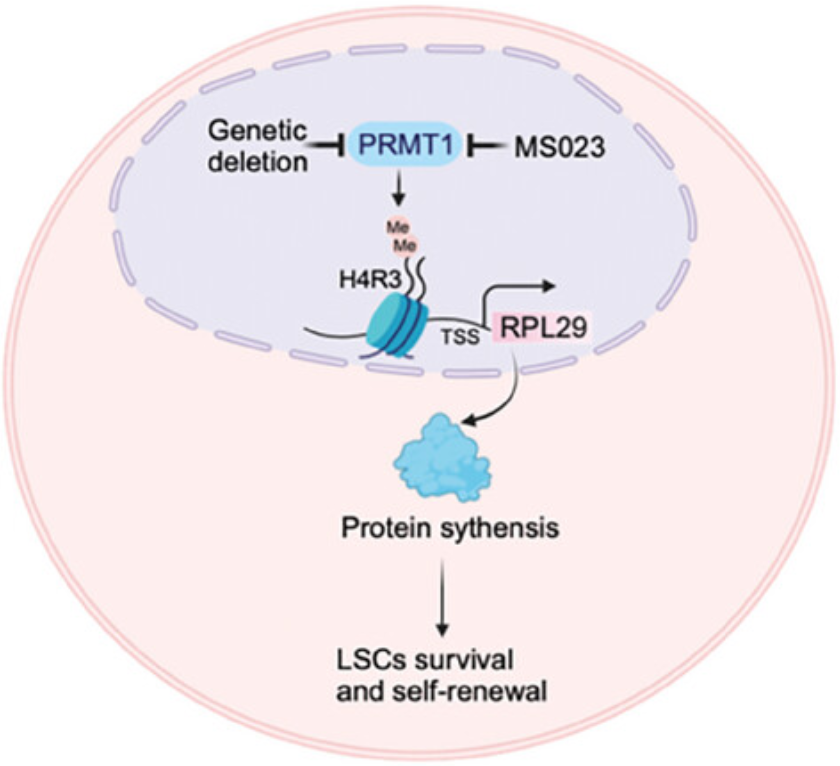
PRMT1-RPL29介导的维持LSCs自我更新的蛋白质合成的工作模型(图源自Advanced Science )
PRMT1是主要的I型精氨酸甲基转移酶,负责哺乳动物细胞中85%的精氨酸甲基化。在PRMTs家族中,PRMT1主要催化组蛋白H4R3 (H4R3me2a)的不对称二甲基化,这与转录激活相关。PRMT1的失调已经在几种癌症类型中被观察到。例如,PRMT1促进乳腺癌转移、非小细胞肺癌的上皮-间质转化和多发性骨髓瘤的发生。此外,PRMT1通过催化FLT3-ITD在精氨酸残基972/973 (R972/973)的甲基化,促进含有FMS样受体酪氨酸激酶-3内部串联重复(FLT3-ITD)突变的AML的维持。此外,PRMT1在食管鳞状细胞癌中维持肿瘤启动细胞的特性。然而,PRMT1在维持CML LSCs中的关键作用仍然难以捉摸。
研究确定了PRMT1在CML LSCs的维持和自我更新中的作用。高表达的PRMT1增强了人原代CML LSCs的存活和连续镀能力。在CML小鼠中,Prmt1基因缺失阻断了白血病的发展并损害了LSCs的自我更新。药物抑制PRMT1活性选择性地根除LSCs。在机制上,研究发现核糖体蛋白L29 (RPL29)是PRMT1的关键下游功能介质。PRMT1通过转录激活RPL29在CML LSCs中的表达来增强全局蛋白合成。研究结果将LSCs中组蛋白精氨酸甲基化与整体蛋白合成联系起来,并确定PRMT1是CML中消除LSCs的有希望的靶点。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202308586
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#白血病# #PRMT1#
12