乳腺癌原发灶与脑转移灶中的HER2表达存在显著异质性,重复检测有必要!
2024-09-27 苏州绘真医学 苏州绘真医学 发表于上海
乳腺癌BrM中HER2表达非常普遍,且与HER2-0原发性和颅外肿瘤相比,表达频繁增加。这项研究不仅有助于我们了解从原发性到 BrM的HER2表达动态,还强调了迫切需要改进诊断工具来识别脑中的HER2
关于乳腺癌中匹配的原发性肿瘤和脑转移瘤(BrM)之间HER2-low表达动态的数据有限。HER2-low表达已成为具有新颅内活性的高活性抗体-药物偶联物的新型治疗生物标志物。大约一半的乳腺癌可能具有HER2-low表达,这为德曲妥珠单抗(T-DXd)提供了治疗靶点,德曲妥珠单抗是一种抗HER2 ADC,可延长HER2阳性和HER2-low MBC(转移性乳腺癌)患者的无进展生存期和总生存期。包括T-DXd在内的下一代ADC似乎具有令人印象深刻的颅内疗效,并有望改善乳腺癌脑转移患者的预后。研究确定了2003年至2023年期间在NCI指定中心就诊的转移性乳腺癌和BrM患者。根据ASCO-CAP指南,HER2表达定义为HER2阳性(3+、2+/ISH 扩增)、HER2低(1+、2+/ISH阴性)或HER2-0。雌激素受体(ER)状态定义为ER≥1%。从BrM切除到死亡或最后一次随访,在3种亚型之间通过Cox比例风险模型进行多变量生存分析,控制ER和年龄。
在197对匹配的原发和切除BrMs中,81%显示脑部有HER2表达:61%为HER2阳性,20%为HER2-low,19%为HER2-0。HER2阳性原发肿瘤的一致性很高,100%保留了HER2表达(97%保留了HER2阳性表达,2.7%转换为HER2-low)。HER2-0原发肿瘤对应的BrMs经常显示HER2表达增加,转变为HER2-low(35%)或HER2阳性(5.4%)状态。在48个HER2-low原发肿瘤中,52%的脑部HER2状态不一致,21%检测为HER2阳性,31%检测为HER2-0。在调整分析中,HER2阳性BrM患者的死亡风险明显低于HER2-low BrMs患者(HR = 0.41,P = .0006);HER2-0和HER2-low之间没有差异。
在这项回顾性分析中,HER2表达在乳腺癌BrMs中很常见,这强调了对改善的非侵入性诊断的需求。HER2-low和HER2-0 BrMs患者的生存率较低,这是一种未得到满足的临床需求。
-
BC BrMs与原发性肿瘤相比,在HER2表达方面存在明显差异;
-
HER2-low表达在BrMs中很普遍,并且对OS的影响与HER2+不同;
-
需要改善的非侵入性诊断方法来识别BrMs中的HER2状态。
研究背景
脑转移瘤(BrMs)的发病率随着时间的推移而稳步上升,这一趋势归因于转移性乳腺癌(MBC)女性患者生存率的提高。尤其是HER2+或三阴性(雌激素受体[ER]阴性、孕激素受体[PR]阴性和HER2阴性)MBC女性,约占MBC人群的30%-40%,她们面临着发生中枢神经系统(CNS)转移的高风险。虽然ER阳性/HER2阴性乳腺癌患者发生脑转移的风险较低,因为这是迄今为止最常见的乳腺癌亚型,但ER阳性脑转移患者的绝对数量也很高。BrMs的临床亚型以ER、PR和HER2状态为特征。该亚型在MBC管理中起着关键作用,显著影响乳腺癌BrM的发病率、预后和治疗。这些受体的表达也可能在原发性乳腺肿瘤和BrM之间表现出显著的不一致,从而给管理策略带来挑战。了解受体状态从原发性肿瘤中的阳性转变为转移性疾病中的阴性,或反之,对于转移性疾病中的治疗决策过程具有重要意义。
一项针对219名患者的多中心回顾性研究表明,原发性乳腺肿瘤和BrMs之间的受体状态不一致率为36.3%,导致22.8%的病例发生亚型转换。值得注意的是,该队列中近40%的原发性激素受体阳性患者转换了亚型。然而,在这项研究中,并未评估HER2-low与HER2-0表达的一致性。此外,由于脑活检和切除术的并发症,侵入性肿瘤取样通常不进行,因此很难评估BrMs中的亚型。因此,关于中枢神经系统受体不一致的具体知识有限,只有少数研究在较小的人群中对此进行了调查。此外,关于乳腺癌BrMs中HER2-low表达动态以及表达如何影响总体生存期(OS)的数据非常有限。HER2表达,即使是在较低水平,也已成为乳腺癌治疗的新靶点和具有颅内活性的高活性抗体-药物偶联物(ADC)的治疗生物标志物,例如德曲妥珠单抗(T-DXd)。研究表明,大约60%的激素受体阳性、HER2阴性的MBCs是HER2-low,定义为免疫组织化学检测(IHC)评分为1+或IHC 2+而原位杂交(ISH)为阴性。最近,另一个新的亚组称为HER2超低(ultralow)表达,定义为ISH评分为0,即<10%的肿瘤细胞染色不完全且微弱;但是,临床上无法对HER2超低表达进行检测。T-DXd目前已获得美国食品药品管理局的批准,可用于治疗无法切除或转移性HER2+或 HER2-low 乳腺癌患者,目前有证据表明BrM患者有CNS反应和临床获益。在本研究中,研究者旨在研究匹配的乳腺癌原发肿瘤和切除BrMs中的HER2表达动态,包括HER2-low。主要目标是描述受体亚型不一致和由此导致的亚型转换的发生率。次要目标是评估HER2-low表达与HER2+和HER2-0 BrM相比对OS的影响。
研究结果
接受或不接受颅内切除术的乳腺癌BrM患者的患者特征和人口统计学特征:
在1252名诊断为BrM的MBC患者中,共有345名患者接受了BrM切除活检。在MBC中接受BrM切除术或活检相对罕见;因此,表1列出了3个临床队列的基线特征和人口统计学数据,以了解匹配队列的普遍性,包括所有乳腺癌BrM患者(n = 1252)、接受BrM切除术的MBC患者(n = 345)以及接受BrM切除术且有评估和记录ER/PR和HER2 IHC状态的匹配原发灶的MBC患者(n = 197)。在初次诊断转移时,在接受BrM切除术的患者中,25%(n = 85)仅有脑转移性疾病,75%(n = 258)同时患有脑和颅外疾病。相比之下,在所有诊断为BrM的患者中,只有9%仅有脑部疾病,34%同时患有BrM和颅外疾病,57%在初次转移诊断时仅诊断为颅外疾病(表1)。接近三分之二(57%;n = 198)接受CNS切除术的患者在初次转移诊断后一年内被诊断出患有CNS进展。接受切除术的患者原发性HER2状态:19%(n = 65)的患者为HER2-low,14%(n = 50)的患者为HER2-0,37%(n = 127)的患者为HER2+;43%(n = 149)的患者具有激素受体阳性的原发性亚型。在1252名患者中,研究者比较了接受BrM切除术(n = 345)和未接受BrM切除术(n = 907)的MBC患者的特征分布。首次诊断转移时的部位、从首次诊断转移到CNS诊断的时间、总体原发亚型以及种族和民族在0.05水平上具有统计学意义。各组之间的年龄或性别无统计学差异。
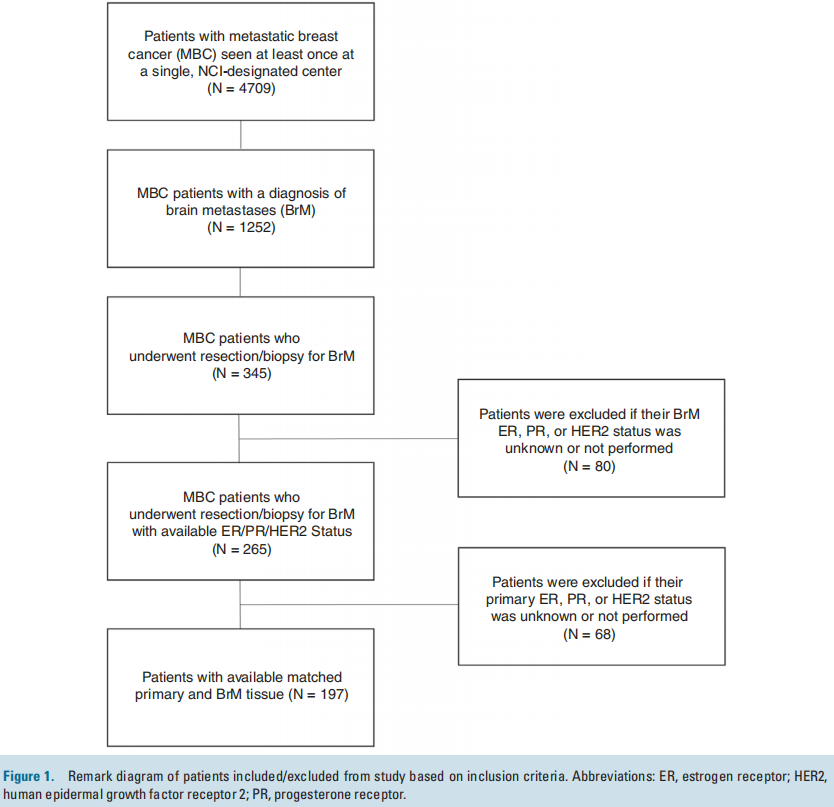
图1
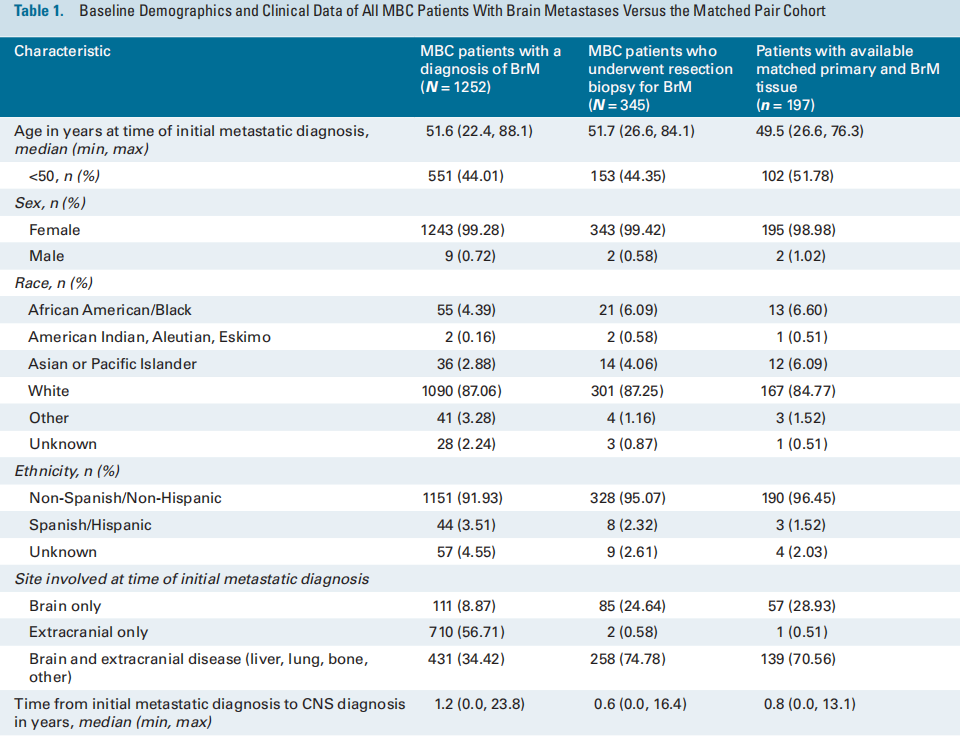
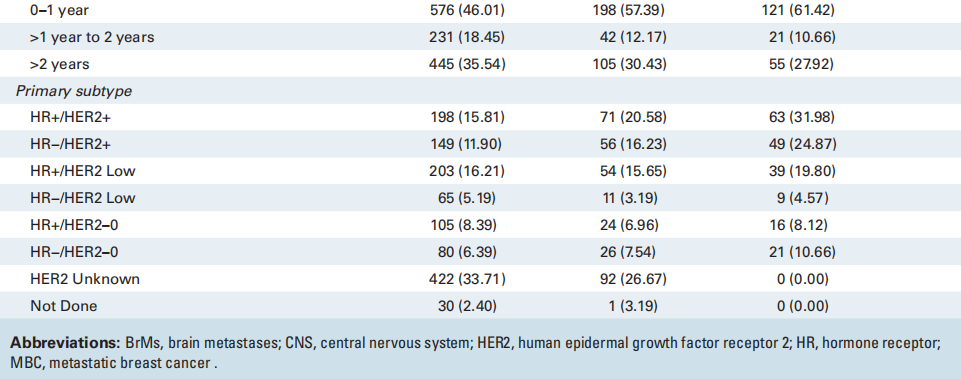
表1
表2列出了197名具有匹配的原发和BrM组织的患者根据HER2状态列出的患者特征、临床特征和治疗特征。对于匹配的配对队列,首次诊断转移时的中位年龄为49.5岁,85% 为白种人。74%为I-III期,之后出现转移复发;而24%的患者在诊断时为IV期新发患者。在IV期新发患者中,近30%为HER2+。患者在CNS诊断之前接受过中位数为一线的全身治疗。大多数患者接受放射治疗(84%),并在BrM切除后继续接受全身治疗(75%)。
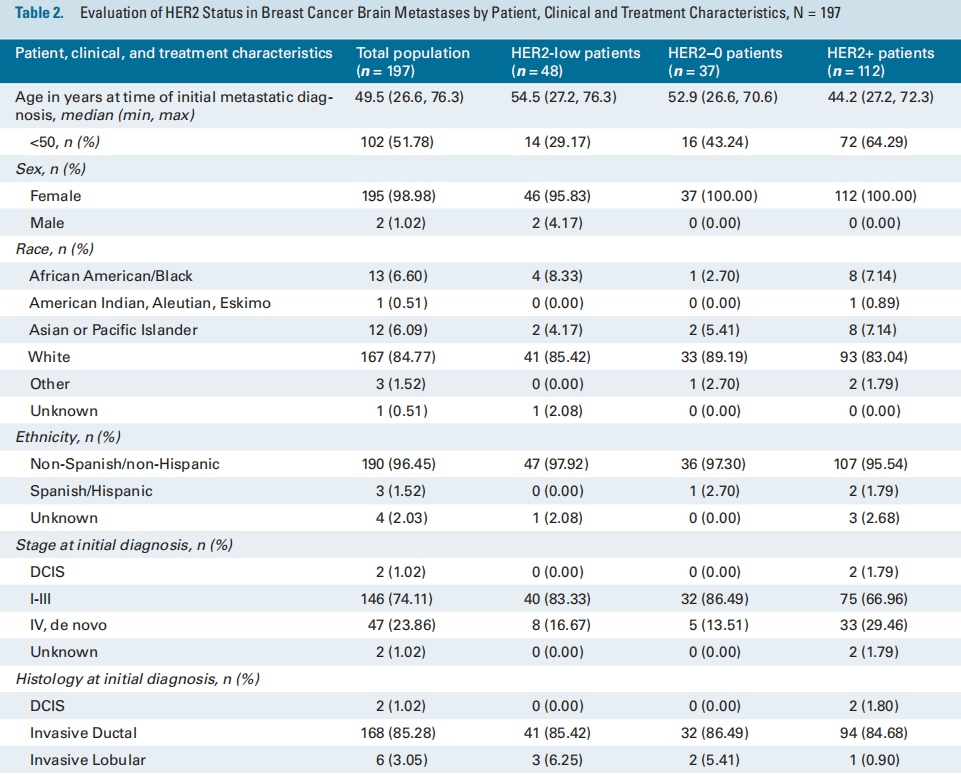
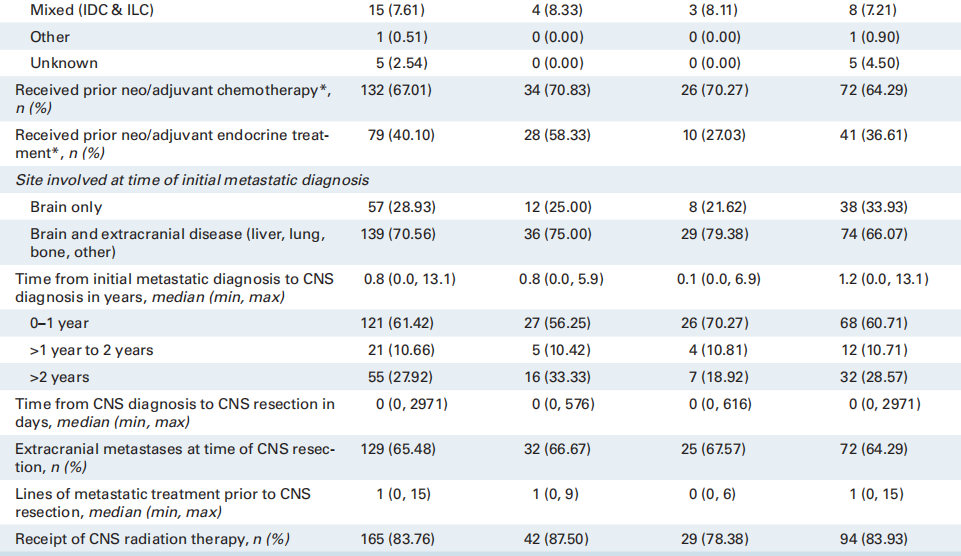
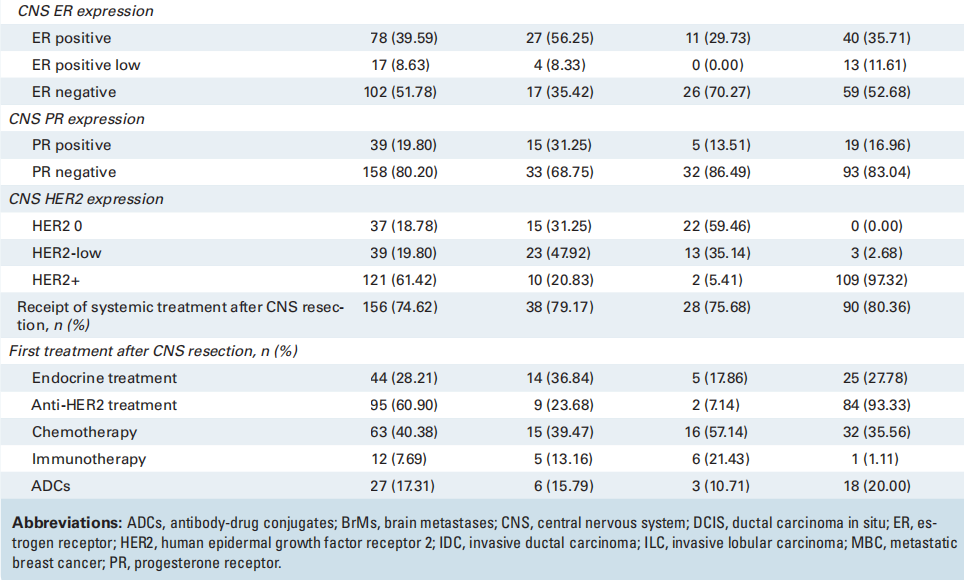
表2
原发灶、颅外转移灶和BrM之间的HER2受体不一致:
在265例进行IHC检测的切除乳腺癌BrMs中,72%的肿瘤有HER2表达:49.8%为HER2+(n = 132)、22.2%为HER2-low(n = 59)和 27.9%为HER2-0(n = 74)。在197例的匹配队列中,81%的肿瘤有HER2表达:57%为HER2+(n = 112)、24%为HER2-low(n = 48)、19%为HER2-0(n = 37;图2A、表3)。在112例HER2+原发性肿瘤中,97% (n = 109) 具有一致的HER2+ BrM,3例 (2.7%) 转换为HER2-low,100%保留了一些HER2表达 (表3 )。在37例HER2-0原发性肿瘤中,35% (n = 13) 在BrM中获得了HER2-low表达,5.4% ( n = 2) 在BrM中获得HER2+表达。在48例HER2-low原发性肿瘤中,一半 (52%) 在BrM中转变为HER2+ (21%) 或HER2-0 (31.2%) (图2A,表3 )。研究还评估了配对队列的HER2亚组中的ER状态。对于HER2+BrM,51%为ER阴性,37%为ER阳性,12%为ER弱阳性。在HER2-low BrM中,39%为ER阴性,56%为ER阳性,5%为ER弱阳性。
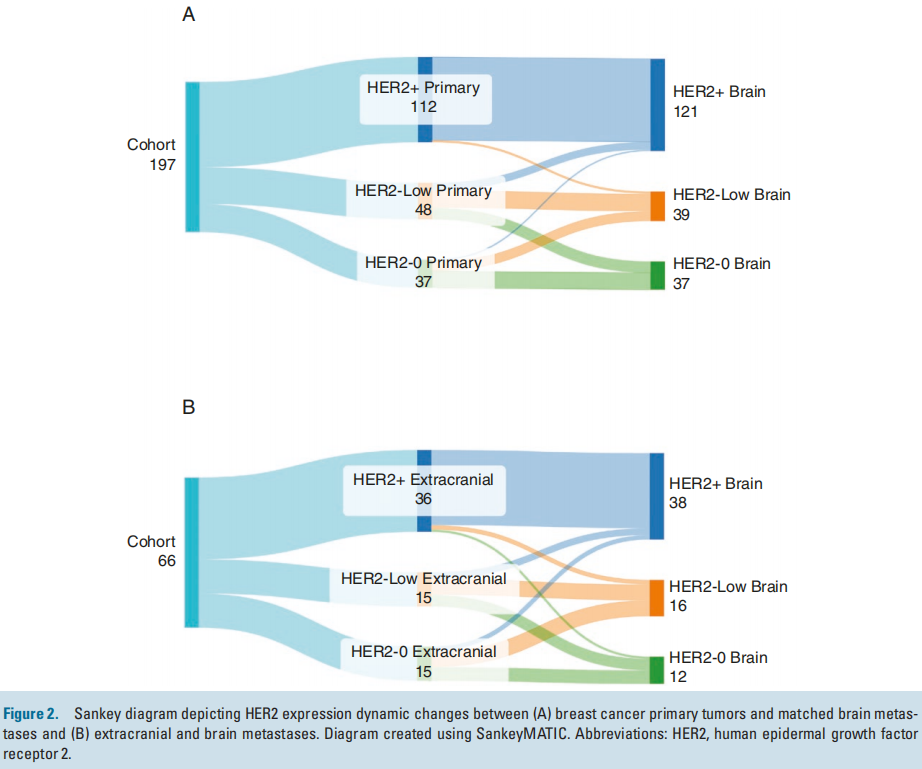
图2
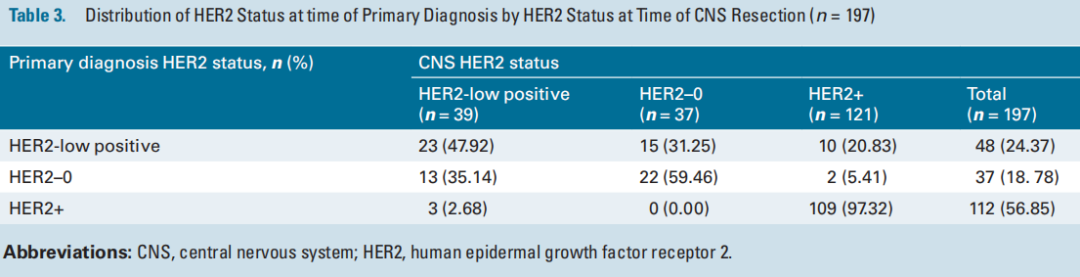
表3
总体而言,有66例与BrM匹配的颅外转移瘤可用于评估HER2转换情况。36例HER2+颅外转移瘤中,92% (n = 33) 具有一致的HER2+ BrM,其中6% (n = 2) 转换为 HER2-low,3% ( n =1) 脑内HER2表达缺失。15例HER2-low颅外转移瘤中,33% (n = 5) 转换为HER2-0,20% (n =3) 获得HER2+表达。值得注意的是,47% (n =7) 的HER2-0 颅外转移瘤在脑内获得HER2-low表达,13% (n =2) 获得HER2+表达(图2B)。
BrM中HER2表达对总体生存的影响:
对乳腺癌BrMs患者的OS进行了评估,这些患者按HER2亚组(包括HER2-low)进行分类。先前的研究表明,HER2-low乳腺癌患者的OS优于HER2-0乳腺癌,但缺乏对BrMs人群的评估。
HER2-low、HER2-0和HER2+患者的BrM切除后未调整的中位生存期分别为12.4、16.1和47.6个月(P=0.0004)。在调整了BrM时的年龄和ER状态后,HER2+ BrM患者的随访死亡风险显著低于HER2-low BrM患者(HR=0.41,P=0.0006;图3)。在调整ER和年龄后,HER2-0 BrM患者的死亡风险与HER2-low BrM患者没有差异(HR=0.96,P =0.9;图3)。
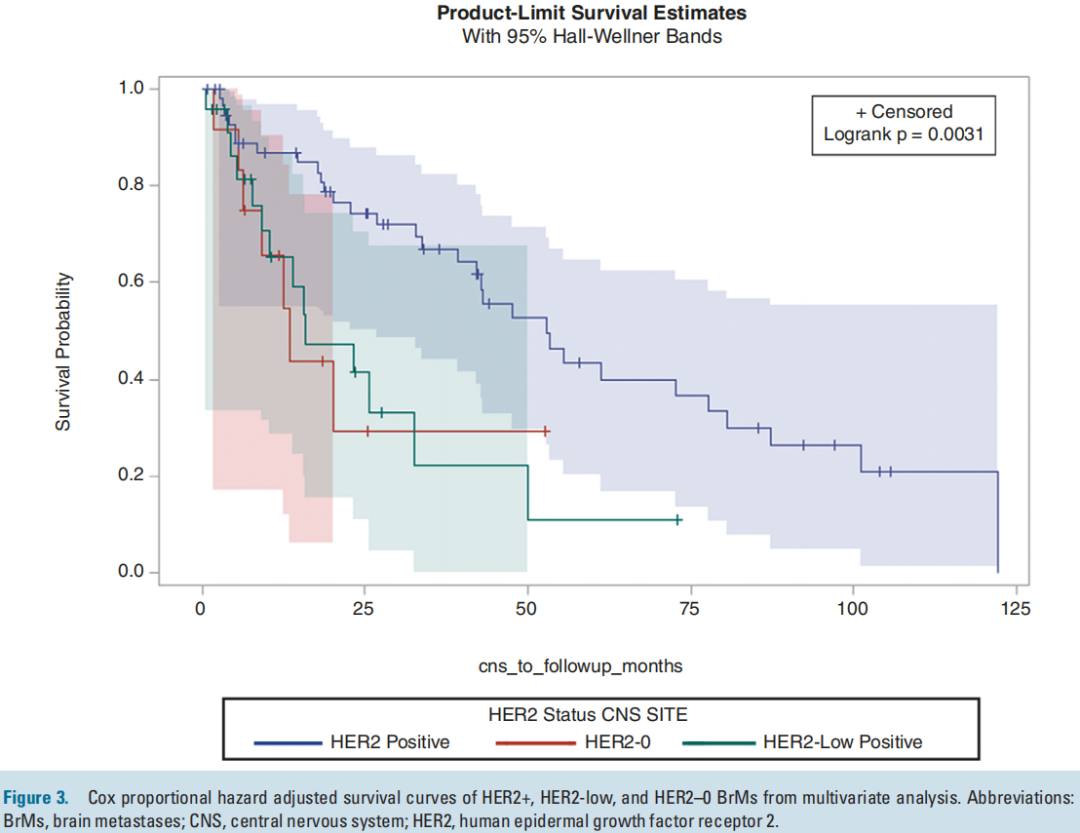
图3
讨 论
乳腺癌BrMs是MBC中常见的转移性播散部位,对患者和护理团队构成重大挑战,并导致较差的治疗效果。乳腺癌BrMs的标准治疗通常是局部治疗,包括颅内切除术,随后对切除腔进行放射治疗或单独进行放射治疗。在回顾性和前瞻性系列研究中,局部治疗后的全身治疗可改善OS,在HER2+ BrMs中最为明显。必须承认,BrMs患者的OS明显较差,尤其是HER2阴性BrMs患者。有限的治疗选择进一步加剧了HER2阴性BrMs治疗的复杂性,尤其是那些内分泌耐药的ER阳性或三阴性疾病患者,这凸显了深入了解这种临床环境中HER2表达动态的紧迫性。
由于T-DXd已获批用于HER2+和HER2-low疾病患者,HER2-low表达现已成为MBC中重要的生物标志物。最近,HER2超低表达也被定义,且HER2超低表达MBC患者可能从靶向HER2治疗中受益;然而,这种生物标志物的使用在临床上并不是标准的。在HER2+ MBC中,与T-DM1相比,T-DXd可改善稳定BrMs患者的无进展生存期 (PFS) 和OS,并且改善了稳定或活跃BrMs患者的特定CNS PFS。此外,T-DXd 在针对活跃HER2+ BrMs 患者的小规模研究中显示出令人印象深刻的颅内反应率。图卡替尼可改善稳定和活跃HER2 + BrMs患者的PFS、CNS-PFS和 OS。BrM中缺乏HER2阳性可能导致停止这些改善OS的治疗。T-DXd的活性在HER2-low BrM治疗中正在不断发展。在对来自DESTINY-Breast04试验的BrM患者的分析中,T-Dxd在25名稳定BrM患者中导致颅内反应率为25%,这是令人鼓舞的。正在进行其他几项临床试验,以进一步评估T-DXd在HER2-lowMBC中的疗效(NCT06048718;NCT04420598)。其他靶向HER2 ADC也在HER2-low乳腺癌中进行评估,例如ARX788和RC-48(Disitamab vedotin)。ARX788 已证明比T-DM1有更强的体外和体内活性,RC-48对HER2+和HER2-low乳腺癌患者表现出疗效,2.0 mg/Kg剂量组的中位PFS为6.3个月。ARX788和RC-48目前都在多个临床试验中进行进一步测试(NCT03255070;NCT05041972;NCT06224673;NCT05851677;和NCT05831878)。
在本研究中,研究者检查了197例匹配的原发性乳腺肿瘤和切除的BrM,结果显示81%的病例表现出脑内HER2表达低或高。鉴于目前已有针对高HER2和低HER2的颅内活性中枢神经系统药物,这一发现具有临床意义。在这些病例中,61.42%为 HER2+,19.80%为 HER2-low,18.78%为 HER2-0。研究者还描述了原发性、颅外和转移性BrM之间HER2表达的动态变化。先前的研究已经发现乳腺癌亚型在原发性肿瘤和BrM之间转换。在一项对216例匹配的原发性肿瘤和BrM的研究中,多达37.5%的BrM发生了亚型转换,其中15%的BrM获得HER2过表达,尽管该研究未分析HER2-low。在本研究中,几乎所有 HER2+原发性肿瘤患者在BrM中的HER2表达都保持高度一致,这让该人群非常放心,因为HER2仍然是中枢神经系统疾病的靶点。相反,HER2-0原发性肿瘤显示出亚型转换的倾向,35%的BrM中观察到HER2低表达,5.4%的BrM中观察到HER2+表达。这一发现表明40%的HER2-0原发性肿瘤在脑中获得HER2表达,这令人担忧,因为我们通常在没有颅内切除术的情况下不会知道这一点,并强调了进行非侵入性HER2检测的必要性。这些数据得到了最近一份小型报告的证实,该报告称,28名HER2-0原发性乳腺癌患者中有15名在随后切除的BrM中可检测到HER2表达。切除的BrM的颅外组织分析进一步强调了HER2表达的动态性,揭示了HER2-0颅外转移中脑内HER2-low(47%)和HER2+(13%)表达的获得。
在基于脑内HER2表达的生存分析中,在调整年龄和ER状态后,HER2+ BrM患者的死亡风险明显低于HER2-low或HER2-0 BrM患者。然而,HER2-0和 HER2-low BrM之间的生存率没有显著差异。HER2-low和HER2-0 BrM患者的生存结果较差,凸显了这一具有挑战性的临床情况下持续存在的未满足的临床需求。虽然HER2-low BrM患者的未调整中位生存期低于HER2-0 BrM(分别为12.4个月和16.1个月),但值得强调的是,HER2-low不是乳腺癌的独特生物学或基因组亚型,而是ADC的靶点;因此,这些数据并不令人惊讶。在已知的原发性乳腺癌临床亚型之外,HER2-low尚未显示影响预后或具有明显的结果。该研究强调了在无需侵入性采样的情况下,确定大脑中HER2状态方面的诊断性关键作用。鉴于管理HER2阴性BrM的历史局限性,改进的诊断工具对于揭示HER2表达动态的复杂性至关重要,使临床医生能够在这种复杂的环境中及时做出明智的治疗决策。最近的研究调查了脑脊液中循环肿瘤细胞和循环肿瘤 DNA(ctDNA)分析的适用性,与活检相比,利用CNSide检测以一种较小侵入性和风险的方式确定HER2状态,尽管还需要在BrM人群中进行更多的研究。这是一个有希望的未来研究领域,最终可以用于在无法进行活检时检测原发性肿瘤样本和BrM的HER2扩增和不一致性。据研究者所知,这是第一份描述脑内HER2低表达对OS影响的报告。最近一项包含42项研究的系统荟萃分析评估了HER2-low对早期乳腺癌和MBC生存的影响。Molinelli及其同事得出结论,与HER2-0患者相比,HER2-low患者在晚期和早期疾病环境中的OS率略高,无论激素受体表达如何。这项荟萃分析并未专门包括脑转移患者,HER2表达主要在原发性肿瘤上进行。在本研究的分析中,HER2-0和HER2-low BrM患者的OS相似,这可能是因为目前缺乏针对HER2-low BrM患者的脑渗透性全身疗法。
本研究存在一些局限性,特别是缺乏对所有样本进行集中病理学审查或集中重新检测,这为HER2表达评估带来了潜在的差异。观察到的原发性肿瘤和脑转移瘤之间的受体不一致可能不仅仅反映了生物学变化,也可能是由于实验室间检测差异造成的。此外,该研究没有考虑HER2超低状态,这是一种最近的分类,可以提供对HER2表达动态的更多见解。没有统一的HER2超低表达检测,限制了可行性。此外,由于匹配队列仅纳入了接受脑转移瘤手术切除的患者,因此存在固有的选择偏差,这可能会影响本研究分析的队列中HER2表达的分布。虽然本研究的补充数据表明亚型分布可能存在偏差,但研究者认为这种偏差不太可能显著影响亚型转换率。尽管存在这些局限性,本研究结果为HER2在原发性和转移性脑肿瘤中的表达提供了宝贵的见解,并且未来针对更具包容性的患者群体和标准化检测方案的研究将对于验证和扩展本研究结果非常有价值。
总之,乳腺癌BrM中HER2表达非常普遍,且与HER2-0原发性和颅外肿瘤相比,表达频繁增加。这项研究不仅有助于我们了解从原发性到 BrM的HER2表达动态,还强调了迫切需要改进诊断工具来识别脑中的HER2表达。
参考文献:
Alyssa M Pereslete, Melissa E Hughes, Alyssa R Martin, Janet Files, Kyleen Nguyen, Lauren Buckley, Ashka Patel, Abigail Moore, Eric P Winer, Deborah Dillon, Tianyu Li, Sara M Tolaney, Nancy U Lin, Sarah L Sammons, Analysis of HER2 expression changes from breast primary to brain metastases and the impact of HER2-low expression on overall survival, Neuro-Oncology, 2024;, noae163, https://doi.org/10.1093/neuonc/noae163

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#乳腺癌# #脑转移瘤#
59