免疫检查点抑制剂毒性的几个问题
2024-05-16 小药说药 小药说药 发表于上海
我们针对ICIs炎症毒性的几个问题进行探讨,对这些问题的回答将加深我们对irAE发病机制、治疗方法和一些尚未解决的主要问题的理解。
前言
在过去的十年里,免疫治疗从根本上改变了实体瘤和血液瘤的治疗格局。阻断免疫检查点受体CTLA-4、PD-1及其配体PD-L1的单克隆抗体已显示出对多种肿瘤类型的广泛活性,使许多患者的生存期延长,甚至持久缓解。
然而,尽管免疫检查点抑制剂(ICIs)具有巨大的潜力,但它们的成功在一定程度上受到各种炎症毒性的限制,这些毒性统称为免疫相关不良事件(irAE)。这些毒性可能导致治疗延迟和中断,在极少数情况下可能危及生命。与化疗和靶向治疗诱导的不良事件相比,irAE的严重程度和时间都很难预测。
因此,了解驱动irAE的分子和细胞机制显然非常重要。在此,我们针对ICIs炎症毒性的几个问题进行探讨,对这些问题的回答将加深我们对irAE发病机制、治疗方法和一些尚未解决的主要问题的理解。这些会有助于更好地预测毒性,并开发出针对这些毒性的优化疗法,避免干扰抗肿瘤免疫。
ICI如何影响irAE的发展?
CTLA-4和PD-1/PD-L1在免疫调节中具有非常不同的作用。CTLA-4是抗原呈递细胞(APC)上表达的共刺激蛋白B7-1和B7-2的诱饵受体,阻止B7与T细胞上的共刺激受体CD28相互作用。因此,CTLA-4减少了幼稚T细胞的激活,也可能干扰炎症组织中T细胞的持续刺激。CTLA-4也在调节性T细胞(Tregs)上高表达,诱导DC细胞耐受,后者通过IDO进一步抑制T细胞的能力。PD-1是一种T细胞激活后表达的抑制性受体,在重复刺激后表达水平最高。PD-1在与其配体PD-L1或PD-L2结合后,通过激活SHP-2磷酸酶直接抑制TCR和CD28信号传导。
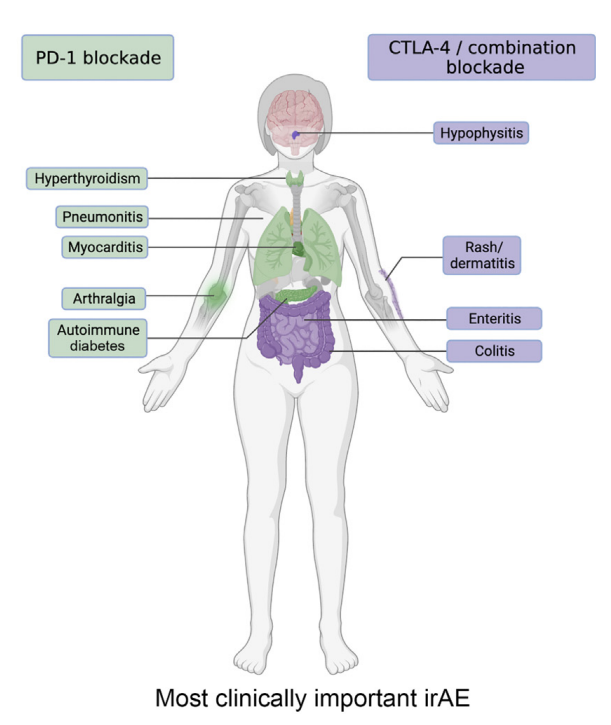
irAE的分布、严重程度和频率显然与所使用的ICI类别有关。在大多数情况下,CTLA-4阻断比PD-1阻断导致更严重和更频繁的毒性。特别是,CTLA-4阻断剂比PD-1或PD-L1抑制剂更常见肠道炎症。在CTLA-4阻断剂作用下,垂体炎也更常见。相比之下,PD-1阻断更常见甲状腺炎,或者肺炎和自身免疫性糖尿病。此外,靶向CTLA-4和PD-1的联合免疫疗法比单独治疗的毒性大得多。
为什么某些器官更容易成为irAE的目标?
检查点抑制剂的炎症毒性可以影响身体的任何器官系统。然而,大多数毒性发生在屏障器官,包括皮肤、胃肠道、肝脏和肺部。
结肠炎是目前ICIs最常见的严重毒性。大约20%的PD-1阻断患者出现轻度胃肠道炎症,25%的患者出现更严重的炎症。对于CTLA-4抑制剂,近40%的患者会出现胃肠道炎症,10-15%的患者会发展为严重疾病。皮肤毒性更为常见,影响了绝大多数接受ICI治疗的患者。
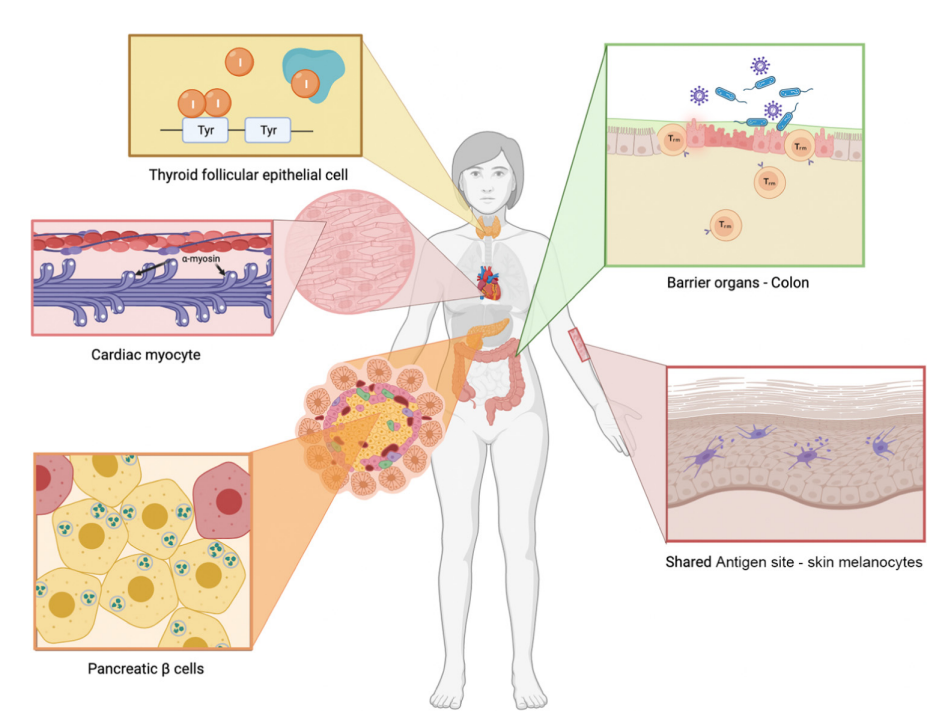
屏障器官如此普遍地参与这一事实表明,免疫反应的抗原靶点可能是共生微生物组。适应性免疫系统是通过一个复杂的选择过程发展起来的,该过程会去除大多数高亲和力的自身反应性T细胞和B细胞。而识别无害微生物和环境蛋白的免疫细胞仅通过外周耐受机制如CTLA-4和PD-1/PD-L1途径进行调节。事实上,屏障器官的炎症是外周耐受机制中许多遗传缺陷的共同特征。
内分泌毒性在ICI治疗中也很常见,而内分泌器官也是许多自发自身免疫性疾病的常见靶点。这些组织表达许多特殊蛋白,这些蛋白不参与身体的任何其他过程。尽管中枢耐受通常会去除大多数自我反应性细胞,但这些机制并不完善。研究表明,即使中枢耐受功能正常,外周耐受也在保护这些器官方面发挥着关键作用。
ICI毒性与自发性自身免疫性疾病之间有什么关系?
了解ICI毒性与自发性自身免疫性疾病之间的关系具有重要的科学和临床意义。了解ICI毒性与其他自身免疫性疾病的关系,将为了解自身免疫的机制提供见解,并有可能确定新的治疗靶点和预测自身免疫性病风险的新方法。从临床角度来看,了解自身免疫和ICI毒性之间的关系可能有助于确定ICI毒性的潜在治疗方法。
而患有某些自身免疫性疾病的患者似乎也确实增加了与其自身免疫疾病相关的ICI毒性的风险。在一项针对接受ICIs治疗的IBD患者的大型回顾性研究中,胃肠道毒性的风险约为40%,而没有IBD的ICIs对照队列患者的胃肠道毒性风险为11%。同样,显微镜下结肠炎(一种独特的结肠炎症性疾病)患者也会因ICIs而产生胃肠道毒性的风险增加。
然而,由于自身免疫性疾病通常是慢性的,并且在很长一段时间内使用免疫抑制治疗,因此自身免疫性疾病和ICI毒性之间可能会出现差异,这些差异与疾病存在的时间长度或治疗引起的变化有关,而不是与疾病生物学的根本差异有关。
哪些因素决定了谁会发展成irAE?
了解决定谁将发生irAE的因素具有至关重要的临床意义。炎症毒性是联合免疫疗法的一个主要限制,能够预测特定的炎症毒性是开发预防性治疗的重要步骤,并且可能有助于选择最佳的癌症治疗方案。
以ICI结肠炎为例,在用CTLA-4或PD-1抑制剂治疗后,CD8+结肠驻留记忆T细胞(Trms)被激活、增殖并产生颗粒酶B(GZMB)和IFN-γ。Trms被认为在很大程度上识别微生物组中的抗原,这可能是对来自微生物组抗原识别的反应,也许Trms和特定微生物产物之间的相互作用决定了某些患者的免疫稳态平衡是否会导致炎症。这种相互作用可能受到饮食、其他药物或并发感染的影响。有趣的是,有一些数据表明,粪便微生物群移植可以解决难治性ICI结肠炎,这进一步显示了该综合征中的微生物组的作用。
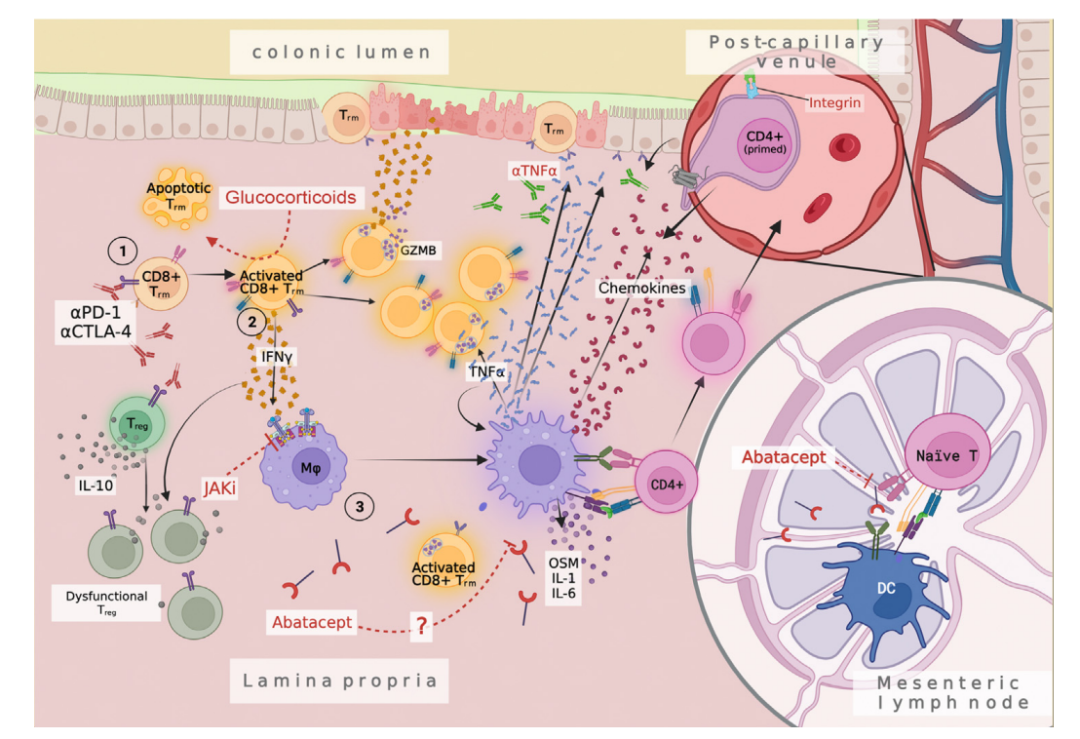
从ICI结肠炎中获得经验是否可以推广到其他毒性仍然是一个问题。Trms存在于每个屏障器官中,但在内分泌组织或心肌等 “无菌”器官中没有大量发现。因此,有必要对各种毒性进行详细分析,以了解不同的毒性是否具有不同的免疫起源。此外,独立于ICI毒性结果,对患者进行治疗前、器官水平的免疫分析,对于确定是否存在随后导致irAE的基线免疫差异至关重要。
如何选择irAE的最佳治疗策略?
绝大多数因ICI治疗而出现炎症毒性的患者都可以用糖皮质激素治疗,这些药物的早期干预几乎可以肯定降低与irAE相关的发病率和死亡率,特别是发生在心脏和神经系统等关键器官的irAE。然而,糖皮质激素的使用也可能带来风险,除了与全身糖皮质激素相关的大量副作用外,它们还具有广泛的免疫抑制作用,并可能干扰抗肿瘤反应。
抗肿瘤反应和irAE的发展可能在机制上没有区别,也就是说,发生irAE的患者有可能产生强大的抗肿瘤反应。在这些患者中使用糖皮质激素可能会抑制一些这种机制的“协同作用”。在一项针对接受低剂量和高剂量糖皮质激素治疗患者的回顾性分析中,发现与接受高剂量糖皮质激素治疗的患者相比,接受低剂量糖皮质激素治疗的患者总体生存期和治疗失败时间显著延长。
此外,IFN-γ信号传导可以被几种药物靶向,包括JAK抑制剂托法替尼,它可能对ICI结肠炎有效,但也可能直接干扰抗肿瘤反应。类似地,CTLA-4融合蛋白(如阿巴西普)也被建议用于治疗ICI毒性,特别是心肌炎。虽然这些药物在控制ICI毒性方面很有可能有效,但它们也可能直接逆转ICI本身的活性。
小结
优化癌症免疫治疗中的irAE管理是一个紧迫的临床问题。虽然已经有了irAE的管理指南,但这些指南几乎完全基于专家意见和小型回顾性临床研究,目前仍缺乏前瞻性治疗试验。由于每种毒性的机制、严重程度和治疗反应可能不同,所以这些试验应当涉及不同的毒性,而不是将多种毒性捆绑在一起。
目前,我们才刚刚开始了解驱动这些毒性的机制,它们有望为人类的自身免疫和免疫稳态提供新的见解。这些领域的进展对于更广泛地推进癌症免疫治疗至关重要。
参考文献:
1.Immune mechanisms of toxicity from checkpoint inhibitors. Trends Cancer.2023 Jul;9(7):543-553.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#毒性# #免疫检查点抑制剂# #ICIs#
32