Circ Res:天津医科大学陈雄文等团队合作发现蛋白激酶A是生理和病理心肌肥大的主要调节因子
2024-01-28 iNature iNature 发表于上海
该研究发现蛋白激酶A是生理和病理心肌肥大的主要调节因子。
交感病理肾上腺素能系统及其主要效应体PKA(蛋白激酶A)被激活以维持心输出量以应对生理或病理应激源。PKA是否以及如何在生理性心肌肥厚(CH)和病理性CH (PaCH)中起作用尚不清楚。
2024年1月24日,天津医科大学陈雄文及天普大学Xiaoying Zhang共同通讯在Circulation Research(IF=20)在线发表题为“Protein Kinase A Is a Master Regulator of Physiological and Pathological Cardiac Hypertrophy”的研究论文,该研究发现蛋白激酶A是生理和病理心肌肥大的主要调节因子。
研究结果发现,(1) cPKAi延缓了出生后心脏生长,钝化了运动诱导的生理性CH;(2)交感神经肾上腺素能系统的激活、内源性PKA抑制肽α (PKA inhibitory peptide α)的缺失以及非规范PKA激活剂的刺激导致TAC后心脏PKA被激活;(3) cPKAi改善TAC诱导的PaCH,增加Ca2+流入,减弱异丙肾上腺素和苯肾上腺素引起的新生大鼠心肌细胞肥大;(4) cPKAi通过降低Akt活性抑制mTOR信号,抑制TAC诱导的蛋白合成,但增强抑制GSK-3α和GSK-3β信号;(5) cPKAi通过降低RPN6磷酸化降低泛素-蛋白酶体系统对蛋白质的降解;(6) cPKAi增加抗肥厚ANP的表达;(7) cPKAi改善了已建立的PaCH,提高了动物存活率。综上,心肌细胞PKA通过调节蛋白质的合成和降解,是生理上CH和PaCH的主要调节剂。cPKAi是一种治疗PaCH的新方法。

C型心肌肥厚(CH)是在生理或病理应激条件下为满足心输出量需求而增加的负荷而产生的一种适应。生理性CH (PhCH)在出生后生长、怀孕和运动训练期间随着心脏大小的增加而发生,而它对收缩功能没有负面影响,并且随着时间的推移没有不良影响面对生理应激,交感-肾上腺素能系统(SAS)的激活是提供短期适应的重要机制。然而,SAS及其主要效应物PKA(蛋白激酶A)是否在生理CH中起作用尚不清楚。
由于高血压、心肌梗死或瓣膜功能障碍导致的SAS和PKA持续激活会对心脏产生不良影响。最初的代偿性肥厚过程可演变为病理性CH (PaCH),并导致收缩功能障碍、心肌硬化、间质纤维化,最终导致心力衰竭。预防和治疗PaCH被认为是减少心脏应激患者心力衰竭和心律失常的重要措施,但这一需求尚未得到满足。预防PaCH 的新方法是必要的。
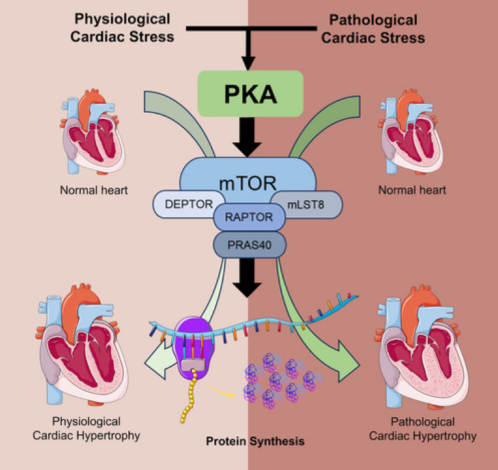
机理模式图(图源自Circulation Research )
PKA是SAS系统的主要心脏效应物,通过直接磷酸化不同的蛋白效应物或调节特定基因的转录,负责调节心血管稳态和心脏病发病过程中的许多细胞过程。PKA可通过调控核PKA,进而调控cAMP反应元件结合蛋白(CREB)介导的肥厚基因转录,从而促进心肌细胞肥厚。相反,有报道称PKA使HDAC5磷酸化以抑制其转位出核,从而减弱CH。核PKA激活诱导HDAC4蛋白水解,释放抑制MEF2活性的抗肥厚片段更有趣的是,PDE3和PDE4的抑制增加了cAMP的池,导致CH。与此一致的是,PDE2的激活减弱了儿茶酚胺诱导的cAMP/PKA过度激活,以保护梗死的心脏。然而,PDE2的抑制增加了另一个cAMP库,通过PKA依赖的NFAT磷酸化来抑制CH因此,PKA在PaCH中的作用一直存在争议,由于之前没有心肌细胞完全PKA敲除动物模型,PKA在PaCH中的作用尚未得到明确阐明。
该研究表明,PKA通过统一的PKA调节的蛋白质合成和降解机制调节出生后生理性心肌细胞生长、运动诱导的PhCH、压力过载诱导或Ca2+流入增加诱导的PaCH,尽管可能存在细微差异。在心脏应激时,PKA活性可通过SAS激活和非规范PKA激活剂增强,并伴随内源性PKIα心脏的减少。cPKAi可以阻止PKA过度激活,抑制基础PKA活性,诱导抗肥厚分子表达来预防或治疗PaCH,这需要在更多的翻译环境中进一步测试。总之,该研究表明,选择性抑制PKA可能是改善PaCH和预防继发性心力衰竭的新策略。
原文链接:
https://doi.org/10.1161/CIRCRESAHA.123.322729
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#心肌肥大# #蛋白激酶A#
65