NEJM Evid:复方苯丁胺/托吡酯缓释剂可用于青少年肥胖治疗
2022-05-04 网络 网络
生活方式疗法是儿童肥胖症治疗的基础,但由于疾病的复杂性以及驱动人类能量调节的遗传、环境、社会因素和生物力量等多重影响,因此作为一种单一方法经常失败。 1-3 事实上,许多 患有肥胖症的青少年仅通过生活
生活方式疗法是儿童肥胖症治疗的基础,但由于疾病的复杂性以及驱动人类能量调节的遗传、环境、社会因素和生物力量等多重影响,因此作为一种单一方法经常失败。 1-3 事实上,许多 患有肥胖症的青少年仅通过生活方式治疗无法实现或维持具有临床意义的体重减轻。 4-6 奥利司他和利拉鲁肽在青少年生活方式治疗之外可降低体重指数(BMI;体重(千克)除以身高(米)的平方) 分别约为 3% 和 4.5%,是目前唯一获得美国食品和药物管理局 (FDA) 批准用于青少年长期使用的抗肥胖药物7、8; 只有利拉鲁肽获得了欧洲药品管理局的批准。 因此,肥胖青少年需要更多选择。
2012 年 7 月,FDA 批准了速释芬特明 (PHEN) 和缓释托吡酯 (TPM) 的固定剂量组合,作为超重或成人慢性体重管理的低热量饮食和增加体力活动的辅助手段。肥胖。肥胖成人随机分配至高剂量 PHEN/TPM (15 mg/92 mg) 治疗 1 年后,减去安慰剂后的平均体重减轻 9.8% 至 11.0%,而随机分配至中等剂量 PHEN 的患者/TPM 实现了 7.5% 的体重减轻(7.5 毫克/46 毫克)。10,11 值得注意的是,持续治疗后体重减轻持续了 2 年以上,提供了持久性的证据。12 除了体重减轻,参与者被随机分配到PHEN/TPM 显着降低了血压、改善了血糖参数、增加了高密度脂蛋白胆固醇 (HDL-C) 并降低了甘油三酯。10,12 在肥胖的青少年中,PHEN/TPM 的 8 周药代动力学和药效学试验证明暴露与成人中观察到的相当,并且具有可耐受的安全性。 13
我们进行了一项随机、双盲、安慰剂对照的临床试验,评估了每天一次口服 2 剂 PHEN/TPM(7.5 mg/46 mg 和 15 mg/92 mg)的疗效和安全性,持续 56 周,作为 作为生活方式治疗的辅助手段,用于肥胖青少年的体重管理。 我们假设与安慰剂相比,两种剂量的 PHEN/TPM 都会导致 BMI 降低更大的百分比。
这是一项多中心、随机、双盲、安慰剂对照的临床试验,旨在评估 PHEN/TPM 在 56 周治疗期间对肥胖青少年的安全性和有效性。该试验于 2019 年 5 月 2 日至 2021 年 4 月 16 日在美国的 26 个地点进行。
符合条件的参与者年龄在 12 岁至 17 岁以下,年龄和性别的 BMI 为 95% 或更高,Tanner 阶段大于 1,体重稳定,并且有记录在改变生活方式后体重减轻不足的历史。 主要排除标准包括抗肥胖药物治疗、减肥手术或饮食失调史、兴奋剂使用、1 型糖尿病、先天性心脏病、已知遗传或内分泌来源的肥胖、血压升高、双相情感障碍或精神病史、重度抑郁症 精神障碍,目前中度或更严重的抑郁症,或存在或有自杀行为或意图采取行动的想法的历史。
参与者以 1:1:2 的比例随机分配接受安慰剂、中剂量 PHEN/TPM (7.5 mg/46 mg) 或最高剂量 PHEN/TPM (15 mg/92 mg),每天口服一次。 早晨。 随机化按年龄组(12 至 14 岁对 15 至 16 岁)和性别进行分层。无法耐受指定剂量的参与者被转换为降低剂量水平或可以休药假,通常限制在不到 2 周。 如果在降低滴定和/或药物假期和重新开始治疗后不耐受仍然存在,则将参与者从研究治疗中移除,并鼓励他们继续参与试验以根据方案进行后续评估。
所有参与者,无论分组如何,都被要求在整个研究期间遵循代表 500 卡路里/天赤字的轻度低热量饮食调整计划,并在可耐受的情况下为青少年实施基于家庭的生活方式调整计划。 生活方式计划包括体育活动、行为改变和家庭支持。 在研究协调员或营养师的例行研究访问中,所有地点都实施了相同的生活方式改变计划,包括对参与者及其父母/监护人的培训。 通常,5 到 15 分钟的访问时间专门用于生活方式培训,早期研究访问(基线到第 12 周)接近此范围的高端,而研究后期访问则接近低端。
主要终点是 BMI 从随机化到第 56 周的平均百分比变化。次要终点包括从随机化到第 56 周的参与者实现 5%、10% 和 15% 或更大的 BMI 降低以及腰围百分比的变化周长、空腹胰岛素和全身胰岛素敏感性指数 (WBISI)、甘油三酯和 HDL-C 的百分比变化以及血压。 WBISI 也称为松田指数,它提供了源自标准 2 小时口服葡萄糖耐量试验的胰岛素敏感性估计值。 WBISI 评分范围很广,但通常在 0 到 10 之间,评分越低表示胰岛素抵抗越大,评分越高表示胰岛素敏感性越高;青少年的正常范围尚未确定。 探索性终点包括从随机化到第 56 周体重对儿童生活质量 (IWQOL-Kids) 问卷评分和血糖和血脂标志物的影响的变化。 IWQOL-Kids 评估与年龄相适应的与体重相关的生活质量,包括身体舒适度、身体自尊、社交生活和家庭关系。分数范围从 0(最差的生活质量)到 100(最好的生活质量);青少年的正常范围尚未确定。
研究结果

在筛选的 325 名参与者中,227 人被随机分配接受治疗,223 人接受了至少一剂治疗; 56 人接受安慰剂,54 人接受中剂量 PHEN/TPM,113 人接受最高剂量 PHEN/TPM(图 1,CONSORT 图)。 该研究由分别接受安慰剂、中剂量 PHEN/TPM 和最高剂量 PHEN/TPM 的 29 名 (56.9%)、37 名 (75.5%) 和 73 名 (65.2%) 参与者完成。 在基线时,三个治疗组之间(表 1)或完成试验的参与者与未完成试验的参与者之间没有显着差异(表 S2)。 大多数参与者是女性(121 [54.3%])和白人(149 [66.8%])。 平均 (±SD) 年龄为 14.0±1.4 岁,其中 136 名参与者 (61.0%) 在 12 至 14 岁阶层,87 人 (39.0%) 在 15 至 16 岁阶层。 平均 (±SD) 基线体重、BMI 和 BMI 占第 95 个百分位数的百分比分别为 106.1±23.7 kg、37.8±7.1 kg/m2 和 142.4±26.8%。
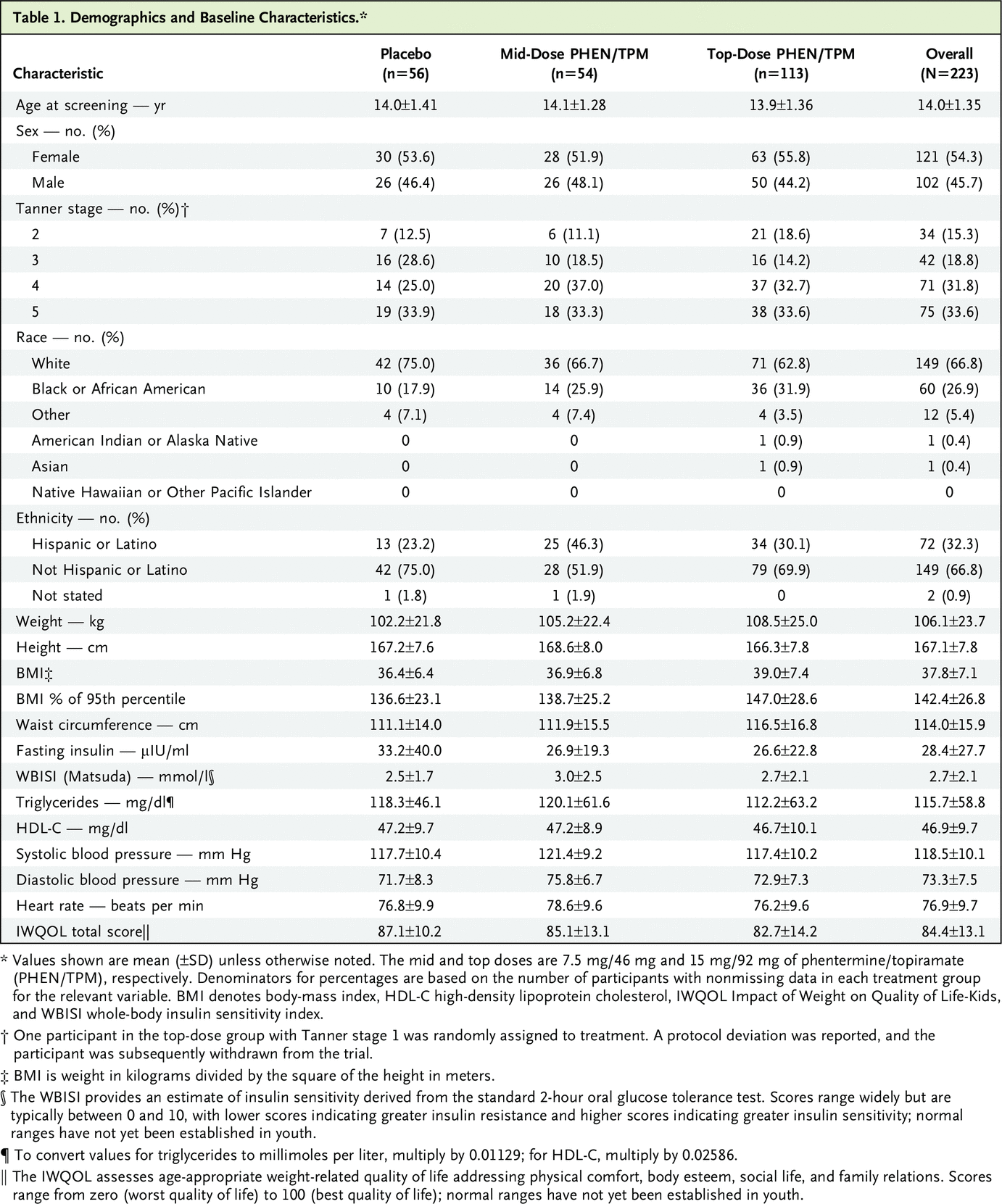
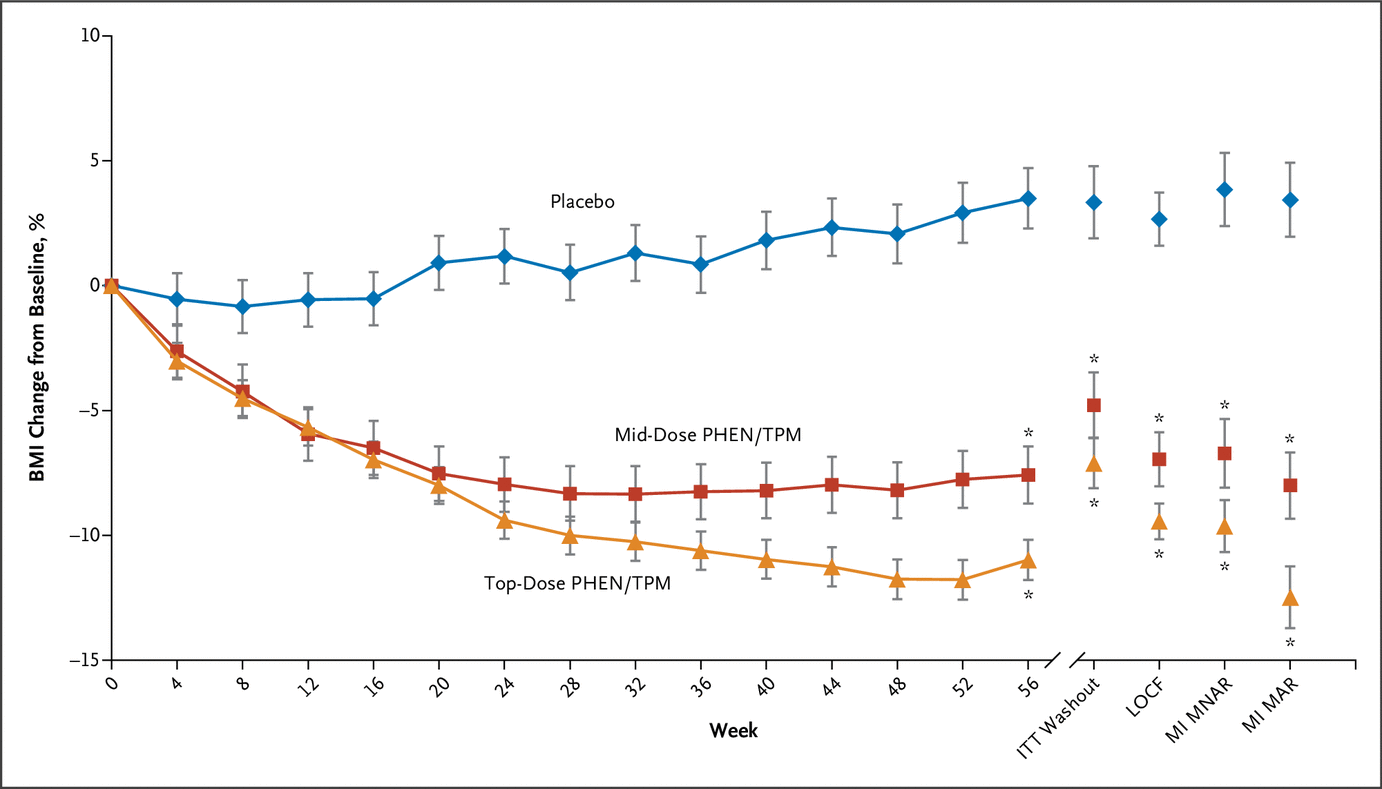
BMI 和腰围结果如表 2 所示。最高剂量和安慰剂在第 56 周时 BMI 百分比变化的治疗差异具有统计学意义(LS 平均差异,-10.44 个百分点;95% CI,-13.89 至 -6.99 ; P<0.001) (图 2)。
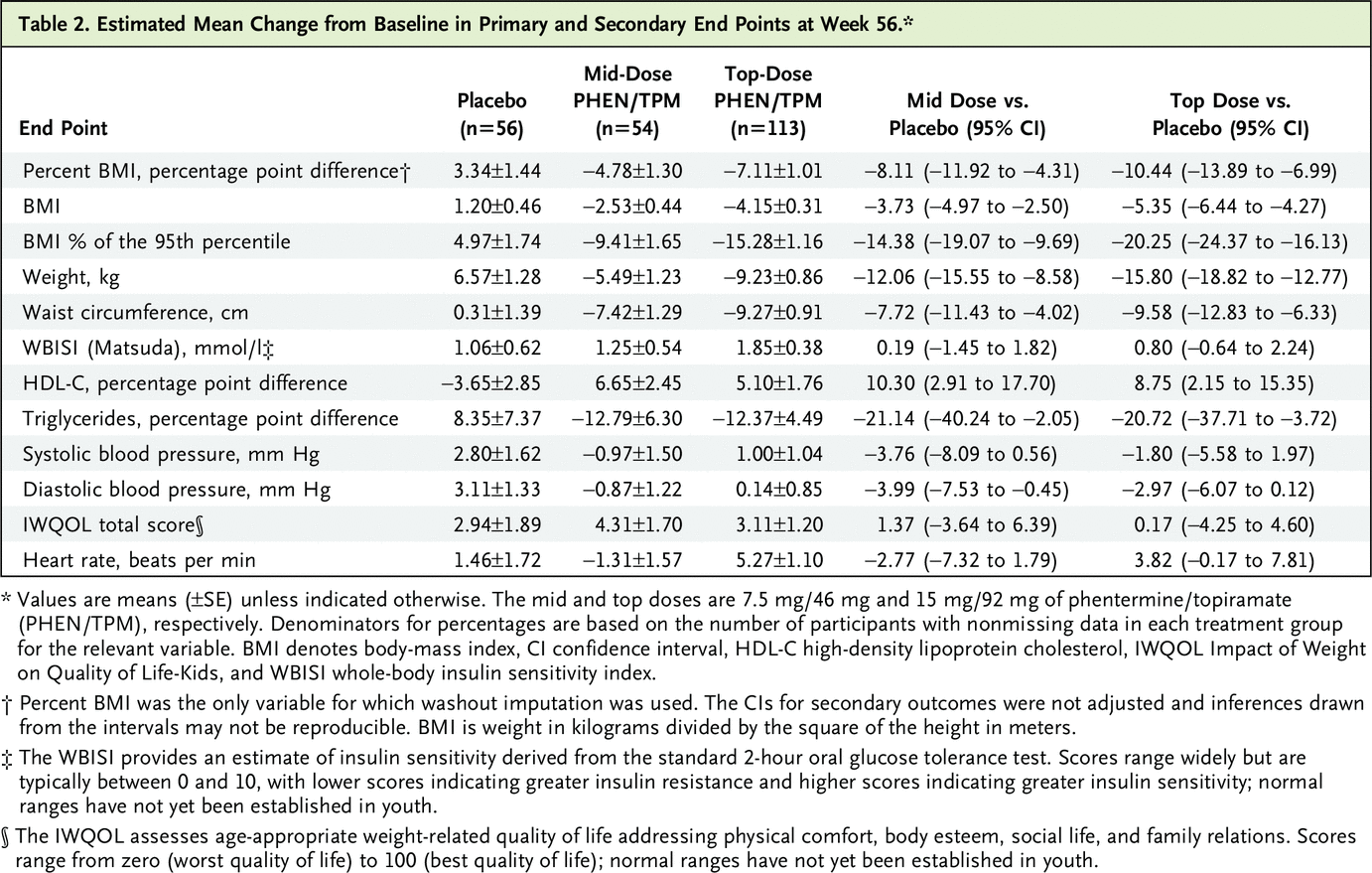
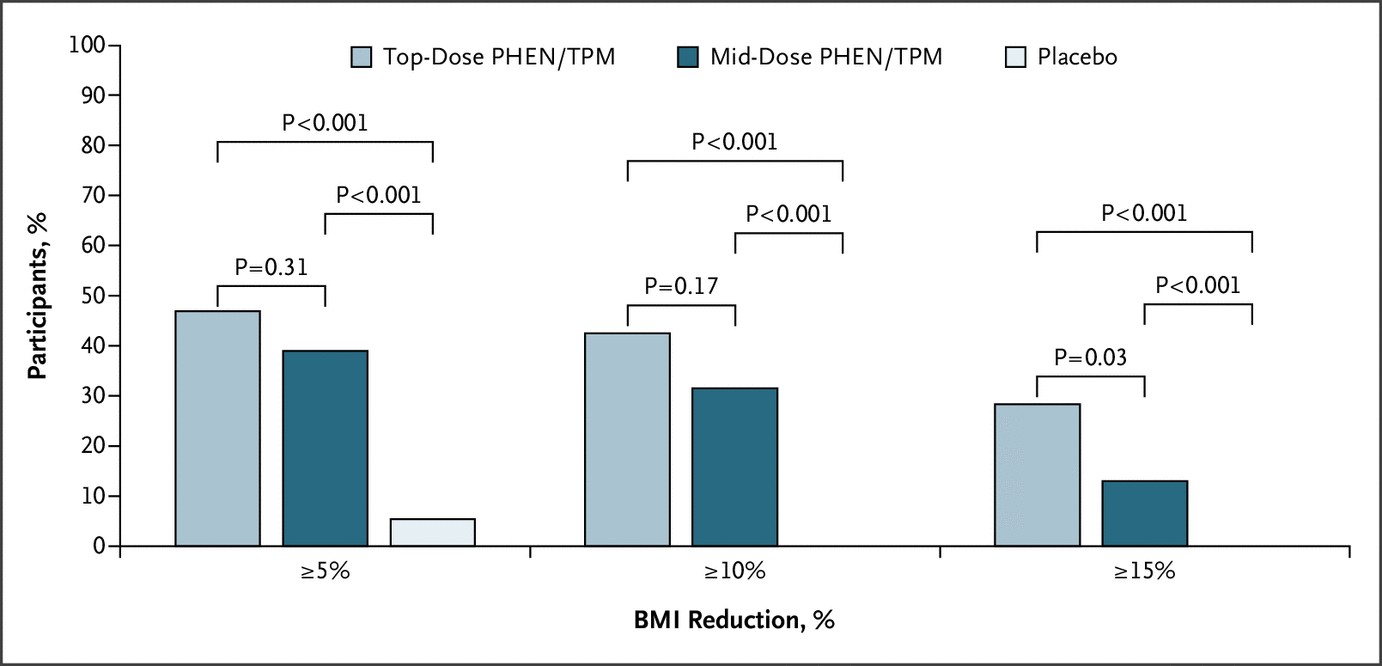
中间剂量和安慰剂在第 56 周时 BMI 百分比变化的治疗差异也具有统计学意义(LS 平均差异,-8.11%;95% CI,-11.92 至 -4.31;P<0.001)(图 2)。第 56 周时最高剂量和中剂量之间 LS 平均 BMI 百分比变化的差异无统计学意义(LS 平均差异,-2.33%;95% CI,-5.27 至 0.62;P=0.12)。图 3 显示了接受安慰剂、中剂量和最高剂量的参与者的 BMI 降低 5% 或更大的百分比(分别为 3 [5.4%]、21 [38.9%] 和 53 [46.9%])、10 % 或更大(分别为 0 [0.0%]、17 [31.5%] 和 48 [42.5%])和 15% 或更大(0 [0.0%]、7 [13.0%] 和 32 [28.3%] , 分别) 用于 ITT 人群。与安慰剂相比,中剂量和最高剂量治疗导致 BMI 降低 5% 或更多的参与者比例更高(中剂量:RR,4.6;95% CI,1.7 至 12.7;P<0.001;最高剂量:RR, 5.6;95% CI,2.2 至 14.4;P<0.001),BMI 比安慰剂降低 10% 或更多(中剂量:RR,9.3;95% CI,2.3 至 38.0;P<0.001;最高剂量:RR,12.2 ;95% CI,3.1 至 48.3;P<0.001),并且 BMI 比安慰剂降低 15% 或更多(中剂量:RR,4.3;95% CI,1.0 至 19.3;P = 0.008;最高剂量:RR, 8.1;95% CI,2.0 至 32.7;P<0.001)。在第 56 周时,最高剂量与安慰剂和中剂量与安慰剂之间腰围平均变化的治疗差异为 -9.58 cm(95% CI,-12.83 至 -6.33;P<0.001)和 -7.72 cm(95% CI,分别为 -11.43 至 -4.02;P<0.001)。
心脏代谢危险因素和与健康相关的生活质量结果见表 2。甘油三酯和 HDL-C 的最高剂量和安慰剂之间的 LS 平均治疗差异分别为 -20.72%(95% CI,-37.71 至 -3.72)和 8.75% (95% CI,2.15 至 15.35)。 中剂量和安慰剂之间甘油三酯和 HDL-C 的 LS 平均治疗差异分别为 -21.14%(95% CI,-40.24 至 -2.05)和 10.30%(95% CI,2.91 至 17.70)。 在第 56 周,任何组的空腹胰岛素、WBISI、IWQOL-Kids 问卷评分、血糖标志物或总或低密度脂蛋白胆固醇的变化没有统计学上的显着差异。 第 56 周收缩压的变化在组间没有显着差异。
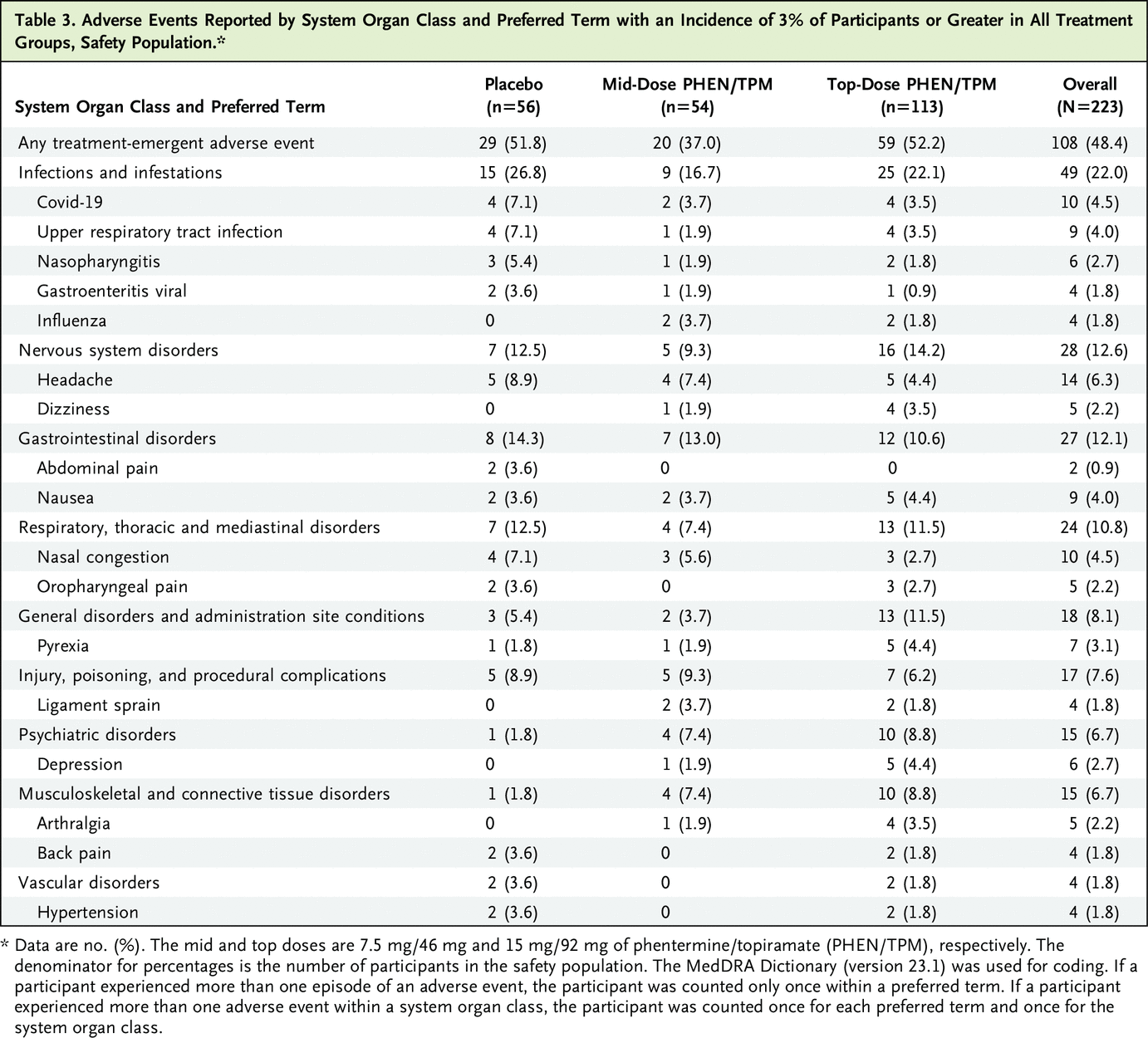
在安慰剂组、中剂量组和最高剂量组中,参与者报告至少一种不良事件的发生率分别为 51.8%、37.0% 和 52.2%。 三名参与者发生了导致剂量减少的不良事件:中剂量组一名(1.9%)和最高剂量组两名(1.8%)。 三名参与者发生了导致研究治疗中断的不良事件:安慰剂组两名(3.6%)和最高剂量组一名(0.9%)。 安慰剂组的一名参与者(2.0%)、中剂量组的一名参与者(2.0%)和最高剂量组的两名参与者(1.8%)由于治疗中出现的不良事件退出了研究。
总之,中剂量和最高剂量的 PHEN/TPM 作为生活方式治疗的辅助手段,在统计学上显着降低了肥胖青少年的 BMI 和腰围,并有利地影响了甘油三酯和 HDL-C 的水平。 安全性与在成人中观察到的相似。
原始出处:
Phentermine/Topiramate for the Treatment of Adolescent Obesity. DOI:https://doi.org/10.1056/EVIDoa2200014 https://evidence.nejm.org/doi/full/10.1056/EVIDoa2200014
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#青少年肥胖#
78
#糖尿病#没有
126
NEJM上果然牛,感谢梅斯更新及时
76