Nature Metabolism:肥胖和减重情况下不同器官内皮细胞的动态变化图谱
2022-12-02 代谢网 代谢网 发表于安徽省
肥胖导致的各种疾病往往需要内皮细胞的参与,然而不同器官或同一器官中的内皮细胞在功能和分子标记方面存在高度异质性。肥胖对内皮细胞的影响尚不明确。
由于饮食和生活方式的改变,肥胖人群在全球迅速增加,有6.5亿成年人被归类为肥胖人群。肥胖可促进多种急慢性疾病的发生,包括动脉粥样硬化、心力衰竭、卒中、肺动脉高压、肾血管疾病、微血管功能障碍和一系列肝脏血管并发症。血管的内皮细胞(ECs)控制着营养物质、代谢物、氧气和二氧化碳在血液和器官之间的运输。肥胖可导致EC功能障碍,其特征是一氧化氮生物利用度降低和氧化损伤增加。然而不同器官的EC在功能和分子表达上是不同的,同一器官中EC功能也有差异,肥胖对不同器官中EC的影响尚不清楚。
2022年11月18日,莱比锡大学的Bilal N. Sheikh团队在Nature Metabolism上发表了题为《Single-cell profiling of vascular endothelial cells reveals progressive organ-specific vulnerabilities during obesity》文章。该研究中作者通过单细胞测序分析了正常饮食和西方饮食(WD)小鼠的脑、心脏、肺、肾脏、肝脏、内脏脂肪组织(vis AT)和皮下脂肪组织(sub AT)7个主要器官的内皮细胞(EC),发现肥胖会诱导内皮细胞发生器官特异性变化。文章还鉴定了肥胖诱导的不同器官中EC亚群、比例和基因表达的变化,基因表达变化包括脂质处理、代谢途径、AP1转录因子和炎症信号。作者进一步分析了正常饮食、持续WD饮食和回归饮食等不同饮食干预方式对小鼠7个器官的EC的影响,并通过GWAS整合分析确定了一系列肥胖诱导的血管和神经疾病的异常表达的基因。该工作首次系统阐明了肥胖对不同器官中EC的影响,为相关研究提供了丰富且实用的资源,为进一步发现相关疾病的治疗靶点提供了线索。
 肥胖诱导内皮细胞发生器官特异性变化
肥胖诱导内皮细胞发生器官特异性变化
为了确定肥胖对血管EC的影响,作者给8周龄的小鼠喂食西方饮食(WD)或对照饮食3个月。待小鼠出现预期的肥胖表型,作者通过流式分选(FACS)从脑、心脏、肺、肾脏、肝脏、内脏脂肪组织(vis AT)和皮下脂肪组织(sub AT)7个主要器官中分离ECs(CD31+ CD45low)进行scRNA-seq。根据EC细胞标记物Pecam1(Cd31),Cdh5和Flt1的从单细胞数据中分离出99739个EC细胞进行第一次聚类分群。作者根据标志物将每个器官中的血管EC分为三大亚群,包括动脉与小动脉(art)、毛细血管(cap)和静脉与小静脉(ven)。作者计算了不同器官的EC中与对照小鼠相比肥胖小鼠的差异表达基因(DEGs)的数量,发现AT ECs显示出最多的DEGs,特别是其cap EC亚群,其次是肝cap ECs。这提示,AT和肝脏作为代谢的关键器官,其EC受肥胖的影响最大。接下来,作者确定了肥胖小鼠每个器官EC中的top DEGs并计算了不同器官中top DEGs的相关性,发现肥胖诱导的DEGs在不同器官的EC之间表现出较低的一致性。这表明肥胖以器官特异性的方式影响EC。
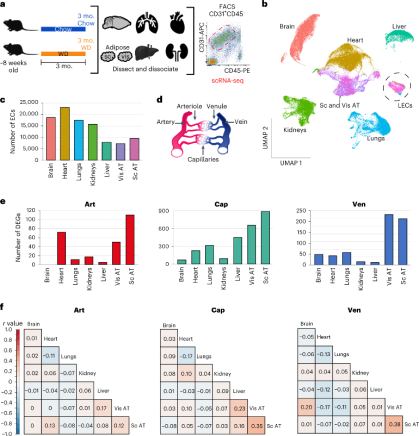 不同器官中肥胖诱导的EC的变化
不同器官中肥胖诱导的EC的变化
为了确定肥胖如何特异地影响不同器官的EC,作者对每个器官中的EC进行了聚类分群和细胞类群鉴定。
AT EC:肥胖和正常小鼠的AT ECs的DEG数量最多。内脏AT和皮下AT分别有10个和12个EC亚群。与对照组相比,肥胖小鼠的内脏AT中的cap2亚群比例显著升高,该群主要表达编码细胞外基质(ECM)和整合素相互作用的基因。其中,在内脏AT和皮下AT中均观察到Itgb1 mRNA和整合素-β1蛋白水平的显著上调。肥胖小鼠AT中与血管生成、增殖相关的EC比例增加三倍以上,而肥胖小鼠皮下AT中11%的EC表现出血管生成或增殖性表型,这与肥胖中AT的扩张和重塑一致。
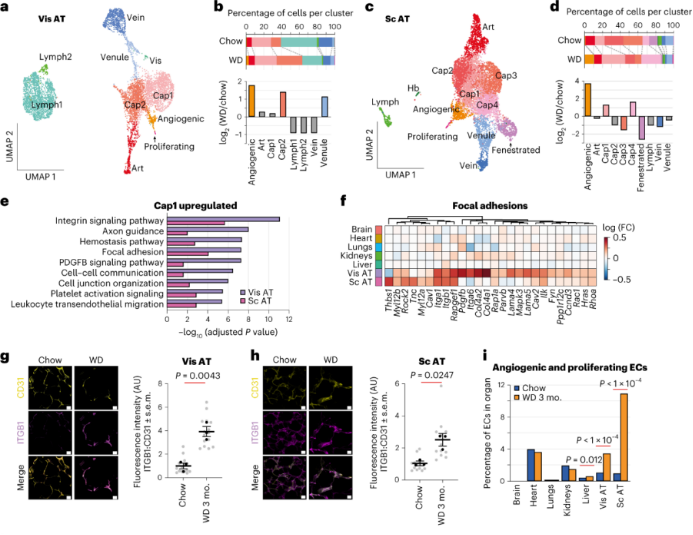 肝脏ECs:肝脏是脂质的主要代谢器官。作者发现肝脏中ECs可以分为8个亚群,其中有2个肝脏特异性EC亚型,EC-liver 1和EC-liver 2。和内脏AT一样,肥胖小鼠中肝脏cap2亚群比例也增加了。总体而言,肥胖小鼠肝脏EC中脂质动员相关基因表达上调,特别是EC-liver 1和EC-liver 2亚群。
肝脏ECs:肝脏是脂质的主要代谢器官。作者发现肝脏中ECs可以分为8个亚群,其中有2个肝脏特异性EC亚型,EC-liver 1和EC-liver 2。和内脏AT一样,肥胖小鼠中肝脏cap2亚群比例也增加了。总体而言,肥胖小鼠肝脏EC中脂质动员相关基因表达上调,特别是EC-liver 1和EC-liver 2亚群。
此外,肥胖引发了肝cap EC中肝脏特异性脂肪酸转运蛋白Fabp1的表达增加,而在AT的动脉和静脉EC中脂肪酸转运蛋白Fabp4、Cd36、Fabp5、Dbi和Lpl的表达增加,实验发现肥胖相关的肝脏EC Fabp1上调是由脂肪酸通过PPARα和TBK1-IKKε-IRF3途径引起的。这表明肥胖引起的肝脏EC中脂质动员和代谢网络的转变。GO分析显示在cap2 EC中血小板活化和聚集相关通路显著富集,提示血小板对cap EC的黏附增强。实验证实与对照组的肝脏相比,肥胖小鼠的肝脏显示出CD62P染色的增加,这与血小板活化和对肝脏EC的粘附增加一致。
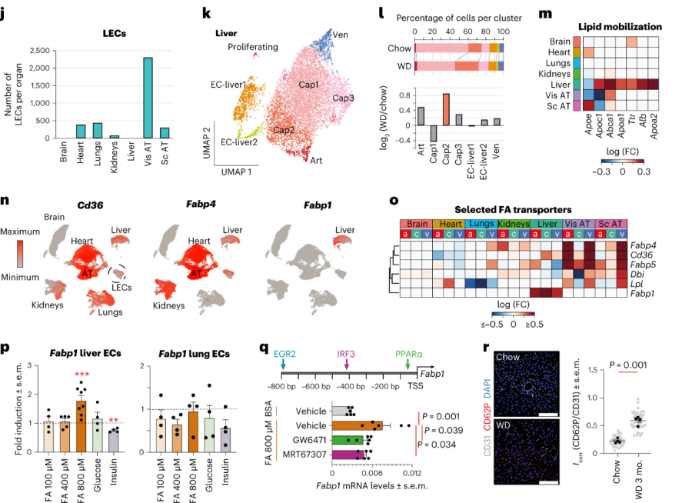 心脏ECs:肥胖会促进动脉粥样硬化,诱发心肌梗死。scRNA-seq分析显示心脏ECs有11个EC亚群。其中肥胖小鼠的小动脉EC亚群比例显著增加,其高表达剪切应力和动脉粥样硬化、ECM-受体相互作用和白细胞跨内皮迁移等通路的基因,高表达激活脂肪酸摄取的基因Meox2和Tcf15。肥胖导致动脉EC中TGFβ信号通路和AP1转录因子网络的相关基因的上调。AP1转录因子与动脉粥样硬化之间存在密切关联,提示在肥胖小鼠中心脏动脉EC更容易发生动脉粥样硬化。
心脏ECs:肥胖会促进动脉粥样硬化,诱发心肌梗死。scRNA-seq分析显示心脏ECs有11个EC亚群。其中肥胖小鼠的小动脉EC亚群比例显著增加,其高表达剪切应力和动脉粥样硬化、ECM-受体相互作用和白细胞跨内皮迁移等通路的基因,高表达激活脂肪酸摄取的基因Meox2和Tcf15。肥胖导致动脉EC中TGFβ信号通路和AP1转录因子网络的相关基因的上调。AP1转录因子与动脉粥样硬化之间存在密切关联,提示在肥胖小鼠中心脏动脉EC更容易发生动脉粥样硬化。
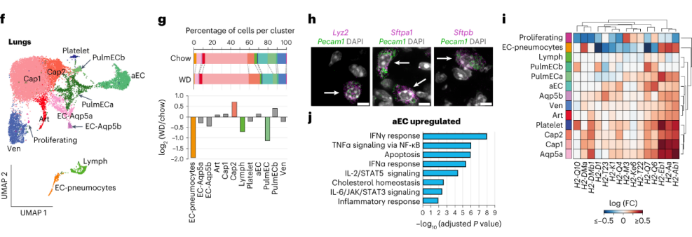
 肺ECs:肺EC有13个亚群,包括两个肺EC特异性EC亚群pulmECa和pulmECb。作者还检测到一个特殊的EC亚群,它同时表达EC标志物(Pecam1和Flt1)和肺细胞的标志物(Sftpa1、Sftpb和Sftpc),将其称为“EC肺细胞”,并通过荧光原位杂交(FISH)证实了它的存在。相对于其他ECs,EC肺细胞高表达核糖体和代谢基因。肥胖小鼠的EC肺细胞数目显著减少。在肥胖小鼠中,pulmECa和LEC比例减少,而cap2 EC亚群比例增加。肥胖小鼠的肺cap EC显示出炎症网络的激活,并表达组织相容性基因;aEC亚群高表达IFN、TNFα、IL-2和IL-6等基因。这表明,肥胖会增加肺部EC的炎症状态。
肺ECs:肺EC有13个亚群,包括两个肺EC特异性EC亚群pulmECa和pulmECb。作者还检测到一个特殊的EC亚群,它同时表达EC标志物(Pecam1和Flt1)和肺细胞的标志物(Sftpa1、Sftpb和Sftpc),将其称为“EC肺细胞”,并通过荧光原位杂交(FISH)证实了它的存在。相对于其他ECs,EC肺细胞高表达核糖体和代谢基因。肥胖小鼠的EC肺细胞数目显著减少。在肥胖小鼠中,pulmECa和LEC比例减少,而cap2 EC亚群比例增加。肥胖小鼠的肺cap EC显示出炎症网络的激活,并表达组织相容性基因;aEC亚群高表达IFN、TNFα、IL-2和IL-6等基因。这表明,肥胖会增加肺部EC的炎症状态。
 肾ECs:肾脏中有13个EC亚群,包括两个髓质ECs(mECs)、肾小球ECs(gEC)、Aqp1阳性EC(Aqp1小动脉ECs)和高AP1转录因子EC(AP1-EC)。
肾ECs:肾脏中有13个EC亚群,包括两个髓质ECs(mECs)、肾小球ECs(gEC)、Aqp1阳性EC(Aqp1小动脉ECs)和高AP1转录因子EC(AP1-EC)。
mEC1和mEC2亚群高表达与代谢途径和碳酸氢盐回收相关的基因,mEC1中溶质转运蛋白表达水平更高。肥胖会导致mEC1比例增加,其离子转运体、中性氨基酸转运体和葡萄糖转运体表达上调;肥胖诱导mEC2细胞中线粒体呼吸和代谢基因的上调。因此,肥胖对肾脏中不同mEC的影响有差异。在肥胖小鼠gEC中,抑制Notch信号和血管生成的基因Dlk1上调最强,其蛋白水平增加了两倍。这提示了肥胖特异性影响肾脏皮质EC、mEC和gEC。
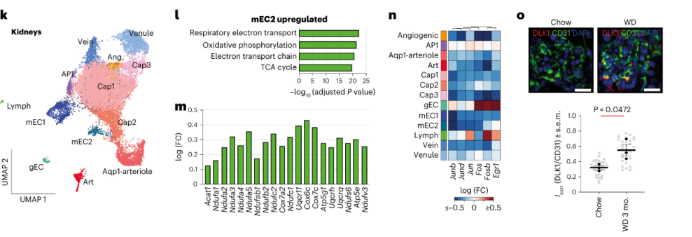 脑ECs:脑EC可分为8个亚群,包括孔毛细血管ECs,Hb-EC,血小板ECs和AP1-ECs。肥胖小鼠的孔毛细血管EC显示出独特的DEG。与肾脏EC类似,脑EC在肥胖中显示AP1转录因子相关基因的下调。相对于其他脑ECs,art ECs中有几个白细胞粘附基因的富集表达,并且在肥胖小鼠art EC中Vcam1、Pecam1、Alcam和Icam1上调。这提示,肥胖小鼠脑部白细胞粘附和经内皮迁移增加。孔毛细血管EC通常见于脉络丛。在肥胖孔毛细血管EC中Jam3、Pdch12、Afdn和Tjp1上调,几种溶质转运蛋白表达下调。这提示,肥胖会减少脉络丛途径的物质运输。实验也表明,肥胖小鼠脉络丛中孔毛细血管EC的染料摄取减少。鉴于脉络丛中EC转运和功能缺陷与记忆缺陷和神经变性有关,该研究揭示了肥胖与神经稳态失调之间的潜在联系。
脑ECs:脑EC可分为8个亚群,包括孔毛细血管ECs,Hb-EC,血小板ECs和AP1-ECs。肥胖小鼠的孔毛细血管EC显示出独特的DEG。与肾脏EC类似,脑EC在肥胖中显示AP1转录因子相关基因的下调。相对于其他脑ECs,art ECs中有几个白细胞粘附基因的富集表达,并且在肥胖小鼠art EC中Vcam1、Pecam1、Alcam和Icam1上调。这提示,肥胖小鼠脑部白细胞粘附和经内皮迁移增加。孔毛细血管EC通常见于脉络丛。在肥胖孔毛细血管EC中Jam3、Pdch12、Afdn和Tjp1上调,几种溶质转运蛋白表达下调。这提示,肥胖会减少脉络丛途径的物质运输。实验也表明,肥胖小鼠脉络丛中孔毛细血管EC的染料摄取减少。鉴于脉络丛中EC转运和功能缺陷与记忆缺陷和神经变性有关,该研究揭示了肥胖与神经稳态失调之间的潜在联系。
 饮食干预对ECs基因表达影响
饮食干预对ECs基因表达影响
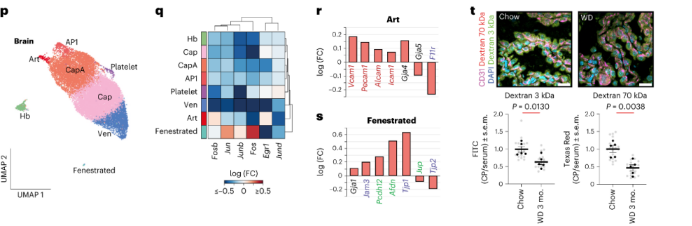
为了研究饮食干预如何影响肥胖和EC表型,作者进行了3组小鼠饮食干预实验:正常饮食(队列1,正常饮食6个月),持续WD(队列2,WD饮食6个月,小鼠发生肥胖)和回归饮食(队列3,WD饮食3个月然后正常饮食3个月,正常饮食后,小鼠的体重和体脂下降)。在4个月和6个月时收集7种组织通过FACS分离EC并进行scRNA-seq。
首先,作者确定了7个组织共有的cap EC中肥胖诱导的DEG。在持续WD小鼠中,编码泛素A52的基因Uba52在cap EC中上调最显著。编码生物钟调节因子(Dbp,Nr1d1和Nr1d2)、KLF转录因子(Klf2和Klf6)和细胞信号分子(Rhob和Shank3)的基因在持续WD小鼠中也上调,但在回归饮食组中没有上调。与应激反应和电子呼吸链相关基因在持续WD小鼠中下调。这些基因的表达水平与回归饮食后的小鼠更相似。因此,包括转录调节因子、细胞信号分子、应激反应和代谢基因在内的多个基因在持续WD的cap EC中系统性失调。
接下来,作者探究了饮食干预能否恢复持续WD引起的基因表达异常变化。如果一个基因在回归饮食组中的表达水平更接近于正常饮食组中的表达水平,而且不在持续WD组中的表达,则该基因被定义为恢复(restored)。作者发现肝cap EC对饮食干预最敏感,~88%的DEGs通过饮食干预得到恢复;来自AT、心脏、肺和大脑的cap EC中60-85%的DEGs通过饮食干预得到恢复;肾cap EC对饮食干预的反应较差,47%的上调基因和88%的下调基因不受回归饮食的影响。这表明,在器官特异性EC中,肾脏EC最容易受到肥胖的影响,且不易恢复。
 不同器官中EC对饮食干预的响应
不同器官中EC对饮食干预的响应
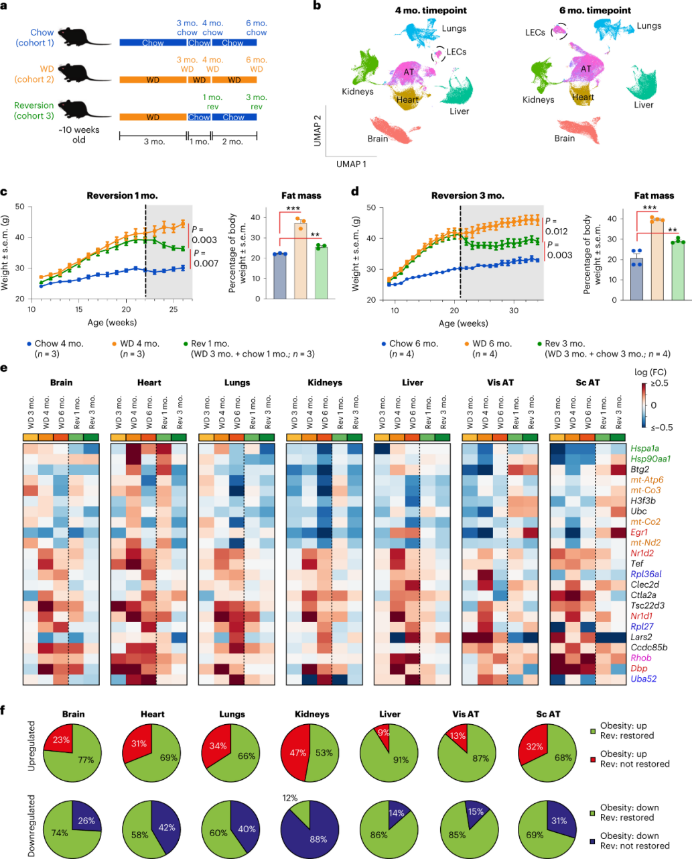
AT ECs:与肥胖小鼠AT的重塑一致,WD促进了EC血管生成和增殖。然而,与早期的3个月和4个月WD时间点相比,持续WD的皮下AT中血管生成和增殖EC的比例降低。这与临床肥胖症的血管生成缺陷一致。此外,编码缺氧诱导因子1-α(Hif1a)的基因在6个月时间点在内脏AT的cap EC中上调。这表明,AT EC表现出更严重的疾病状态。
持续WD还会导致cap EC中整合素和局灶粘连网络的上调,但是可以通过回归饮食缓解缓解。在脂肪酸转运蛋白中,AT EC中Fabp5受肥胖诱导上调最强。AT EC脂肪酸转运蛋白的表达水平在回归饮食后得到部分恢复。
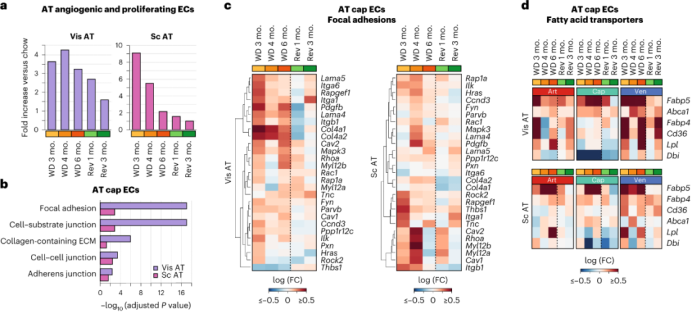 Liver ECs:持续WD饮食的小鼠的肝cap EC中炎症相关通路上调,而回归饮食小鼠中炎症相关通路没有显著上调,在回归饮食后3个月,Vcam1、Icam1、Cxcl9和Cxcl10的炎症因子表达水平恢复到正常。此外,持续WD加剧了肝脏EC中线粒体呼吸亚基的表达水平的下调、脂肪酸和脂质转运蛋白Cd36、Fabp4、Fabp5和Abca1的表达上调,回归饮食能在部分恢复上述基因的表达。这表明,回归饮食能降低肝cap EC炎症水平,部分改善EC的脂质代谢。尽管肝cap EC中的大多数DEG在回归饮食后恢复,但Apoc1、Apoa2和Apoc3的表达水平仍然很高。同样的,在回归饮食组中,低密度脂蛋白受体Ldlr mRNA表达水平仍然较低。高水平的APO蛋白和低水平的LDLR会增加心血管疾病的风险。
Liver ECs:持续WD饮食的小鼠的肝cap EC中炎症相关通路上调,而回归饮食小鼠中炎症相关通路没有显著上调,在回归饮食后3个月,Vcam1、Icam1、Cxcl9和Cxcl10的炎症因子表达水平恢复到正常。此外,持续WD加剧了肝脏EC中线粒体呼吸亚基的表达水平的下调、脂肪酸和脂质转运蛋白Cd36、Fabp4、Fabp5和Abca1的表达上调,回归饮食能在部分恢复上述基因的表达。这表明,回归饮食能降低肝cap EC炎症水平,部分改善EC的脂质代谢。尽管肝cap EC中的大多数DEG在回归饮食后恢复,但Apoc1、Apoa2和Apoc3的表达水平仍然很高。同样的,在回归饮食组中,低密度脂蛋白受体Ldlr mRNA表达水平仍然较低。高水平的APO蛋白和低水平的LDLR会增加心血管疾病的风险。
在持续WD 3个月时,血小板活化及其对肝cap EC的粘附已经显著增加。其中一群EC表达典型的血小板相关基因,持续WD增加了该亚群的比例,但在其他器官中无此现象。与持续WD相比,回归饮食的小鼠肝脏中血小板阳性EC的比例有所下调。这表明,肝内皮在肥胖时容易受损,但是可以通过减肥得到部分缓解。
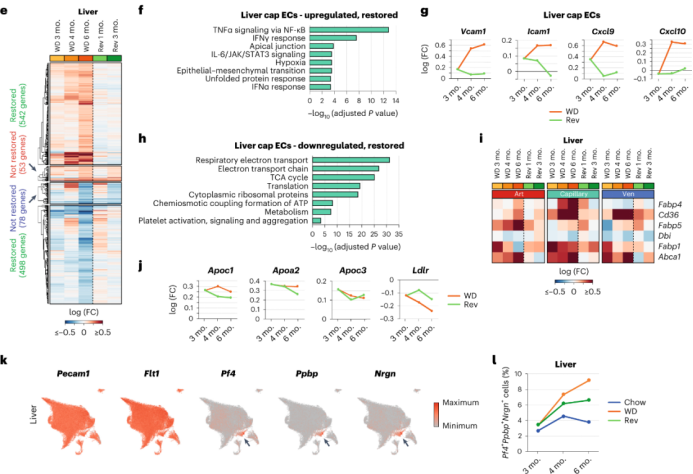 心脏ECs:在持续WD 3个月时AP1转录因子亚基的基因已经在心脏动脉EC中上调,在持续WD 6个月时进一步上调,并在小动脉EC中也上调。在回归饮食3个月后,AP1亚基的表达恢复到对照水平。这表明,改善饮食可以部分降低心脏动脉粥样硬化的风险。
心脏ECs:在持续WD 3个月时AP1转录因子亚基的基因已经在心脏动脉EC中上调,在持续WD 6个月时进一步上调,并在小动脉EC中也上调。在回归饮食3个月后,AP1亚基的表达恢复到对照水平。这表明,改善饮食可以部分降低心脏动脉粥样硬化的风险。
持续WD小鼠心脏cap ECs显示ECM相关基因的表达减少,但是可以通过回归饮食缓解。肥胖WD小鼠的心脏art、cap和ven EC中Klf基因的表达水平持续上调,回归饮食则能降低cap EC和ven EC中Klf基因的表达却不能降低art EC中Klf基因的表达。这表明虽然饮食干预可以部分缓解心脏EC的压力,但对心脏中art EC却无效。
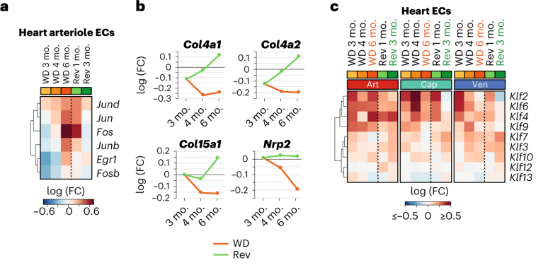 肺EC:在持续WD 3个月后,肺部的EC肺细胞亚群约减少三倍,在WD 4个月和6个月后进一步耗尽,但回归饮食能有效恢复其水平。持续WD 6个月后肺cap EC中炎症因子水平显著上调,但是饮食回归组没有此现象。持续WD组肺aEC亚群中线粒体呼吸相关的基因上调,但在饮食回归组中没有此现象。这提示,回归饮食对肺EC的改善有较明显的作用。
肺EC:在持续WD 3个月后,肺部的EC肺细胞亚群约减少三倍,在WD 4个月和6个月后进一步耗尽,但回归饮食能有效恢复其水平。持续WD 6个月后肺cap EC中炎症因子水平显著上调,但是饮食回归组没有此现象。持续WD组肺aEC亚群中线粒体呼吸相关的基因上调,但在饮食回归组中没有此现象。这提示,回归饮食对肺EC的改善有较明显的作用。
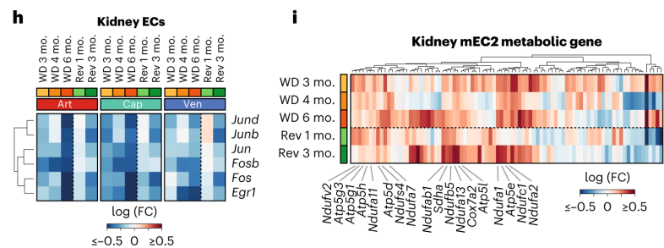
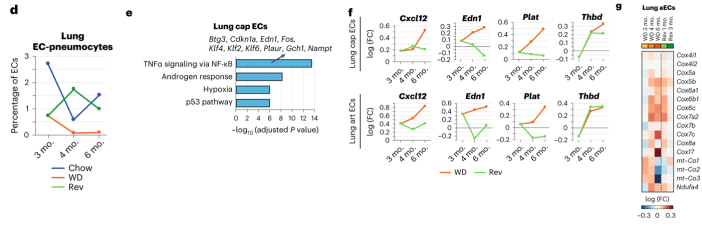 肾ECs:肾脏EC最容易受肥胖影响,并且在回归饮食后表现出最少的改善。肾脏ECs中AP1转录因子全局下调,且不能通过回归饮食恢复。持续WD会诱导肾脏mEC2中多种代谢基因的上调,包括糖酵解和呼吸基因,在回归饮食小鼠中也有此现象。肾脏mEC中代谢通路的上调与细胞应激有关。这表明短期或中度肥胖足以诱导肾脏mEC的压力状态。
肾ECs:肾脏EC最容易受肥胖影响,并且在回归饮食后表现出最少的改善。肾脏ECs中AP1转录因子全局下调,且不能通过回归饮食恢复。持续WD会诱导肾脏mEC2中多种代谢基因的上调,包括糖酵解和呼吸基因,在回归饮食小鼠中也有此现象。肾脏mEC中代谢通路的上调与细胞应激有关。这表明短期或中度肥胖足以诱导肾脏mEC的压力状态。
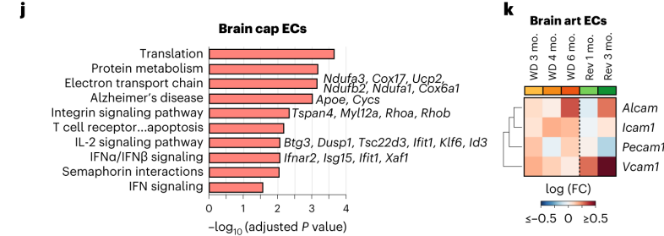
 脑ECs:在脑EC中,持续WD导致与蛋白质翻译、电子传递链、阿尔茨海默病、整合素和IFN信号传导相关的基因表达增加,但是能通过回归饮食缓解。持续WD能诱导与白细胞迁移相关的基因(如Alcam、Icam1、Pecam1和Vcam1)的上调,回归饮食只能恢复Icam1和Pecam1的表达。
脑ECs:在脑EC中,持续WD导致与蛋白质翻译、电子传递链、阿尔茨海默病、整合素和IFN信号传导相关的基因表达增加,但是能通过回归饮食缓解。持续WD能诱导与白细胞迁移相关的基因(如Alcam、Icam1、Pecam1和Vcam1)的上调,回归饮食只能恢复Icam1和Pecam1的表达。
 肥胖诱导的疾病相关基因
肥胖诱导的疾病相关基因
为了确定EC中肥胖诱导的可能增加血管功能障碍风险的DEG,作者将持续WD和正常饮食的数据集与NHGRI-EBI GWAS数据库进行了整合。NHGRI-EBI数据库采用人工策划和质量控制,包含所有已发表的符合质量阈值的GWAS研究。作者关注了与血管病变相关的遗传风险位点,如冠状动脉疾病、动脉粥样硬化、心力衰竭、高血压、中风、阿尔茨海默病和双相情感障碍。
与冠状动脉疾病相关的基因位点(包括NBEAL1和APOE)在肥胖的心脏art EC中上调。NBEAL1的基因变异会显著增加年轻人动脉粥样硬化和心肌梗塞的风险。这表明NBEAL1是一种肥胖诱导的可能增加心脏art EC疾病风险的候选基因。进一步动脉粥样硬化有关Hivep2和Cfdp1和心衰、衰老相关的p21的编码基因CDKN1A表达也上调。这提示肥胖可能会诱导心脏art EC衰老,促进心衰。SOX17遗传变异是肺动脉高压的最强危险因素。肥胖导致肺部art EC中Sox17的上调,但是回归饮食减轻了Sox17的上调。
ULK4是全身性高血压的重要遗传危险因素,在肺art、心脏art、肾脏art、脑art和gEC中,ULK4随持续WD而上调。Ulk4是唯一在所有器官EC中上调的高血压高风险基因。其他受肥胖影响的高血压相关基因只在某些器官EC中变化,包括Podxl和Ebf1在肺art EC中上调,Nbeal1和Tbx3在心脏art EC中上调,Igfbp3在心脏肾脏和脑art EC中表达降低。
神经血管系统缺陷与许多疾病有关,包括中风、阿尔茨海默病和双相情感障碍。ULK4、CAV2、HTRA1和KLF12的遗传变异都与中风风险增加有关,并且直系同源基因在肥胖的脑art EC中上调。APOE的遗传变异是阿尔茨海默病最强的已知危险因素,Apoe在肥胖的脑cap EC中上调。编码细胞骨架相互作用蛋白PLEC和PARVB的基因是阿尔茨海默病的危险因素,PLEC和SYNE1的遗传变异是双相情感障碍的高风险等位基因。这三个基因在肥胖的脑cap EC中均下调。Plec、Parvb或Syne1 水平降低会对EC形态和EC渗透率产生不利影响。鉴于血管通透性的失调是神经变性的早期标志,这些结果表明。肥胖中脑cap EC中细胞骨架网络的变化促进了疾病状态。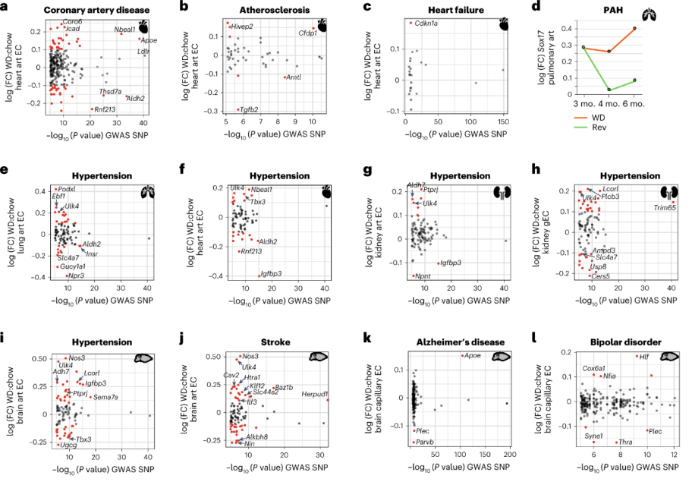 总结
总结
肥胖导致的各种疾病往往需要内皮细胞的参与,然而不同器官或同一器官中的内皮细胞在功能和分子标记方面存在高度异质性。肥胖对内皮细胞的影响尚不明确。
作者通过对7个器官的内皮细胞的单细胞测序分析发现肥胖以器官特异性的方式影响内皮细胞。AT和肝脏作为代谢的关键器官,其EC受肥胖的影响最大,EC增殖水平变强;肝脏EC中脂质动员和代谢上调,血小板对cap EC的黏附增强;肥胖导致心脏动脉EC中TGFβ信号通路和AP1转录因子网络的相关基因的上调,使其动脉EC更容易发生动脉粥样硬化;肥胖会增加肺部EC炎症水平;肥胖特异性影响肾脏皮质EC、mEC和gEC;肥胖会减少脉络丛途径的物质运输,可能影响神经系统功能。在饮食干预方面,肝cap EC对饮食干预最敏感,能通过饮食干预缓解肥胖诱导的不良表型;肾脏EC最容易受到肥胖的影响,且不易通过饮食干预恢复;肝内皮在肥胖时容易受损,饮食干预能改善EC的脂质代谢;饮食干预可以缓解心脏EC的压力,但对心脏中art EC却无效,饮食干预还能部分降低心脏动脉粥样硬化的风险。作者还通过与GWAS分析整合,发现了一系列与冠状动脉疾病、动脉粥样硬化、心力衰竭、高血压、中风、阿尔茨海默病和双相情感障碍相关的基因。
总之,该研究首次系统的阐述了肥胖和饮食干预对不同器官中EC的影响,为该领域的研究提供了参考图谱和检索资源。

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#肥胖#和#减重#情况下不同器官#内皮细胞#的动态变化图谱
202