Cell Stem Cell:肿瘤类器官用于肉瘤药物筛选效果显著
2024-11-15 儿童肿瘤前沿 儿童肿瘤前沿 发表于上海
加州大学团队用患者源性肿瘤类器官对肉瘤样本筛查,揭示其药物敏感性、耐药性模式,类器官特性与患者情况相符,虽多数确定方案未入 NCCN 指南,但有望带来肉瘤精准治疗新方案。
肉瘤是一类起源于间叶组织的恶性肿瘤,包括骨肉瘤、软骨肉瘤、平滑肌肉瘤等多种亚型。肉瘤的罕见性和异质性一直是治疗上的巨大挑战,传统治疗方法往往效果有限。虽然个性化精准医疗是一个解决思路,但每个患者的肿瘤特征都不一样,如何快速、准确地评估患肉瘤的个体对药物的敏感性呢?
近日,来自加州大学洛杉矶分校 的研究团队在 Cell Stem Cell 上发表题为 The landscape of drug sensitivity and resistance in sarcoma 的文章,通过培养患者源性肿瘤类器官(Patient-Derived Tumor Organoids, PDTOs),对110多个肉瘤样本进行了药物敏感性筛查,揭示了肉瘤对多种药物的敏感性和耐药性模式,证实类器官对治疗的反应与患者的治疗结果一致。
类器官这种新兴的研究方法是通过在体外(in vitro)培养肿瘤细胞或与之相关的细胞,形成的三维细胞结构可模拟患癌器官的复杂性。而患者源性肿瘤类器官是指最初培养的细胞取自患者活体,这能极大程度上保留患者体内原始肿瘤的关键组织学和分子特征,如特定的基因扩增、分子信号通路以及肿瘤微环境等,利于研究人员筛选出真正有效的药物。
2018年2月至2022年5月期间,研究团队收集了来自126名患者(其中40岁及以上约占1/2,0-14岁约占1/6)的194个肉瘤样本,涵盖了24种不同的肉瘤亚型。他们利用组织工程技术从这些样本中培养出PDTOs,并利用其进行了高通量药物筛选。研究测试了超过400种化疗药物和靶向药物(按样本数平均117种,范围6-423种),以评估肉瘤对不同药物的敏感性。
通过对比类器官和原发肿瘤的组织病理学特征证实,多种肿瘤的主要特征在类器官上得以维持。例如尤因肉瘤中的小圆形蓝色细胞、脊索瘤中含圆形核的空泡细胞、横纹肌肉瘤(RMS)、某些类型的骨肉瘤以及恶性外周神经鞘瘤(MPNSTs)中的梭形细胞等。(图 2A)
RNA 测序(RNA - seq)分析表明,基因组不同的肉瘤与其各自的类器官之间分子特征一致(图 2B 和 2C),32 对类器官和原发肿瘤的斯皮尔曼等级系数始终高于 0.8(中位数 = 0.87, 数值越接近1代表两者变化的相关性/一致性越高)。数据显示,通过标准化类器官培养方法,PDTOs 既保留了原始肉瘤亚型的组织学和分子特征,又表现出不同的生长动态,保留了患者个体的特异性。
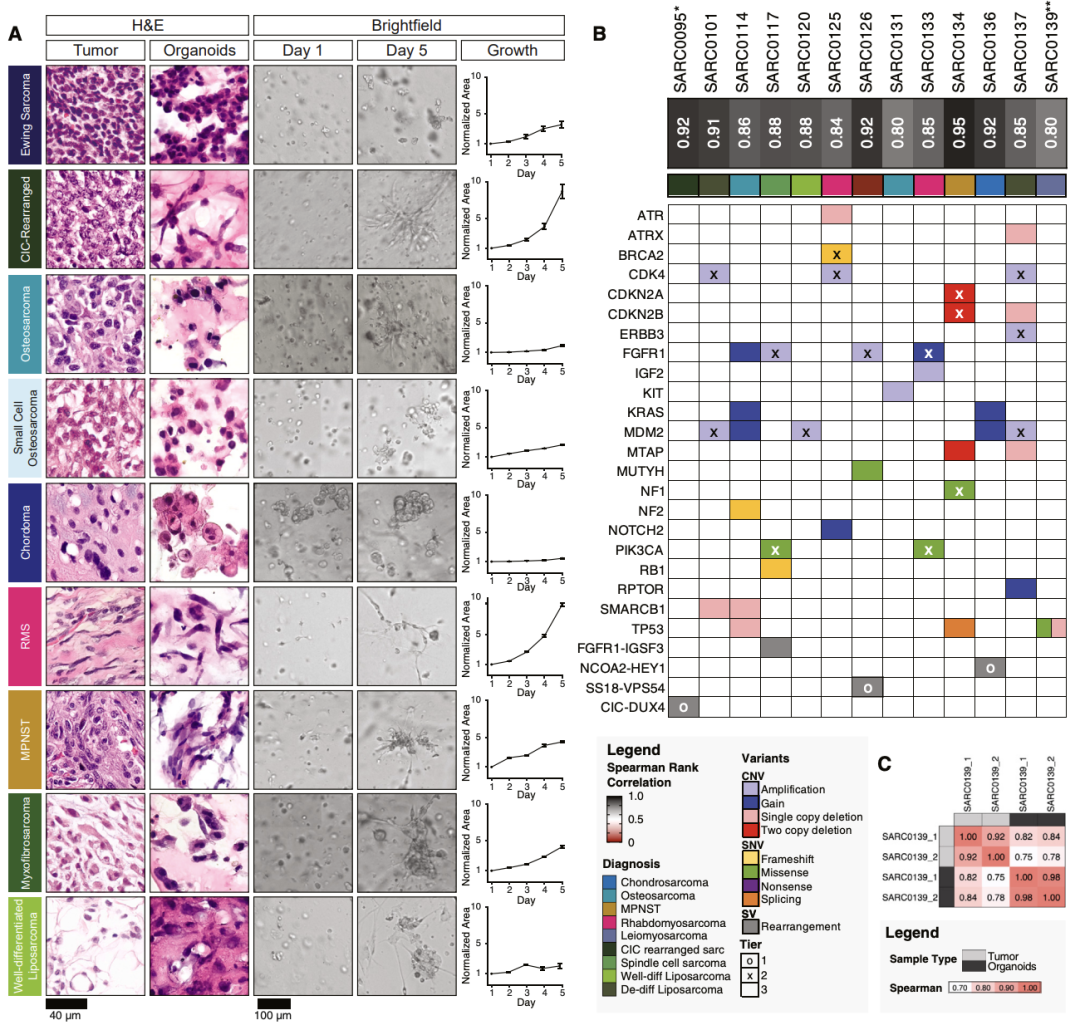
图2. 肉瘤类器官在培养中生长并重现亲本肿瘤的关键形态特征 (A) 用苏木精 - 伊红(H&E)染色的肉瘤及其相应类器官的代表性图像(第 1 列和第 2 列)。培养第 1 天(第 3 列)和第 5 天相同肉瘤细胞的代表性明场图像(第 4 列)。通过使用基于机器学习的流程对明场图像中的聚焦类器官进行分割,并将类器官覆盖的横截面积与培养第 1 天测量的面积进行归一化,从而随时间跟踪生长情况。(B) 所选肉瘤样本的基因组和转录组特征。样本名称下方的深色框是比较 RNA 测序的肿瘤和类器官样本中 RNA 转录本频率的斯皮尔曼等级相关系数。相关性排除了在任一样本中表达低于每百万 0.1 转录本的基因。下表显示了使用丹娜 - 法伯癌症研究所 OncoPanel 3.1 版对肿瘤样本进行基因组特征分析的结果。热图中的颜色表示拷贝数变异(CNV)、单核苷酸变异(SNV)和结构变异(SV)的类型。图上叠加的 “o” 或 “x” 所表示的层级代表分类尺度。层级 1 代表具有 “已确立的已发表证据” 的诊断或预后价值的改变,层级 2 改变 “可能具有临床实用性”,层级 3 改变具有 “不确定的临床实用性”。(C) 比较从患者 SARC0139 采集的两个样本的肿瘤和类器官的 RNA 转录本的斯皮尔曼等级相关系数。表达低于每百万 0.1 转录本的基因被排除在分析之外。
在药物敏感性和耐药性实验中,大多数标本(74/92,80.4%)对一种或多种测试方案至少有一次显著反应(显著反应定义为在存活率得分中排名前 5%)。3 个样本(3.3%)对四分之一或更多的测试化合物表现出这种高水平的敏感性,说明可能存在广泛且非特异性的化学敏感性。相比之下,18 个样本(19.6%)对任何药物都没有显著反应。这些样本通常是针对较小的药物库进行测试的(平均每个样本测试 54 种药物方案,而至少有一次显著反应的样本平均测试了 116 种药物方案),这表明较小规模的筛选可能还不足以确定有效的方案。
研究团队还探索了联合疗法的有效性,SARC0095 是一种CIC重排肉瘤,对吉西他滨和多西他赛表现出显著的敏感性(存活率得分:36,绿色箭头)。横纹肌肉瘤(RMS)的样本SARC0133 对长春瑞滨和莫塞替诺司他的联合用药有出色的反应(图 3A,品红色箭头),相比其他三个 RMS 样本具有更高的敏感性(图 3B)。且PDTOs的药物敏感性测试结果与患者的临床特征和治疗效果高度相关,突出了类器官在功能性精准医疗应用中的潜力。
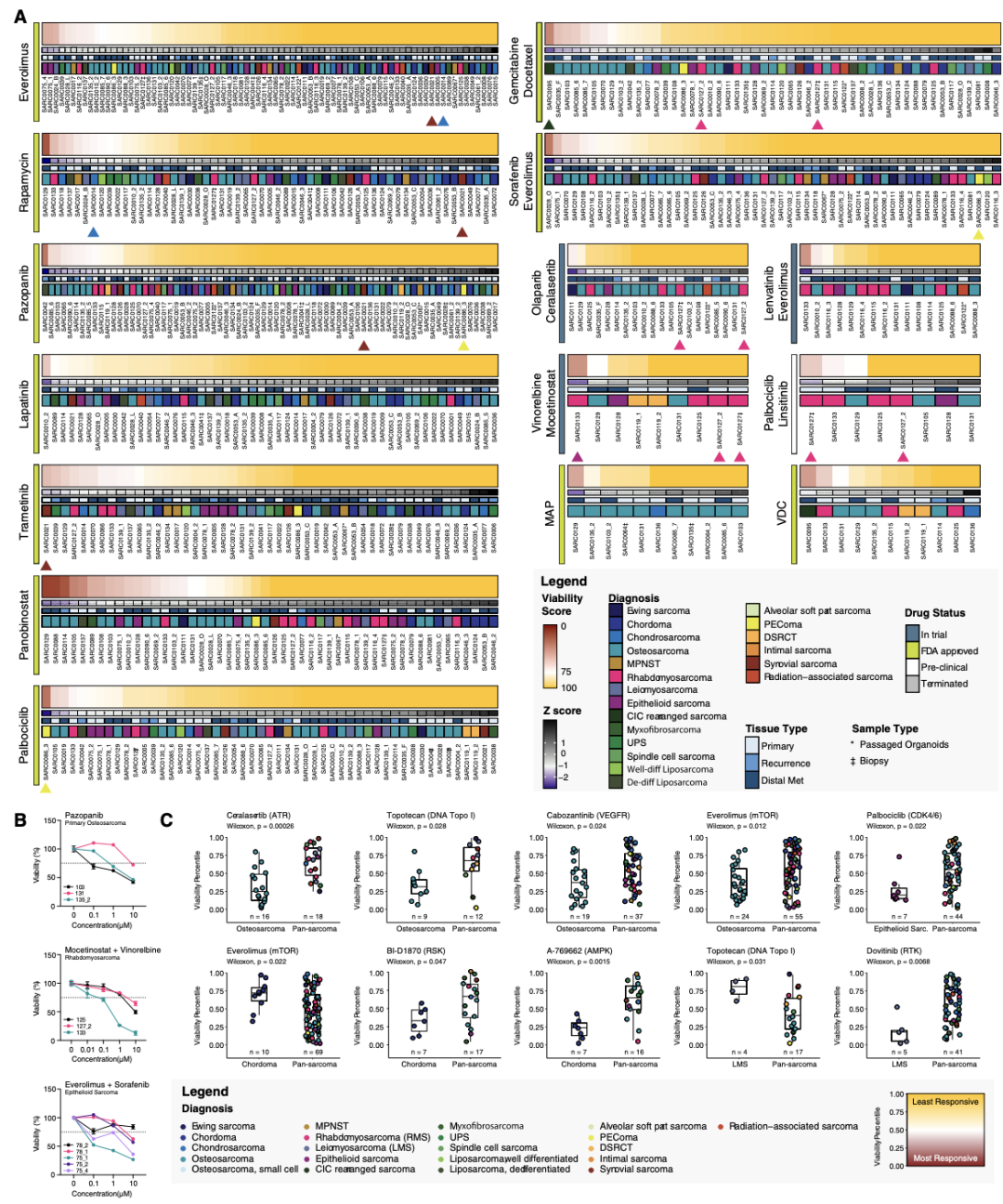
图3. 高通量药物筛选实验中,肉瘤类器官对治疗的敏感性显示出一系列反应。(A)1微米下类器官对选定药物的敏感性热图。活力评分代表每个类器官模型的活力,红色表示对治疗的敏感性高于平均水平。每个热图下方的彩色条代表 Z 分数、病变类型和每个样本的诊断。* 表示传代的样本,z 表示活检样本。具有相同 SARC 编号的样本来自同一患者。(B)选定的治疗方案下类器官活力的剂量 - 反应曲线。(C)敏感性排序图,比较来自所示诊断(左)的类器官与泛肉瘤样本(右)的反应。样本从低残留活力百分位数(响应最强的样本)到高残留活力百分位数(响应最弱的样本)进行排序。主要药物靶点在每种药物名称旁边标明。每个点的颜色代表单个样本的诊断。
此外,研究分析了药物靶向治疗的生物学途径,科学家观察到源自同一患者的样本倾向于聚集在一起。如图5,对于 SARC0103、SARC0078、SARC0075、SARC0139 和 SARC0053 来说,这种模式都成立,表明不管肿瘤类型、肿瘤位置、手术时间或对特定药物的反应如何不同,源自同一患者的肉瘤在分子途径上存在大体一致的靶向位点。

图5. 药物敏感性图谱揭示易受攻击的生物学途径。热图显示了来自 WikiPathways 的每个筛选样本对药物靶向最敏感的分子途径。药物靶向最有效的途径排名最高(红色)。不透明的方块(图中为紫色)表示在药物组合中超过 50% 的组成基因被靶向的途径。白色方块表示在筛选实验中该途径没有被任何药物靶向。
至于药物的临床应用情况,研究表示,由于患者人群少且疾病高度异质,确定的绝大多数(92%)药物治疗方案未被纳入针对骨肉瘤和软组织肉瘤的 NCCN 指南中。只有5%的这些方案被 NCCN 列为其相应组织学亚型的首选方案(例如用于骨肉瘤的依托泊苷、顺铂、索拉非尼和瑞戈非尼,用于横纹肌肉瘤的环磷酰胺,以及用于骨肉瘤和尤因肉瘤的阿霉素),另外3%的药物被推荐用于其各自的诊断(包括用于骨肉瘤的卡博替尼、吉西他滨、多西他赛和依维莫司,以及用于横纹肌肉瘤的阿霉素和长春瑞滨)。
尽管研究中的一些评估方法存在局限性,但科学家通过患者源性肿瘤类器官,在短时间内评估了肉瘤样本对多种药物的敏感性,为我们揭示了肉瘤药物敏感性及抗药性的复杂图景及关键信号通路。研究中,大多数样本都找到了至少一种有效的治疗方案,尽管有些尚未被纳入NCCN 指南,但随着类器官的潜力被验证,相信不久就可能会有肉瘤治疗的新方案进入临床,患者也能得到更加精准的治疗。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#肿瘤新前沿#不错,以后肉瘤也可以靶向
13
#肉瘤# #药物敏感性# #患者源性肿瘤类器官#
29