中山大学肿瘤防治中心田麟团队《自然·通讯》:组织驻留巨噬细胞在肝转移瘤中的可塑性研究
2024-11-03 BioMed科技 BioMed科技 发表于上海
本研究利用巨噬细胞谱系追踪模型,揭示肝转移瘤中巨噬细胞来源及生态位调控,提出抑制策略提高免疫治疗效果,为肿瘤治疗提供新思路。
肝转移瘤是乳腺癌和肠癌等肿瘤的常见转移部位1。肝转移微环境中存在大量免疫抑制细胞,导致对免疫治疗的响应较低,患者预后不良2。既往研究表明,肝转移瘤中的巨噬细胞能够抑制T细胞功能3,但关于肝转移瘤中巨噬细胞的来源及其生态位的动态调控尚不明确。在本研究中,田麟团队利用多种巨噬细胞谱系追踪模型,证明了单核细胞是转移瘤巨噬细胞的主要来源。然而,在单核细胞受到抑制的情况下,肝脏驻留的库佛氏细胞能够浸润转移瘤,以填补因单核细胞缺失而产生的生态位空缺。在这一过程中,库佛氏细胞通过表观重编程发生了表型和功能的改变,其形态和转录组与单核来源的巨噬细胞相似,发挥了免疫抑制的作用。作者指出,同时抑制单核细胞浸润和巨噬细胞增殖可以有效减少转移瘤中的巨噬细胞,改善免疫微环境,提高免疫检查点疗法的效果。
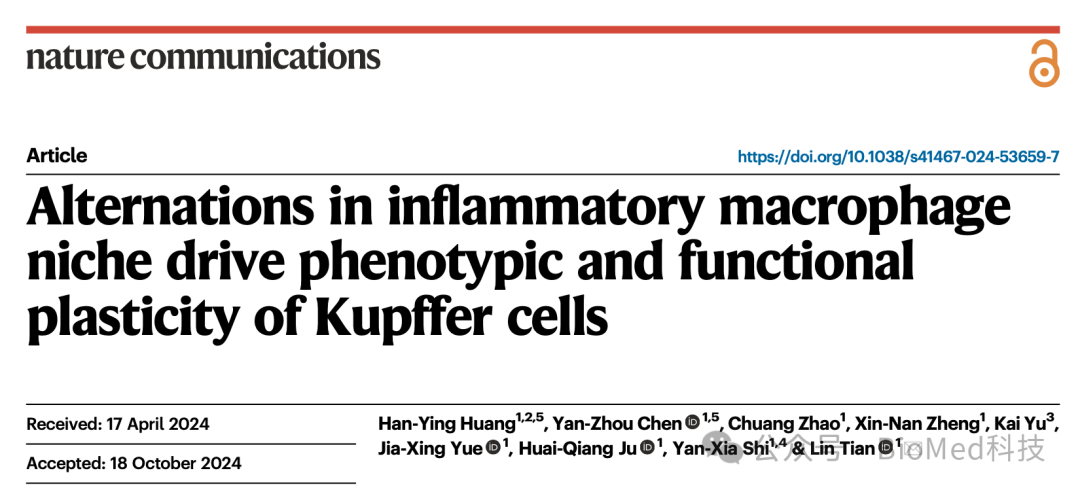
本研究中,研究人员首先利用传统的多色流式细胞分析,发现小鼠肝转移瘤中的F4/80+巨噬细胞高表达CD11b,而正常肝脏的F4/80+巨噬细胞则为低表达CD11b的组织驻留巨噬细胞。进一步,作者采用CITE-seq技术在单细胞层面分析细胞的转录组和100多个细胞表面蛋白表达,这一方法无偏倚地揭示了正常肝脏和转移瘤巨噬细胞的差异。受到上述流式和测序实验的启发,作者构建了双色荧光蛋白报告基因小鼠模型,其中红色荧光蛋白指示库佛氏细胞,绿色荧光蛋白则标记所有巨噬细胞。作者发现,正常肝脏的巨噬细胞同时表达红色和绿色荧光蛋白,而转移瘤巨噬细胞仅表达绿色荧光蛋白。这些实验表明正常肝脏和转移瘤中巨噬细胞的表型存在显著差异。
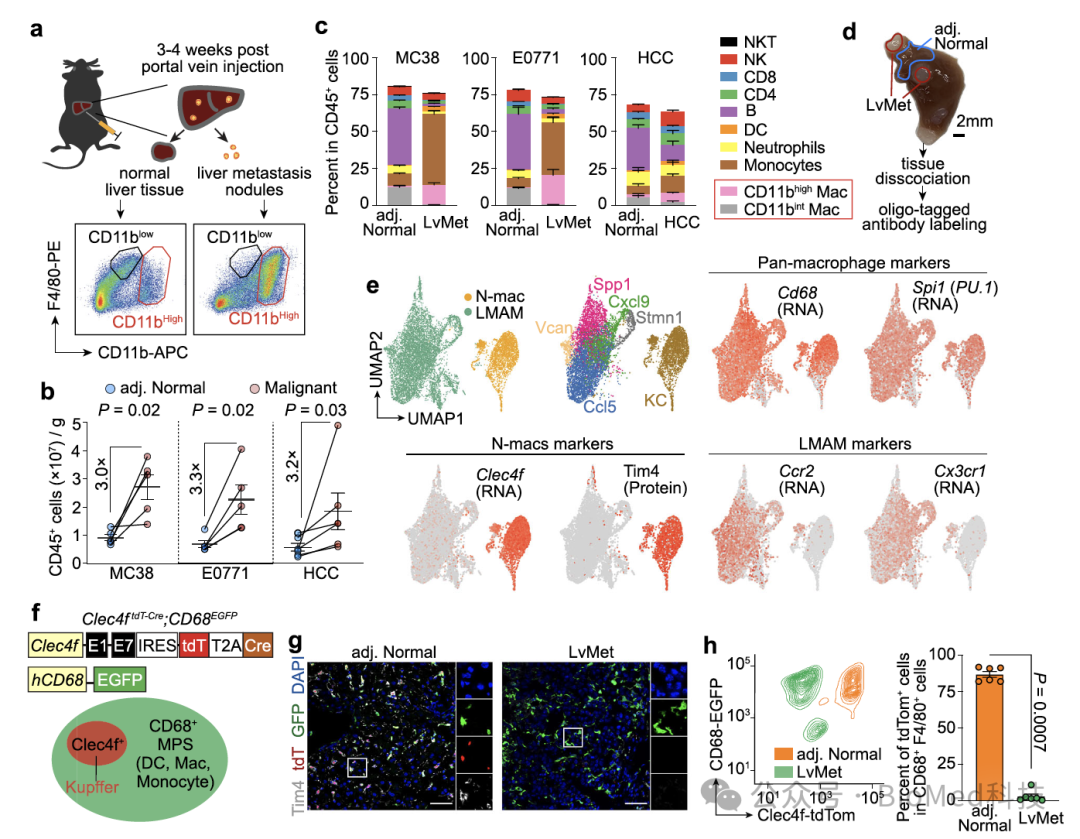
图1. 正常肝脏和肝转移瘤巨噬细胞的差异
(图源:Huang et al., Nature Communications, 2024)
对于巨噬细胞的差异,作者提出了两种可能性:1)巨噬细胞的来源不同导致表型差异;2)同一来源的巨噬细胞在转移瘤中发生表型转变。为了验证这两种可能性,作者利用了库佛氏细胞的谱系追踪模型(Clec4f-Cre以及Tnfrsf11a-Cre)和单核细胞的谱系追踪模型(Cx3cr1-CreERT2),并结合小鼠共生体实验,表明肝转移瘤巨噬细胞主要来源于血液中的单核细胞,而库佛氏细胞几乎不能浸润肝转移瘤。
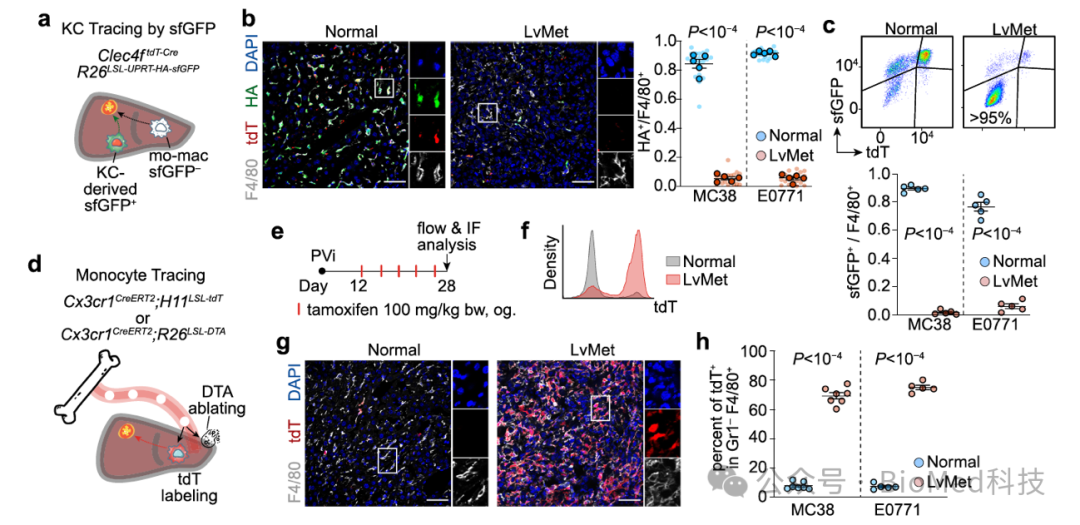
图2. 库佛氏细胞和单核细胞的荧光示踪
(图源:Huang et al., Nature Communications, 2024)
然而有趣的是,如果将荧光示踪的荧光蛋白替换为毒性蛋白以去除单核细胞来源的巨噬细胞,肝转移瘤中仍然存在大量的巨噬细胞。为进一步验证这一观察,作者使用了Ccr2敲除小鼠。在这种小鼠中,由于缺乏炎症因子受体Ccr2,单核细胞无法感知炎症信号并到达炎症部位。确实在Ccr2敲除小鼠中,作者观察到单核细胞的数量减少了十倍,但转移瘤中的巨噬细胞数量并显著没有减少。
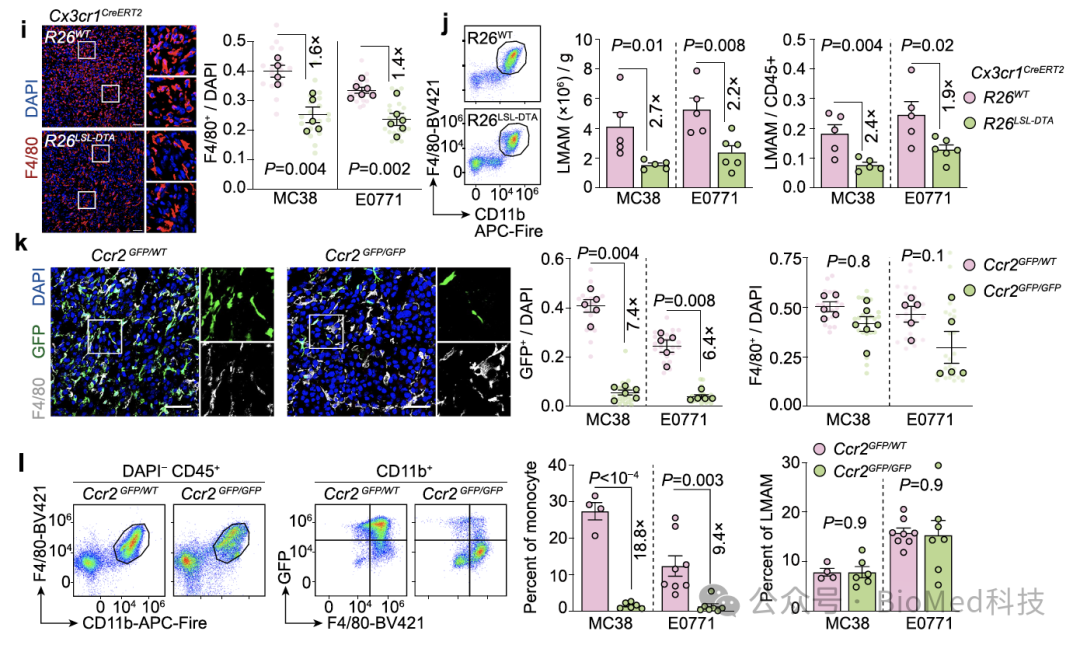
图3. 单核细胞的遗传去除
(图源:Huang et al., Nature Communications, 2024)
这就提出了一个问题:在切断肝转移瘤巨噬细胞的主要来源——单核细胞之后,为什么仍然存在大量肝转移瘤巨噬细胞。为此,作者提出了两种可能的巨噬细胞补偿机制:1)转移瘤内的巨噬细胞增殖增加;2)原本无法浸润转移瘤的库佛氏细胞浸润转移瘤,以填补单核细胞缺失后腾出来的生态位。为了验证第一个假设,作者借鉴了之前报道过的细胞增殖记录系统4,发现转移瘤中的巨噬细胞在没有“外部”来源单核细胞补充的情况下,增殖能力增强。这一结论与之前报道的瘤内巨噬细胞增殖现象一致5。
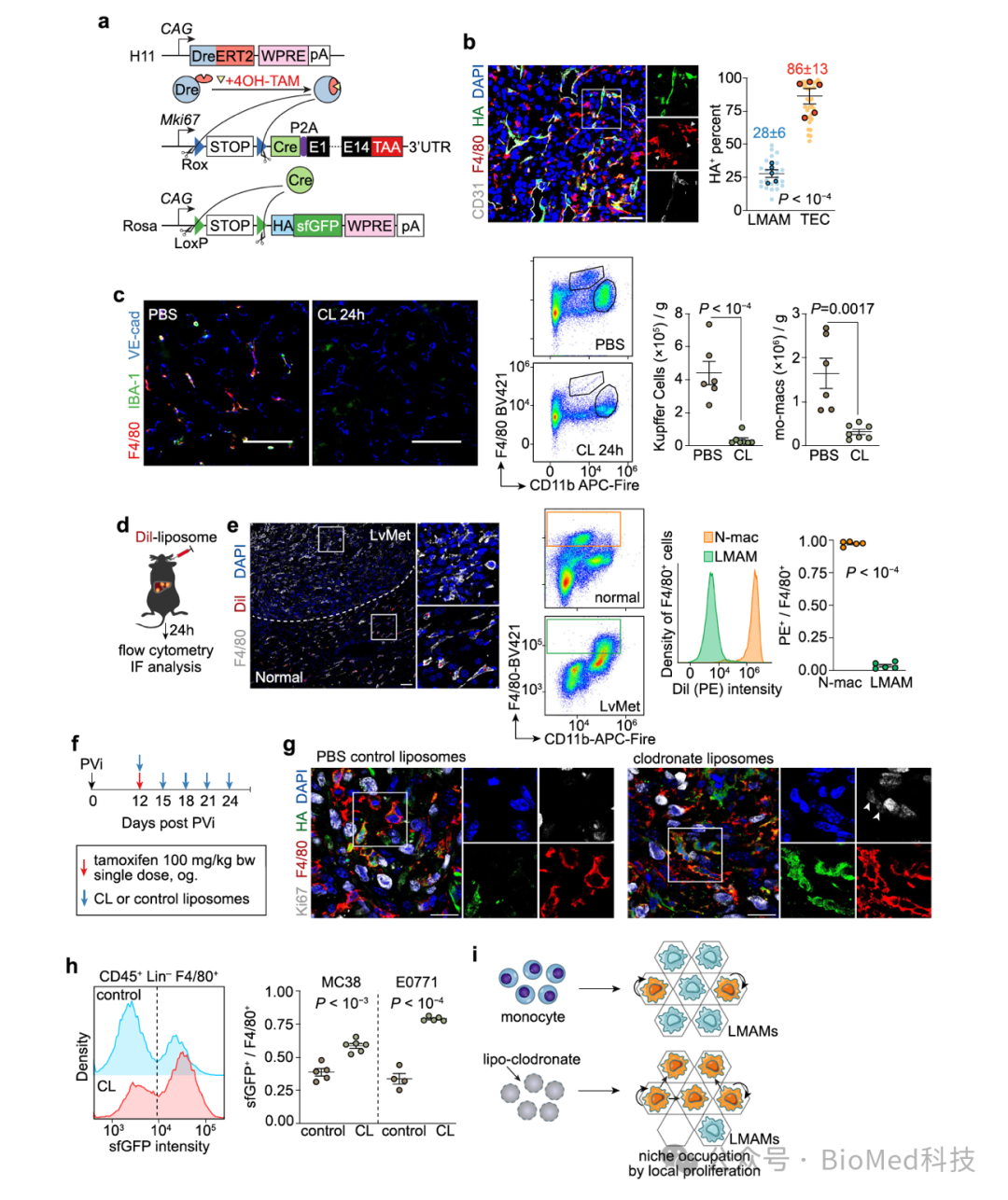
图4. 细胞增殖记录系统
(图源:Huang et al., Nature Communications, 2024)
对于库佛氏细胞能否在单核细胞缺失的情况下填补其生态位,作者将库佛氏细胞的追踪模型与单核细胞缺失模型结合(Clec4f-Cre;LSL-sfGFP;CCR2 KO)。利用这一模型,作者发现,在CCR2敲除背景下,转移瘤巨噬细胞尽管不表达库佛氏细胞的标志,但却来源于库佛氏细胞。为了研究这一可塑性过程,作者在单细胞测序中将WPRE元件作为DNA标签,以对库佛氏来源的细胞进行追踪。结合拟时态分析,作者发现正常肝脏的库佛氏细胞经历一个增殖状态,在肿瘤中表现为Spp1+ Trem2+的免疫抑制表型。有趣的是,在获得这些单核细胞来源的巨噬细胞样表型的同时,浸润转移瘤的库佛氏细胞也丢失了库佛氏细胞特征的基因(如Clec4f, Timd4, Id3等)。
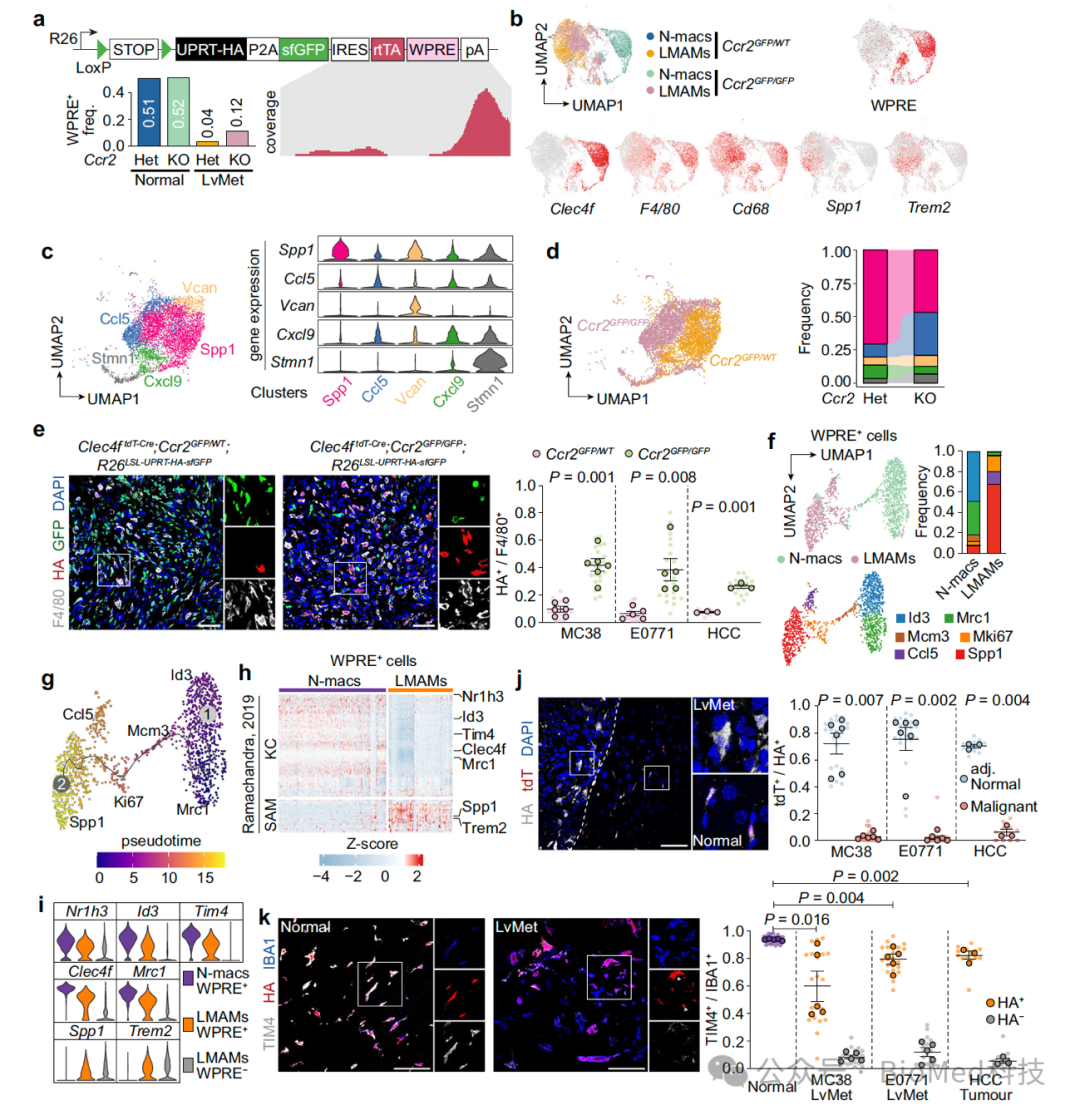
图5. 单核细胞抑制背景下的库佛氏细胞谱系追踪
(图源:Huang et al., Nature Communications, 2024)
为了研究表型变化的分子机制,作者利用表观遗传分析发现,在库佛氏细胞浸润肿瘤的过程中,其标志基因的启动子/增强子区域转录抑制组蛋白修饰(H3K27me3)增加。这一发现解释了库佛氏细胞标志基因如Clec4f和Timd4的表达下调。此外,免疫抑制基因的启动子/增强子区域转录激活组蛋白修饰(H3K27ac)也有所增加。值得一提的是,即使在正常肝脏的库佛氏细胞中,这些免疫抑制基因的染色质区域仍然是开放的,处于“准备”的状态。一旦受到环境因子的激活,这些基因能够快速表达,这也解释了巨噬细胞具有很大的可塑性。
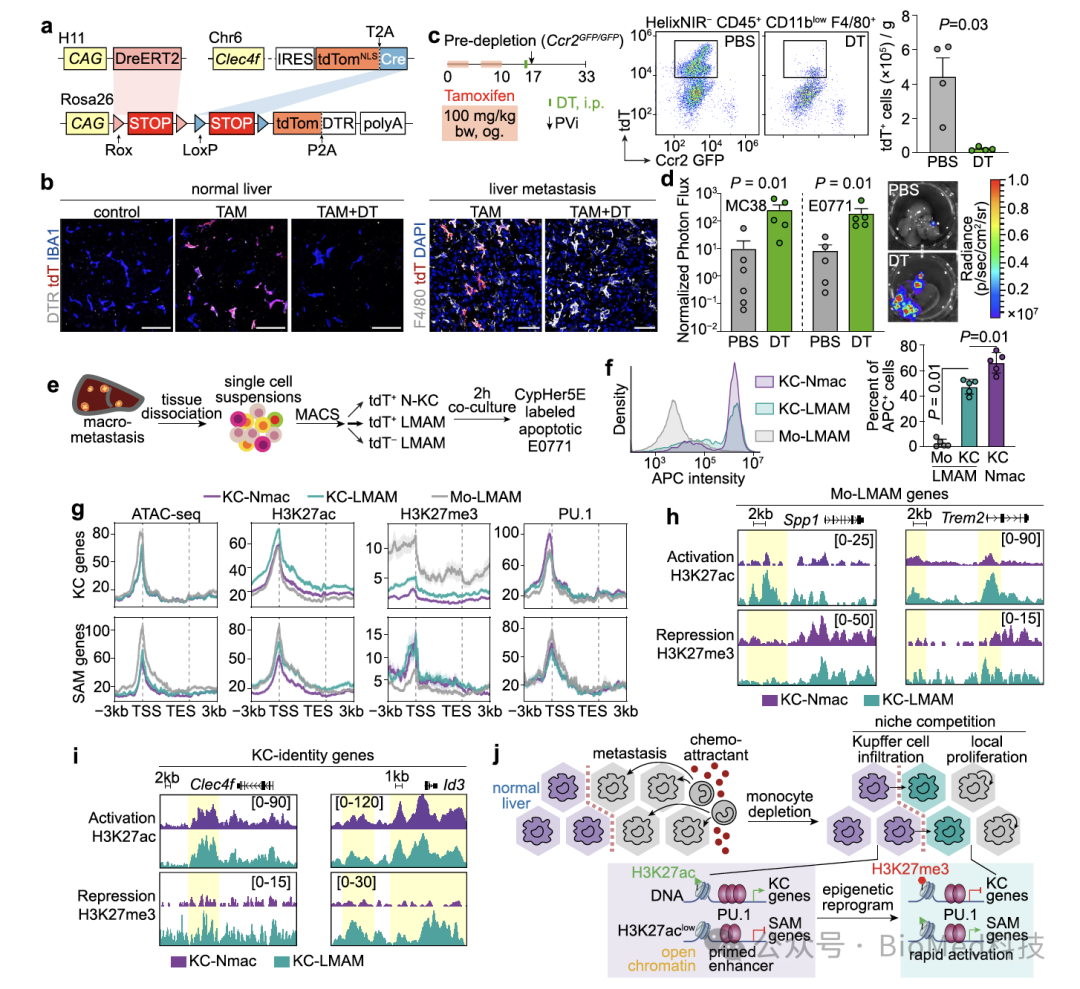
图6. 不同来源、组织巨噬细胞的表观遗传分析
(图源:Huang et al., Nature Communications, 2024)
如之前提到的,库佛氏细胞浸润转移瘤的过程中发生了细胞增殖。因此,作者提出,是否可以通过抑制Ccr2来限制单核细胞的招募,同时靶向Csfr1来限制巨噬细胞的增殖,从而更有效地抑制肝转移瘤中的巨噬细胞。确实,与仅单独抑制Ccr2或Csfr1的小鼠相比,采用联合用药的小鼠肝转移瘤中巨噬细胞的数量显著降低。此外,鉴于肝转移瘤中的CD8+ T细胞主要表达免疫检查点Pd1,作者发现,在同时抑制Ccr2和Csf1r的情况下,抗Pd1的响应和疗效显著提升。
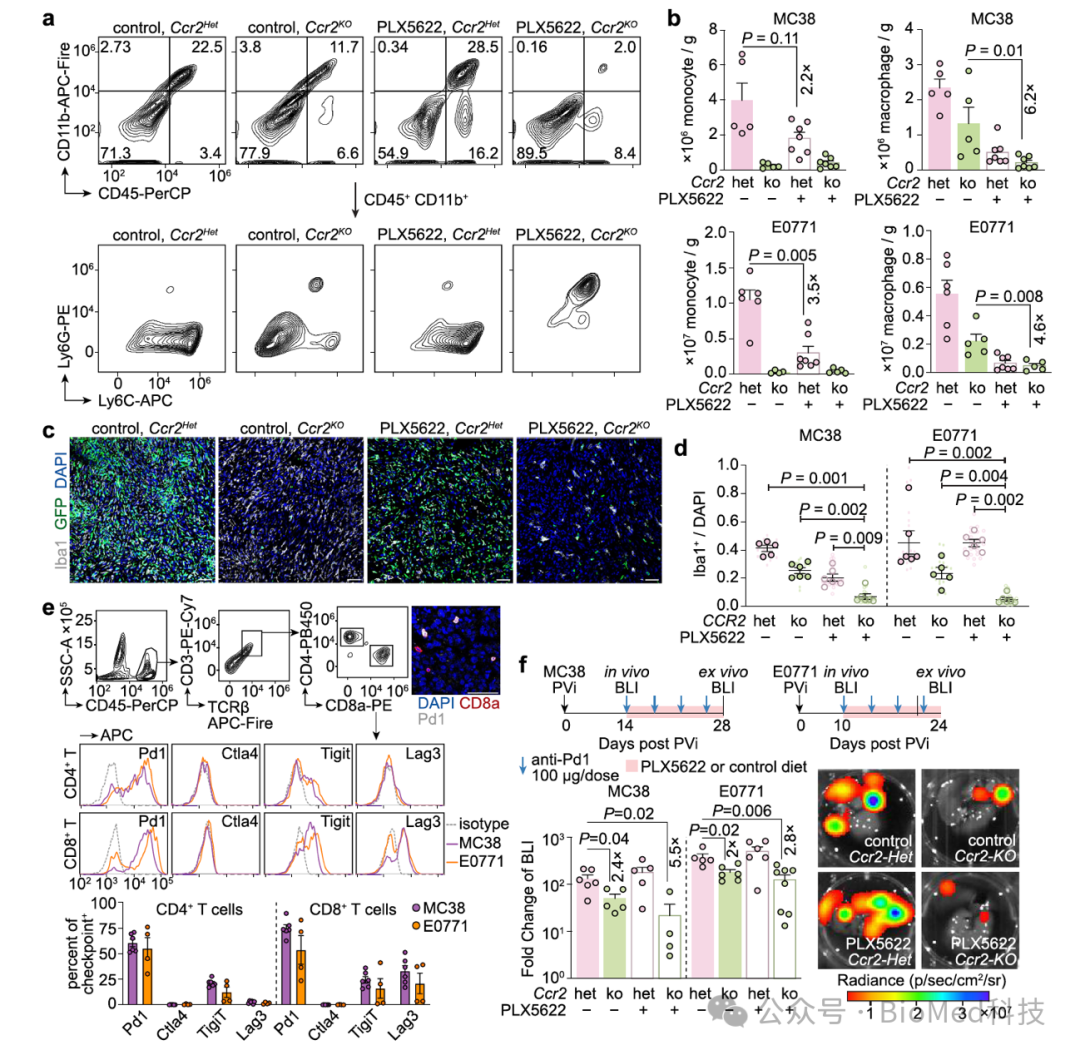
图7. 联合抑制Ccr2和Csf1r促进抗Pd1的免疫治疗疗效
(图源:Huang et al., Nature Communications, 2024)
综上所述,研究人员通过精准的谱系追踪模型,阐明了转移瘤巨噬细胞的异质性与可塑性,为更好地抑制肿瘤巨噬细胞提供了新的思路与策略。值得强调的是,组织来源的巨噬细胞在肿瘤中是否发挥作用一直存在争议6。本研究表明,胚胎来源的肝脏驻留巨噬细胞可以在炎症生态位可及的情况下浸润转移瘤,并通过表观重编程改变其功能。在其他癌变组织中,组织驻留巨噬细胞是否也存在类似情况?逆转这一表型/功能转变是否可以辅助肿瘤治疗?这些问题有待后续研究的进一步探索。
中山大学肿瘤防治中心田麟副研究员为该论文的通讯作者,博士后黄涵英、研究生陈彦州为该论文的共同第一作者。本研究受到国家自然科学基金、广州市科技计划项目和中山大学肿瘤防治中心人才提升计划等项目资助。田麟课题组(https://www.tianlab.info/)2025年有一个硕士生招收指标,欢迎对肿瘤免疫微环境以及细胞可塑性感兴趣的同学报考。
参考文献
1 Tsilimigras, D. I. et al. Liver metastases. Nat Rev Dis Primers 7, 27 (2021). https://doi.org:10.1038/s41572-021-00261-6
2 Brodt, P. Role of the Microenvironment in Liver Metastasis: From Pre- to Prometastatic Niches. Clin Cancer Res 22, 5971-5982 (2016). https://doi.org:10.1158/1078-0432.Ccr-16-0460
3 Yu, J. et al. Liver metastasis restrains immunotherapy efficacy via macrophage-mediated T cell elimination. Nat Med 27, 152-164 (2021). https://doi.org:10.1038/s41591-020-1131-x
4 He, L. et al. Proliferation tracing reveals regional hepatocyte generation in liver homeostasis and repair. Science 371 (2021). https://doi.org:10.1126/science.abc4346
5 Wang, J. et al. Tumor-derived adenosine promotes macrophage proliferation in human hepatocellular carcinoma. J Hepatol 74, 627-637 (2021). https://doi.org:10.1016/j.jhep.2020.10.021
6 Guilliams, M. & Svedberg, F. R. Does tissue imprinting restrict macrophage plasticity? Nat Immunol 22, 118-127 (2021). https://doi.org:10.1038/s41590-020-00849-2
原文链接:
https://www.nature.com/articles/s41467-024-53659-7
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















肝转移瘤巨噬细胞主要来源于血液中的单核细胞!
16
#巨噬细胞# #肝转移瘤#
33