究员最新研究发表于ERJ:嗜酸细胞通过14-HDHA和17-HDHA肺血管重构
2022-11-28 肺动脉高压研究进展 肺动脉高压研究进展 发表于安徽省
发现EOS在PH发展过程中从外周血迁移到肺组织,而成纤维细胞衍生的CCL11可能负责EOS的肺部招募。此外,EOS缺乏会加重PH值,增加中性粒细胞和单核细胞/巨噬细胞的浸润,并促进PASMC增殖。
研究方法和结果 研究方法:通过研究肺动脉高压(PAH)患者和sugen/缺氧诱导的PH小鼠的外周血和肺组织中EOS的浸润和趋化。应用GATA1缺失(ΔdblGATA)小鼠、抗IL5抗体处理的小鼠和大鼠来研究EOS缺失在PH发展中的作用。进行了超高效液相色谱-质谱/质谱分析,以确定EOS产生的关键性牛脂素分子。收集EOS的培养上清液和裂解液,在共培养细胞实验中探索其机制。 研究结果:EOS在外周血中的比例较低,而在PAH患者和PH小鼠的肺部组织中的浸润较高。PAH/PH肺部显示出与EOS相关的趋化因子表达增加,来自肺泡内膜成纤维细胞的CCL11可能介导了EOS迁移到肺部。 图1. PAH患者的肺部嗜酸细胞(EOS)积聚增加。PAH患者血液中的EOS种群减少,而肺部浸润增加。 EOS的缺乏加剧了sugen/缺氧引起的小鼠和大鼠的PH和肺血管肌肉化,同时伴随着中性粒细胞和单核细胞/巨噬细胞浸润的增加。 图2. PH小鼠的肺部嗜酸细胞(EOS)积累增加。PH小鼠血液中EOS的比例减少,肺部EOS的比例增加。 此外,EOS能阻止PDGFbb诱导的肺动脉平滑肌细胞(PASMC)在体外的增殖和迁移。EOS高度表达花生四烯酸15-脂氧化酶(ALOX15),EOS的缺乏在很大程度上抑制了ALOX15在肺部的表达。 由于以前的研究表明,EOS参与调节免疫平衡过程,如Th2极化、肥大细胞浸润和B细胞免疫球蛋白的产生,我们研究了EOS缺乏如何影响小鼠PH期间的不同免疫细胞群。研究结果发现 在揭示了EOS在PH小鼠中具有抗炎和抗增殖的作用后,研究接下来试图确定其基础的研究机制。一个潜在的机制是EOS的脱颗粒;然而,研究排除了这种可能性,因为它很少发生在小鼠身上。另一个机制是EETs的形成;然而,在PH小鼠的肺部没有明显的EETs形成。因此,研究推测EOS释放的脂质介质可能在发挥保护作用方面发挥了关键作用。EOS含有多不饱和脂肪酸氧化酶,使其成为脂质代谢的主要场所。 UHPLC-MS/MS显示14-羟基二十二碳六烯酸(14-HDHA)和17-HDHA是EOS产生的下游氧化脂类物质。为了进一步验证氧化脂质的功能,研究选择了14-HDHA、17-HDHA、15-HEPE和12-HETE进行体外PASMC增殖试验。我们发现14-HDHA、17-HDHA和15-HEPE在10nM和20nM的浓度下抑制了PDGFbb诱导的PASMCs增殖;这些效果与EOS裂解液和EOS上清液的效果一致。 14-HDHA和17-HDHA的抗炎作用已被广泛报道。我们进一步研究了14/17-HDHA的抗增殖作用的机制。如前所述,12/15-脂氧合酶代谢物通过激活PPARγ调节脂质代谢,而PPARγ被认为是PAH过程中TGFβ信号传导和BMP2信号传导途径之间的主要环节 发展过程中,被认为是TGFβ信号和BMP2信号通路的主要环节。一旦被激活,PPARγ就会转入细胞核并调控下游基因的表达。 研究结论 在没有外部炎症刺激的PH发展中,外周血表现出较低的EOS水平,其中EOS通过抑制血管周围炎症和通过14/17-HDHA维持PASMC的平衡而发挥保护作用。 研究临床意义 在这项研究中,发现EOS在PH发展过程中从外周血迁移到肺组织,而成纤维细胞衍生的CCL11可能负责EOS的肺部招募。此外,EOS缺乏会加重PH值,增加中性粒细胞和单核细胞/巨噬细胞的浸润,并促进PASMC增殖。研究进一步证明,EOS通过12/15-lipoxygenease代谢产物发挥作用,下游的14/17-HDHA通过SPM受体FPR2介导免疫细胞的抗炎作用,同时通过PPARγ的激活抑制PASMC的增殖(图8G)。 肺动脉高压(PAH)是一种严重威胁生命的疾病,以肺血管重塑和血管周围炎症细胞浸润为特征。多年来,PAH中Th2免疫反应的增强已被报道。然而,作为Th2效应细胞之一的嗜酸性粒细胞(EOS)在PAH中的作用却鲜有报道。以前的一项研究表明,PAH患者的综合症更严重循环中的EOS水平较低;然而,EOS在调节PAH发展中的功能和详细机制仍不清楚。
肺动脉高压(PAH)是一种严重威胁生命的疾病,以肺血管重塑和血管周围炎症细胞浸润为特征。多年来,PAH中Th2免疫反应的增强已被报道。然而,作为Th2效应细胞之一的嗜酸性粒细胞(EOS)在PAH中的作用却鲜有报道。以前的一项研究表明,PAH患者的综合症更严重循环中的EOS水平较低;然而,EOS在调节PAH发展中的功能和详细机制仍不清楚。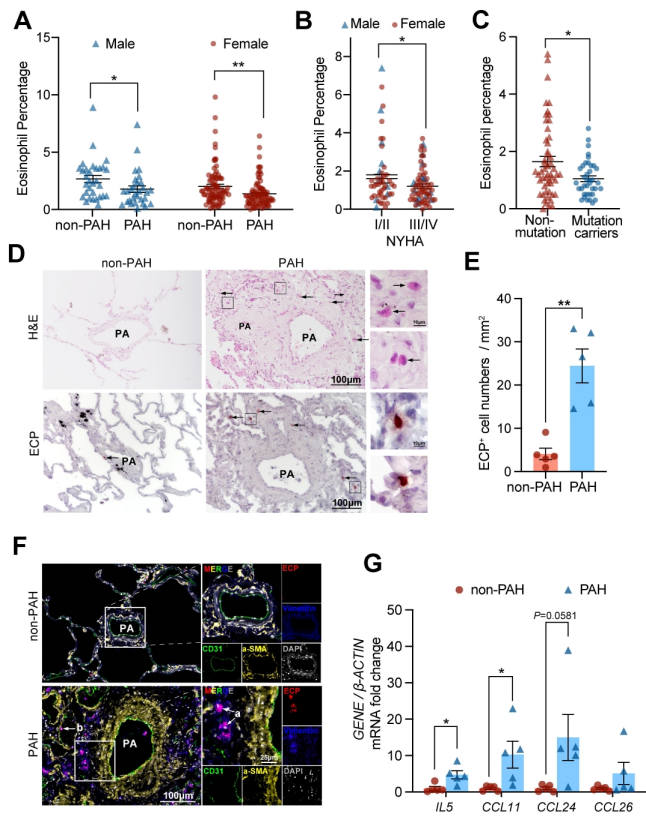
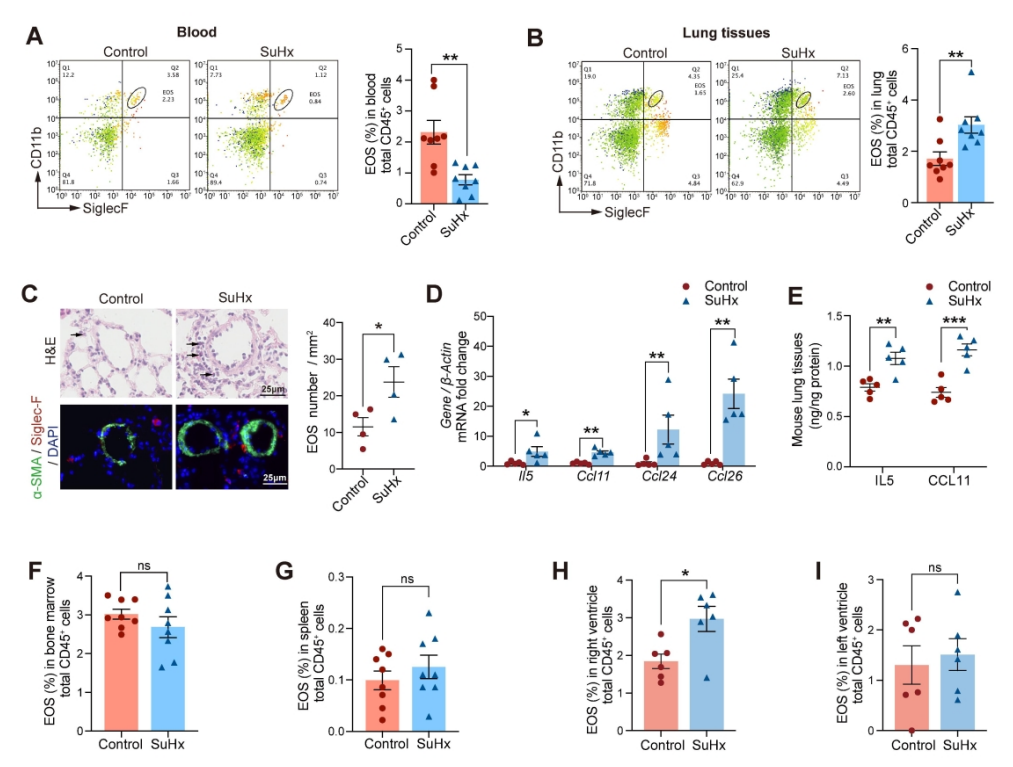
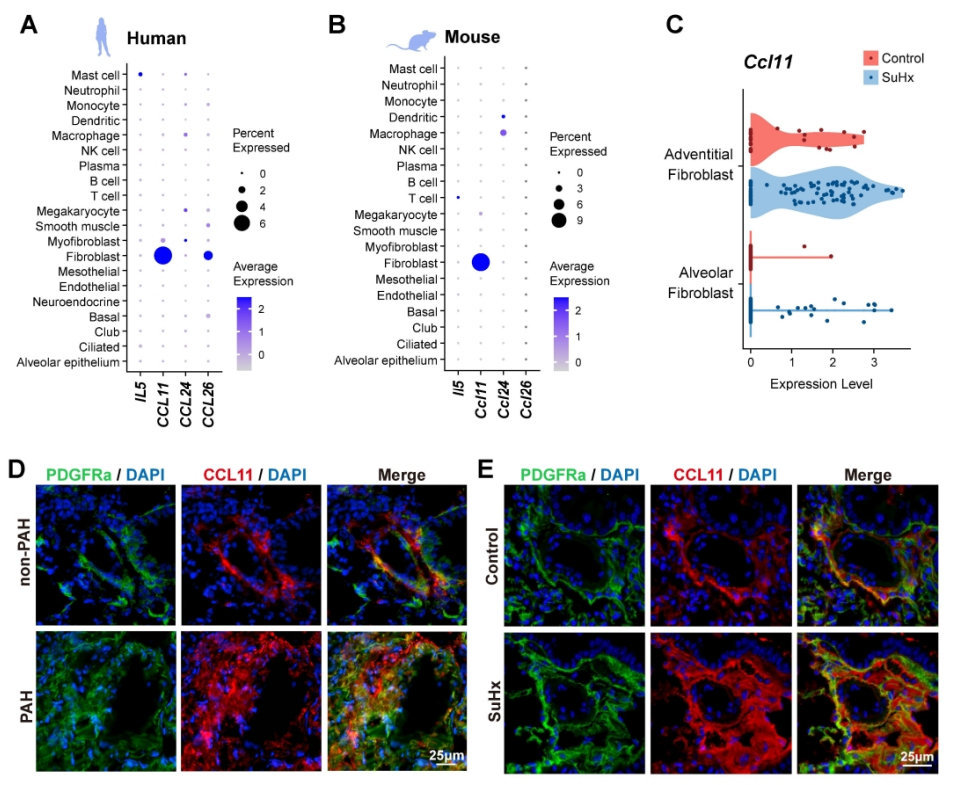
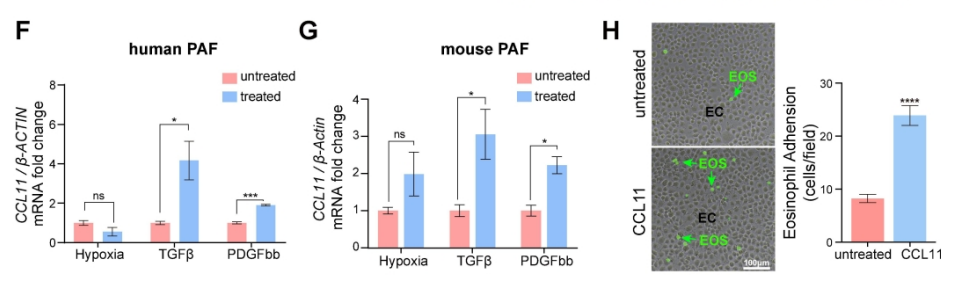 图3. CCL11在肺间质成纤维细胞中的表达。PH肺内膜成纤维细胞的CCL11上调与EOS招募有关。
图3. CCL11在肺间质成纤维细胞中的表达。PH肺内膜成纤维细胞的CCL11上调与EOS招募有关。
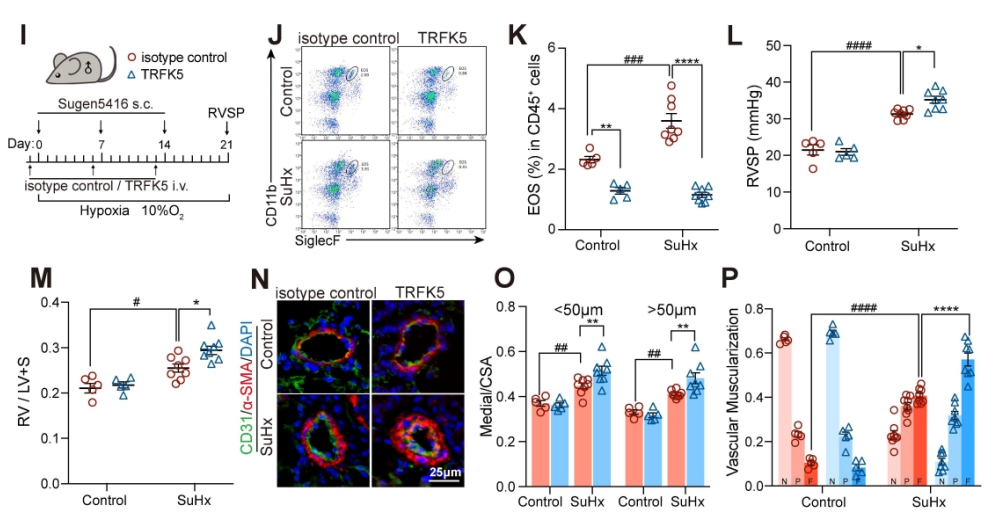 图4. EOS的确实加重了小鼠PH的进展。
图4. EOS的确实加重了小鼠PH的进展。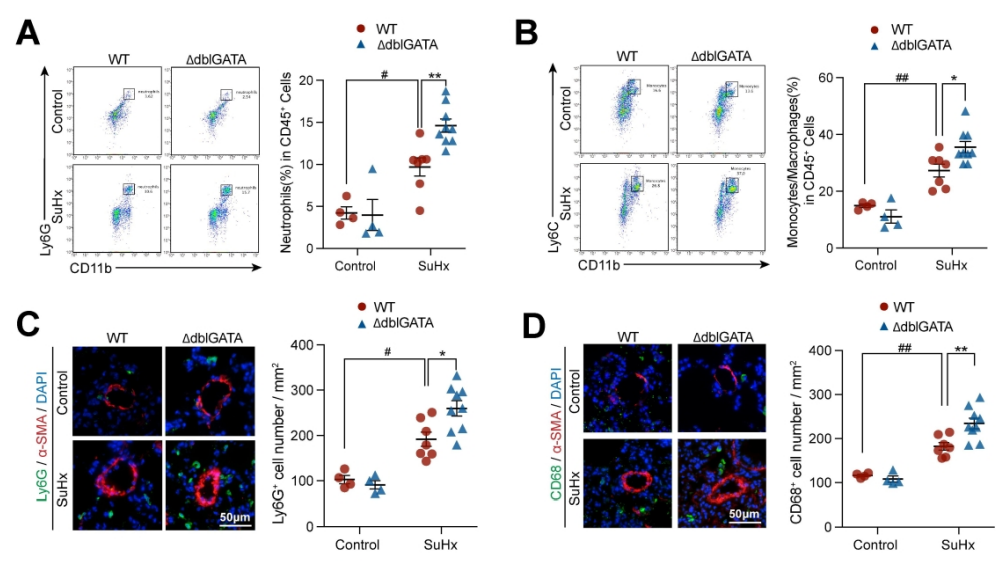
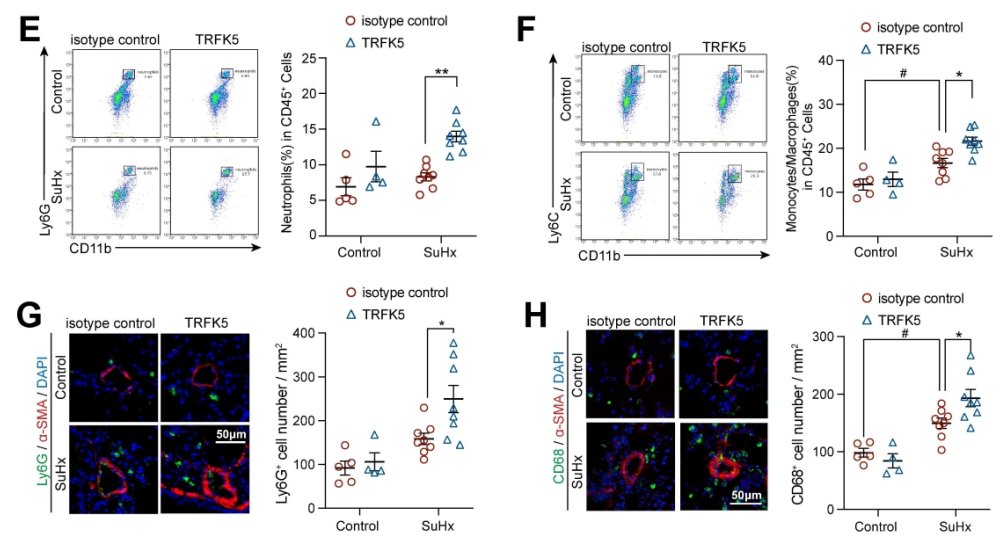 图5. EOS的缺乏或耗竭促进了中性粒细胞和单核细胞/巨噬细胞在肺部的积累。
图5. EOS的缺乏或耗竭促进了中性粒细胞和单核细胞/巨噬细胞在肺部的积累。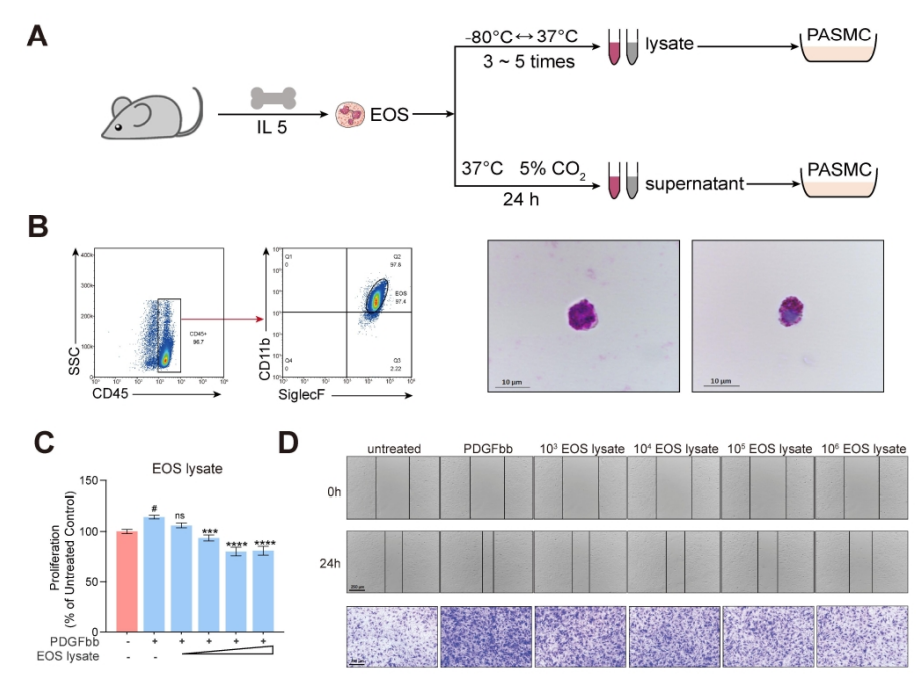
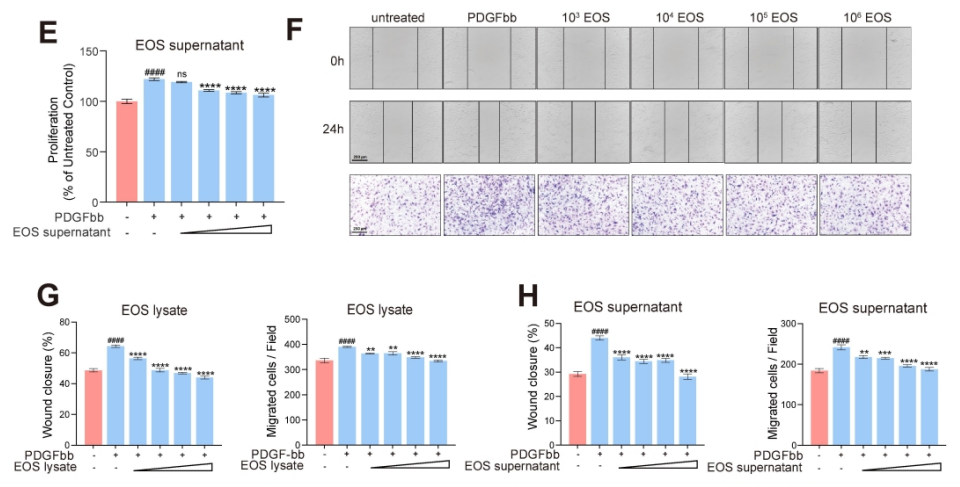 图6. EOS降低了PDGFbb诱导的平滑肌细胞的增殖和迁移。
图6. EOS降低了PDGFbb诱导的平滑肌细胞的增殖和迁移。
 图7. ∆dblGATA小鼠肺部的12/15-脂氧合酶衍生物的缺失。
图7. ∆dblGATA小鼠肺部的12/15-脂氧合酶衍生物的缺失。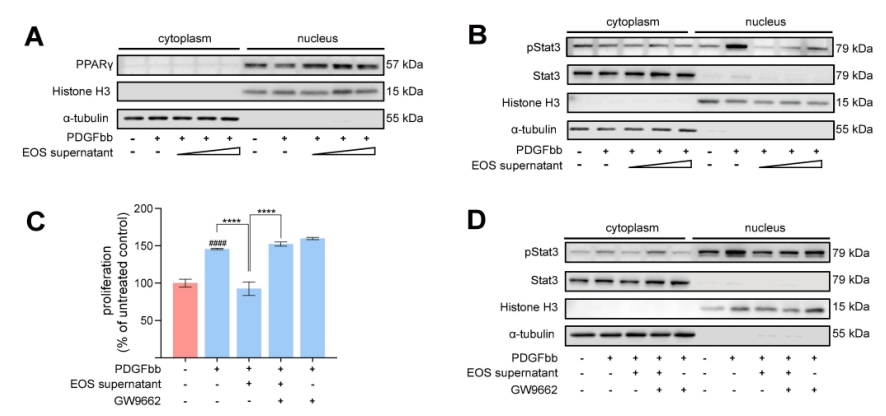
 图8. EOS衍生的14/17-HDHA通过激活PPARγ抑制PASMC的增殖。14/17-HDHA通过甲酰肽受体2对中性粒细胞和单核细胞/巨噬细胞的招募显示出抗炎作用,它们通过激活过氧化物酶体增殖剂激活受体γ和阻断PASMCs中Stat3的磷酸化而抑制增殖。
图8. EOS衍生的14/17-HDHA通过激活PPARγ抑制PASMC的增殖。14/17-HDHA通过甲酰肽受体2对中性粒细胞和单核细胞/巨噬细胞的招募显示出抗炎作用,它们通过激活过氧化物酶体增殖剂激活受体γ和阻断PASMCs中Stat3的磷酸化而抑制增殖。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言