【论肿道麻】Lancet Neurology:非心脏手术患者围手术期卒中的预防
2024-10-31 古麻今醉网 古麻今醉网 发表于上海
作者着重阐述了非心脏手术中围手术期脑卒中及隐匿性卒中的流行病学、风险因素和潜在机制的最新证据,回顾了预防这些并发症的围手术期循证策略,并讨论了未来的研究方向。
每年约有3亿成年人接受非心脏手术。尽管总体围手术期卒中的发病率很低,但卒中患者的绝对数量却相当可观。大多数患有这种并发症的患者面临死亡或严重残疾。隐性卒中比显性卒中更常见,并且与术后谵妄、认知能力下降和术后1年内脑血管事件有关。证据表明,包括高龄、高血压和心房颤动在内的传统卒中风险因素也与围手术期卒中有关,既往卒中是围手术期卒中的最大风险因素。越来越多的证据还表明围手术期事件,如低血压、新发心房颤动、反常栓塞和出血等的致病作用。2023年10月《Lancet Neurology》杂志(IF:46.5)上发布了一篇名为《Prevention of perioperative stroke in patients undergoing non-cardiac surgery》的综述,作者着重阐述了非心脏手术中围手术期脑卒中及隐匿性卒中的流行病学、风险因素和潜在机制的最新证据,回顾了预防这些并发症的围手术期循证策略,并讨论了未来的研究方向。参与围手术期管理的临床医生应了解这些关于预防策略的证据,以改善非心脏手术后患者的预后。
发病率和临床相关性
美国大型数据库分析表明,2004年至2013年间,围手术期缺血性卒中的发病率在所有年龄组中都有所增加。少数发生在术中,高达30%发生在术后第2天,约50%发生在术后第5天,20~25%发生在初次住院的术后30天内。
在非心脏手术环境中,显性卒中的发生率为0.03%~4%。与接受其他类型的非心脏手术的患者相比,接受血管手术(0.9%)或神经外科手术(1.5%)的患者发生率更高。此外,围手术期缺血性卒中比出血性更常见。
与非手术环境中发生的卒中相比,在非心脏手术围术期内发生的卒中更多是致命的或导致严重缺陷的。超过20%的围手术期急性中风患者会在术后30天内死亡。超过50%的围手术期卒中幸存者将患有严重残疾。此外,与社区性卒中相比,围手术期卒中表现出:更严重;来自大血管或心源性栓塞,累及前循环;神经影像学和治疗的时间更长;静脉溶栓率(由于禁忌症/超出治疗时间窗口)和卒中病房入院率较低。
隐性卒中在非手术环境中比显性卒中更常见,并且与认知能力下降和功能性精神运动并发症有关,后续发生显性卒中风险增加。研究通过围手术期神经影像学表明围手术期隐性卒中比围手术期显性卒中更常见,在接受颈动脉支架置入术的患者中发病率高达40%,在非血管外科患者中发病率为10%。
一项名为NeuroVISION国际队列研究对9个国家共1114人(≥65岁)进行了选择性非心脏手术。通过术后第2天和第9天之间的MRI检测到在所有类型的非心脏手术中围手术期隐性卒中发生总发病率为7%。这一发病率明显高于非手术环境。在非手术环境中,人群研究报告称在脑部MRI中急性或亚急性隐匿性卒中的发生率小于1%。
NeuroVISION旨在研究围手术期隐性卒中与术后1年认知变化的关联。术后1年,42%的围手术期隐性卒中参与者出现认知能力下降,而未发生隐性卒中参与者为29%,且更多的围手术期隐性卒中患者在数字符号替换测试和踪迹描绘测验中也有下降。有10%的围手术期隐性卒中参与者在术后前3天出现谵妄,而未发生隐性卒中的参与者中5%发生谵妄。在对NeuroVSION参与者子集的二次分析中,围手术期隐性卒中的参与者相比未发生者具有更高的神经丝蛋白轻链峰值水平和更高的谵妄严重程度评分。隐性卒中也与随后一年显性卒中或短暂性脑缺血发作的风险增加有关。
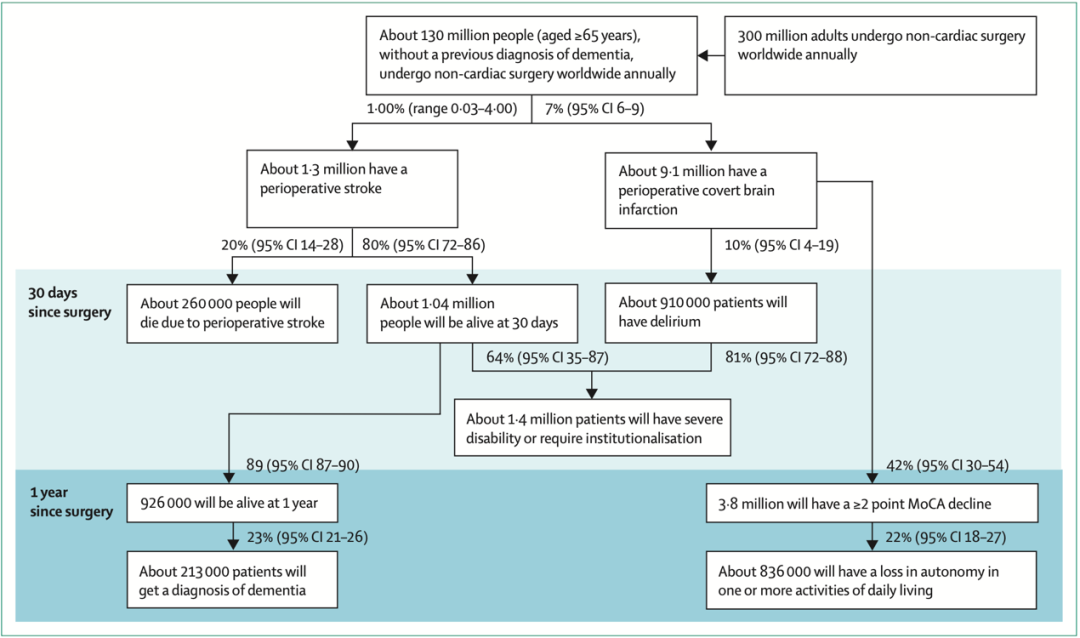
图一:围手术期卒中在非心脏手术环境中的流行病学和影响
危险因素和发病机制
因为尚不确定围手术期隐性脑卒中是否具有相同的机制和危险因素,本节中,我们将仅提及显性卒中。
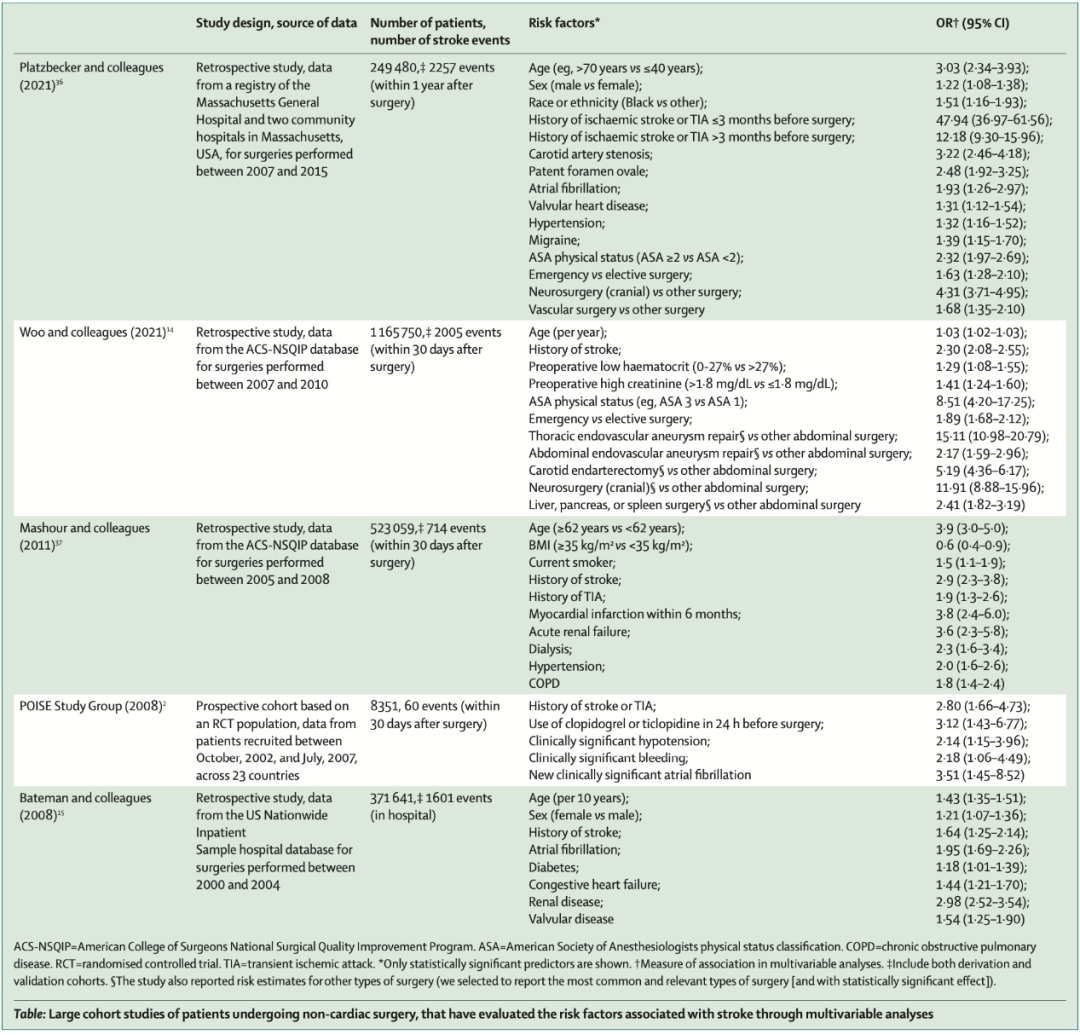
表:该表总结了对接受各种非心脏手术的患者进行的大型队列研究的结果,其中多变量分析确定了围手术期卒中的预测因素。
年龄和其他风险因素
老年患者(≥65岁)在非心脏手术后比年轻患者更有可能发生重大心血管并发症。研究表明中风或短暂性脑缺血发作的病史是围手术期中风的独立预测因素。慢性肾病、高血压、糖尿病、冠状动脉疾病和吸烟也与围手术期卒中风险增加有关。
关于颅外颈动脉狭窄患者围手术期卒中风险的数据很少。两项回顾性研究(包括224名和2110名患者)未发现颈动脉狭窄的严重程度与围手术期卒中风险之间存在关联。有症状的颅内动脉狭窄患者在随后的一年中发生卒中的风险约为15%。尽管可以假设这些患者在接受非心脏性手术时发生卒中的风险提高了15%,但实际上确切的风险尚不清楚。
手术类型和麻醉技术
急诊手术的围手术期卒中风险高于择期手术。某些类型的手术(如神经外科和血管外科)比其他类型的手术具有更高的风险。
几项大型随机对照试验研究了不同麻醉技术对接受非心脏手术的患者围手术期心血管事件发生率的影响。ENIGMA II 试验将7112名患者随机分配接受吸入浓度为70% N2O(已知N2O会不可逆地抑制维生素 B12 及其代谢)或不含N2O的全身麻醉,主要结局是术后30天内死亡和心血管并发症的发生率。BALANCED研究比较了浅麻醉(BIS目标50)与深麻醉(BIS目标35)对6644名接受预期持续时间至少为2小时的手术患者的1年全因死亡率的影响。两项试验的主要结局均未显示差异。在这两项试验中,围手术期卒中发生率约为1%,两组之间没有差异。另外有两项试验——REGAIN试验(1600名患者中出现12例卒中)以及 RAGA 试验(950名患者中出现1例卒中),比较了区域麻醉与全身麻醉下的髋部骨折手术,但没有显示两组围手术期卒中事件的差异。
心房颤动
房颤病史已被确定为围手术期中风的危险因素,但房颤是否与无症状卒中有关仍不确定。无论房颤是真正的围手术期事件还是新发现的阵发性事件,围手术期房颤都与围手术期卒中有关,并且长期来看卒中风险增加,与非手术环境中检测到的房颤相关风险相似。心脏栓塞病因可能解释许多围手术期卒中的严重程度。在NeuroVISION试验中,45%的房颤患者的皮质中发现了无症状围手术期卒中,13%患有隐性脑梗的患者患有多发性急性脑梗,这些特征提示存在栓塞机制。
卵圆孔未闭
在卵圆孔未闭的情况下,非心脏手术可增加反常栓塞的风险,因为肺压和体循环压力的变化有利于右向左分流,并增加血栓形成和非血栓形成(如脂肪)栓塞现象的风险。2022 年发表的一项系统评价总结了卵圆孔未闭与围手术期卒中之间关联的证据,校正OR为5.49,但研究之间存在显著异质性(I2=100%)。这些研究发现,与没有卵圆孔未闭的围手术期卒中患者相比,卵圆孔未闭患者发生卒中的风险增加, NIHSS评分更高,院内死亡率更高。但由于其回顾性方法和行政数据的使用,这些研究容易受到选择和确定偏倚的影响。
围手术期血流动力学
围手术期低血压很常见,28%的患者在非心脏手术术中出现临床显著低血压(即收缩压<90mmHg),19%的患者在术后出现临床显著低血压。一项病例对照研究发现,手术期间平均血压低于患者基线30%的时长与术后中风的发生有关。POISE-1试验表明,临床上术后显著低血压是围手术期卒中的最强预测因子,校正OR为2.14,归因风险为15%。
美国两个大型队列回顾性分析并没有发现术中或术后低血压与围手术期缺血性中风之间的关联。另外一项病例对照研究表明,术中低血压与术后30天卒中显著相关。不同的低血压的定义,血压监测的不同时间和方式,以及不同类型的数据和数据收集或许可以解释这些结果的不一致。
围手术期出血和输血
围手术期出血可能通过血红蛋白浓度下降和对血流动力学的负面影响导致脑血管事件。围手术期出血也可能导致延迟重新使用抗血栓药物,这可能会进一步增加卒中的风险。在美国接受非心脏手术的651775名成年人的数据分析中发现,发生大出血(即出血需要输注>4U少浆)的患者与没有大出血的患者相比在手术后30天内中风的调整后HR为2.7。术中输注的单位数与围手术期卒中风险之间存在剂量-反应关系。在 POISE-1 试验中,有临床意义的出血也是围手术期卒中的独立预测因子之一。在另一项包括 12786 名接受颈动脉内膜剥脱术患者的研究中,术中接受至少一次输血在术后30天内发生卒中的调整后OR为 4.75(接受输血的患者卒中发生率为6.1%,未接受输血的患者为1.4%)。
事实上,围手术期出血和中风之间的联系在一定程度上可能是由输血需求介导的。一项Cochrane系统评价评估了手术和非手术环境中的输血策略,未发现对卒中风险的影响。然而,一项仅包括髋部骨折患者的系统性评价发现,发现限制性输血策略对围手术期卒中具有保护作用
其他潜在的致病机制或危险因素
许多患者接受非心脏手术来治疗癌症及其并发症,而癌症本身与高凝状态有关。REGARDS研究(n=6602)的二次分析发现,与未患癌症的受试者相比,新诊断患有癌症的受试者在随访期间发生脑血管事件的风险增加。这种关联仅在诊断后的前30天内出现且不超过30天。病例报告描述了继发于急性椎动脉夹层的围手术期卒中患者,可能是由于围手术期操作涉及操作颈椎结构(例如,插管、体位、中心静脉插管和脊柱手术)或接受特别大型的手术。
风险分层和预防策略
目前尚无合适的预测模型帮助估计个体围术期卒中的风险。利用来自大型数据库的数据开发了两个模型。Woo所研究的模型提供了非心脏手术后30天内中风绝对风险的风险调整估计值;然而其不包括潜在重要的危险因素,如房颤、颈动脉狭窄和卵圆孔未闭。Platzbecker模型包括了这些预测因子,但其预测了术后一年内中风的风险,其用于围手术期风险评估尚不清楚。建议谨慎使用这两种模型,因为它们尚未在外部或前瞻性中得到验证。
许多指南都建议进行术前12导联心电图检查用于筛查术前房颤。美国2021年关于无症状患者颈动脉狭窄筛查的指南指出血运重建对无症状患者的好处以及与血运重建相关风险不确定,不建议对此类患者进行筛查。指南对使用超声心动图进行术前心血管风险分层的建议各不相同,且目前没有关于卵圆孔未闭筛查对通过反常栓塞发生卒中的高风险患者进行一级预防的有效性和成本效益的证据或指导。总体而言,没有足够的证据支持颈动脉狭窄或卵圆孔未闭的术前筛查。然而,许多患者既往接受过超声心动图或颈动脉超声检查,应在术前评估时进行复查(同时评估进行这些检查的原因)。
手术时间
既往卒中患者围手术期卒中的风险增加;然而,风险会由上一次卒中距当下的时长而发生巨大变化。丹麦一项大型队列研究中发现,与从未发生过卒中的患者相比,术前3个月内发生卒中的患者在非心脏手术后 30 天内术后缺血性卒中的调整 OR 为 67.6,在非心脏手术前3~6个月之间发生中风患者的 OR 变为24.0,在非心脏手术前6~12个月之间发生中风的患者为10.4。这些分析表明,对于在非心脏手术9个月或更长时间发生的中风患者,术后中风风险的增加趋于平稳。
Glance及其同事研究证实,尽管围术期中风的风险随手术时间而变化,当前一次中风发生在90天前时,与前一次中风相关的风险趋于平稳。美国心脏协会声明,将择期手术推迟到前一次中风后6~9个月可能显得过于保守。二级中风预防的改进可能解释了最近的美国队列中的不同发现,然而,这两项研究之间的差异仍然大多无法解释。在卒中患者的临床管理中,任何将择期手术推迟到既往卒中后3个月、6个月或9个月的决定,都应始终与延迟计划手术造成的预期危害相平衡。
动脉粥样硬化、抗凝和出血
在POISE-1试验中,与接受安慰剂的患者相比,随机分配接受围手术期 β 受体阻滞剂(即琥珀酸美托洛尔)的患者中风的患者更多。在POISE-2试验(n=10004)中,对于正在接受非心脏手术的已知动脉粥样硬化疾病或风险的患者继续或开始使用阿司匹林并不能降低术后30天发生主要心血管并发症的风险,包括中风,但与安慰剂相比,阿司匹林确实增加了大出血。无论患者在手术前是否服用阿司匹林,结果都是一致的。
几项小型随机试验评估了他汀类药物对接受非心脏手术的患者围手术期心血管并发症的影响。这些试验的两项荟萃分发现,围手术期使用他汀类药物可降低术后心肌梗死的发生率,但对中风没有显著影响。观察性数据表明,术前高血糖会增加接受非心脏手术的糖尿病患者围手术期中风的风险;然而,在心脏手术中关于血糖的试验发现,严格血糖控制在预防围手术期心肌梗死或中风方面没有益处。因此目前的证据并不支持在围手术期开始或加强这些药物治疗以预防非心脏手术中的中风。然而,当患者必须等待数周或数月才能进行手术时(特别是当决定推迟手术时),有理由将这段时间视为优化控制动脉粥样硬化危险因素的机会,这些因素与围手术期中风发病率增加有关(如高血压、糖尿病、 肥胖和吸烟)。
在接受大型非心脏手术的队列中,有3%至8%的患者正在接受长期口服抗凝治疗,以治疗存在栓塞性卒中风险的疾病(如房颤)。不同手术出血风险不同,有些手术在低至中度风险类别(即大出血风险≤2%)下(如腹腔镜手术),对于接受这些类型手术患者,科学指南建议根据特定口服抗凝剂类型的规则暂时中断口服抗凝治疗。除了与手术相关的出血风险外,还考虑患者特异性血栓栓塞并发症的风险;其他相关因素包括患者的肾功能和麻醉类型。
约1/4至1/3的接受长期口服抗凝治疗且计划进行大型非心脏手术的患者将接受维生素 K 拮抗剂(即华法林)治疗。其药理特性为其围手术期停药和恢复治疗增加了挑战,从而导致了桥接抗凝策略的使用和评估。BRIDGE 试验旨在评估心房颤动住院患者的围手术期低分子量肝素桥接情况,这些患者在非心脏手术前5天中断了华法林的长期治疗。在动脉栓塞事件中,未桥接并不劣于桥接(安慰剂组[0.4%] vs 桥接组[0.3%];非劣效性p=0.01)。相比之下,安慰剂组和桥接组大出血发生率分别为1.3%和3.2%(RR 0.41)。PERIOP2试验纳入了1471名患有心房颤动和机械心脏瓣膜的患者也发现了类似的结果。基于这一证据,不建议常规进行围手术期抗凝桥接。然而,这些试验中患者接受的手术大多是低风险、非癌症门诊手术,大多数患者的 CHA2DS2-VASc评分为2分或更低,BRIDGE 试验中只有9%的患者和 PERIOP2试验中只有12%的患者曾患中风,并且这两项试验在患者入组方面都面临挑战,部分原因是直接口服抗凝剂的使用量超过了华法林。值得注意的是,直接口服抗凝剂的优势在于其抗凝作用的起效和消退速度比华法林更快,且相对更可预测可逆转,这些优势在围手术期尤为重要。
2022年围手术期抗凝管理综合指南强调,是否以及何时在围手术期中断和恢复抗凝治疗的决定应基于对患者特异性和手术特异性血栓和出血风险的仔细评估。至关重要的是,这些风险应在手术后每天重新评估。这种日常评估需要外科医生的参与。
围手术期出血和输血与卒中的潜在关联需要采取策略来尽量减少这些并发症。在一项国际随机试验中,静脉注射2g氨甲环酸(手术开始时推注1g)与大出血结局和输血需求的相对风险相比对照组降低了25%,但并没有增加卒中和其他围手术期心血管结局的风险。
结论和未来方向
围术期卒中会对患者预后产生重大影响,对人群层面的预计负担很高。在这些情况下,参与围术期管理的每一位临床医生都应配备有关围手术期卒中的流行病学、发病机制、风险分层和优化的最新证据。我们建议对接受非心脏手术的成年患者采用临床循证方法,包括通过风险分层和风险优化来预防卒中的策略。
鉴于围手术期脑卒中的发生率相对较低,目前仍需要大型前瞻性队列和随机试验来填补目前关于围手术期事件(如反常栓塞和血流动力学异常)致病作用的空白,并为围手术期脑卒中的筛查、预防和治疗提供临床实践信息。关于隐匿性脑卒中围手术期发生率相对较高的研究可能帮助我们更好理解围手术期脑血管事件的性质和作用,并可能引发该领域的进一步研究。关注围手术期脑梗的血液标志物(如脑肌钙蛋白)或数字生物标志物(如精神运动功能)的亚临床变化将有助于筛查。此外,需要对术前、术中和术后策略进行更多研究,以减少围手术期脑卒中对认知和功能下降的影响。
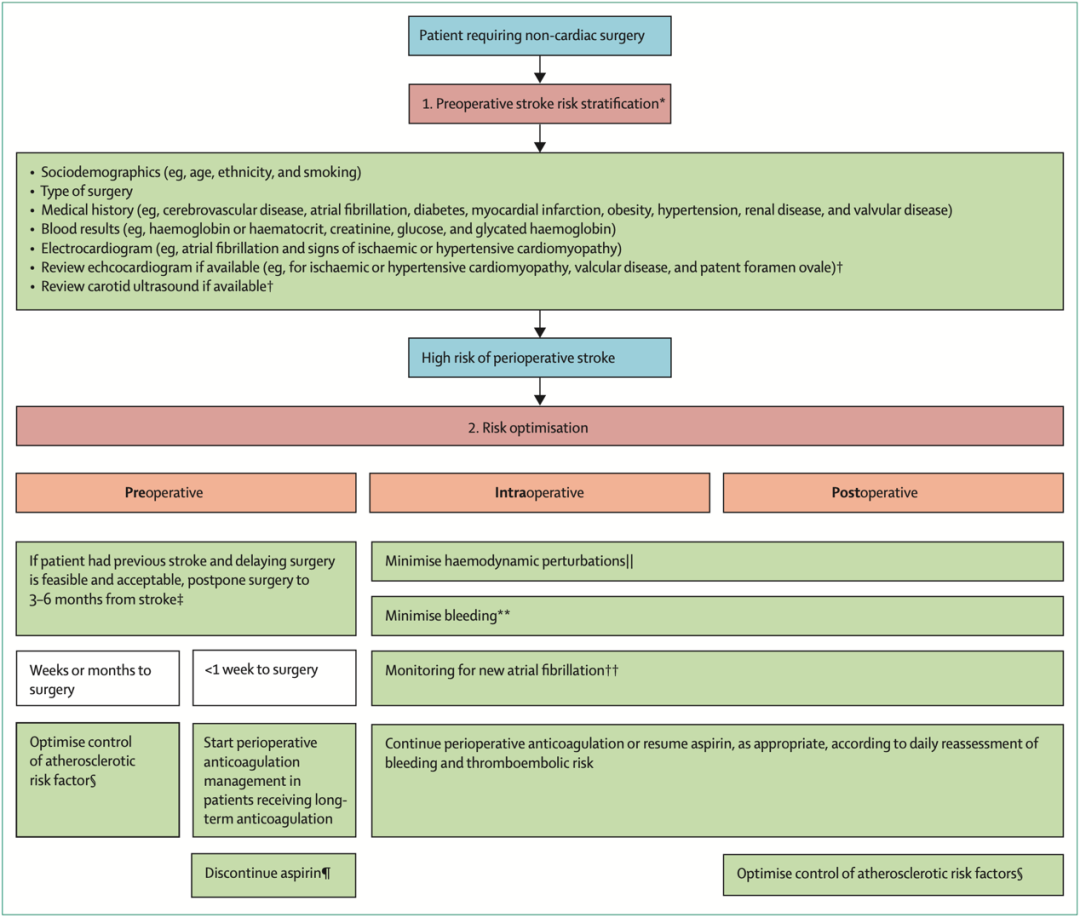
图二:非心脏手术围手术期卒中循证临床方法:通过风险分层和风险优化来预防卒中策略
论肿道麻 述评
《柳叶刀神经病学》杂志2023年10月刊发表的综述文章《预防非心脏手术患者围手术期中风》深入探讨了非心脏手术中围手术期中风的流行病学、风险因素、潜在机制及预防策略。文章指出,尽管围手术期中风的发病率不高,但由于手术患者基数庞大,其对患者健康和医疗系统的影响不容忽视。文章强调,围手术期隐性脑梗塞比显性中风更常见,且与术后谵妄、认知能力下降和长期脑血管事件风险增加有关。研究显示,传统中风风险因素如年龄、高血压和房颤同样与围手术期中风相关,而既往中风史是最强的风险因素。此外,围手术期事件如低血压、新发房颤、矛盾性栓塞和出血也在中风发病中扮演重要角色。文章还讨论了预防策略,包括优化围手术期血流动力学管理、减少出血和输血、以及术前风险评估和优化。文章的结论强调了围手术期中风对患者预后的显著影响,并呼吁临床医生提高对围手术期中风的认识,以改善患者术后的长期健康。这篇文章为非心脏手术围手术期中风的预防和管理提供了宝贵的信息,对于提高手术安全性和患者术后恢复质量具有重要意义。
参考文献:
Marcucci M, Chan MTV, Smith EE, Absalom AR, Devereaux PJ. Prevention of perioperative stroke in patients undergoing non-cardiac surgery. Lancet Neurol. 2023;22(10):946-958. doi:10.1016/S1474-4422(23)00209-0
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#非心脏手术# #围手术期卒中#
36