Blood Cancer Discov:NPM1突变AML的诊断、风险分层和分子监测标准
2023-11-11 聊聊血液 聊聊血液 发表于上海
该研究对 NPM1 突变 AML 的诊断、风险分层和分子学监测标准进行综述。
NPM1突变AML
NPM1 突变急性髓系白血病 (AML) 由于其独特的特征,在2022年 ICC和 WHO 第5版髓系肿瘤分类中,均认为是一种独特的白血病亚型。

NPM1突变AML是成人 AML 中最大的分子学亚组(30-35%),可通过分子技术和免疫组化进行识别,两者联合使用时可解决困难的诊断问题(包括识别髓系肉瘤和外显子12以外的 NPM1 突变)。根据2022年欧洲白血病网 (ELN),确定NPM1(和FLT3)的突变状态是基于基因的 AML 风险分层的必须步骤,通过 RT-qPCR 监测MRD,结合 ELN 风险分层,可指导缓解后阶段的治疗决策。
Blood Cancer Discovery近日发表一篇文章,对 NPM1 突变 AML 的诊断、风险分层和分子学监测标准进行综述。现翻译全文供参考,水平有限,如有错误敬请谅解。

意义
1、NPM1 突变急性髓系白血病是2022年 ICC 和第5版 WHO 髓系肿瘤分类中的一个独特亚型。
2、NPM1 突变 AML 的正确诊断及其与其他 AML 亚型的区别极为重要,因为它对 AML 患者的治疗具有临床意义,正如根据2022欧洲白血病网 (ELN) 进行的基于基因的风险分层。
3、通过 RT-qPCR 监测可测量残留病灶 (MRD),结合 ELN 风险分层,可指导缓解后阶段的治疗决策,例如是否进行异基因造血干细胞移植
NPM1突变AML的检测技术
NPM1 突变可以通过分子检测或替代技术(包括免疫组化)来鉴定,这些方法可互补,允许灵活的方法来诊断 NPM1 突变AML,这对于在全球范围内实施使用 ICC 和 WHO 分类至关重要。
分子技术定性检测NPM1突变
约1/3的成人 AML 患者携带 NPM1 突变,但在儿童期并不常见(约8%),通常为非A型(A和B型共占80%)。NPM1突变 A 型(参考序列860~863位 TCTG 的重复)发生在约75-80%的成人病例中,突变 B 和 D 约占病例的10%和5%,而其他突变罕见。目前已认识到100多种不同类型的 NPM1 突变,NPM1 突变的一个显著特征是它们不驱动克隆性造血,因此若缓解时存在NPM1 突变则表明存在可导致复发的活动性疾病,并与较差结局相关。在这方面,NPM1突变与DNMT3A、TET2和 ASXL1 基因突变(与克隆性造血相关)明显不同;这些突变可在缓解时持续存在但无预后价值,仅反映AML 治疗后重建的白血病前状态,无需进一步治疗。
NPM1 突变的定性分析最常基于基因组 DNA 作为底物,并使用PCR,然后使用片段长度分析来检测插入,但基于熔解曲线分析和逆转录定量 PCR(RT-qPCR) 的分析也可用。一般而言,首选 PCR 片段分析方法,因其可以检测 PCR 扩增子内的所有插入,与突变序列无关,并且简单快速,灵敏度约为5%,几乎在所有情况下均足够。但例外情况是髓系肉瘤,建立亚显微骨髓 (BM) 受累需要更灵敏的技术,如 RT-qPCR。
定性检测最好应用于新鲜 BM 或外周血 (PB) 白血病细胞,但血浆也适用。由于脱钙剂对核酸的变性作用,石蜡包埋环钻中 NPM1 突变的分子检测不可靠。但髓样肉瘤病例从石蜡包埋组织活检中提取的 DNA 通常足以进行 PCR 片段分析。
鉴别出 NPM1 突变后,对于计划进行 MRD 监测的患者,有必要确定突变序列并储存 DNA 和RNA,以便测定基线转录水平,从而与缓解后样本进行比较(在下文进一步讨论)。二代测序 (NGS) 越来越多地用于 AML 的诊断,具有提供插入序列的优势,如果使用适当的组合,能够检测外显子12以外的突变,并识别也可能具有预后影响的共突变。最近的一项研究使用不同的 NGS 平台研究了实验室间识别 AML 驱动突变(DNMT3A、FLT3、IDH1、IDH2、NPM1、TET2、TP53和WT1)的一致性,发现一致性>95%,与 NPM1 突变完全一致。考虑到在治疗开始前对患者进行快速分子分层的需求日益增加,NPM1和其他可能影响一线治疗选择的突变的快速 PCR 方法可在可预见的未来发挥作用。
细胞质NPM1的免疫组化检测
NPM1向白血病细胞(也称NPM1c+)胞浆的异常输出是突变诱导 NPM1 c 端改变的结果,即288和290位的一个或两个色氨酸缺失,并添加一个新的 NES 基序,增强与核出口商输出蛋白-1(XPO1) 的相互作用。插入不同强度的新 C-末端 NES 基序,进一步调整突变体的核质穿梭。
免疫组化检测NPM1c+是诊断 NPM1 突变 AML 的一种简单、低成本、非常敏感和特异性的替代检测方法,可作为分子检测的替代方法。有趣的是,免疫组化也允许在组织切片的蛋白水平研究基因病变,并可能提供 NPM1 突变白血病细胞的地形分布信息(例如在小梁旁区域或靠近血管)。针对 NPM1 和 C23/核仁素不同结构域的单克隆抗体的反应模式见图1。
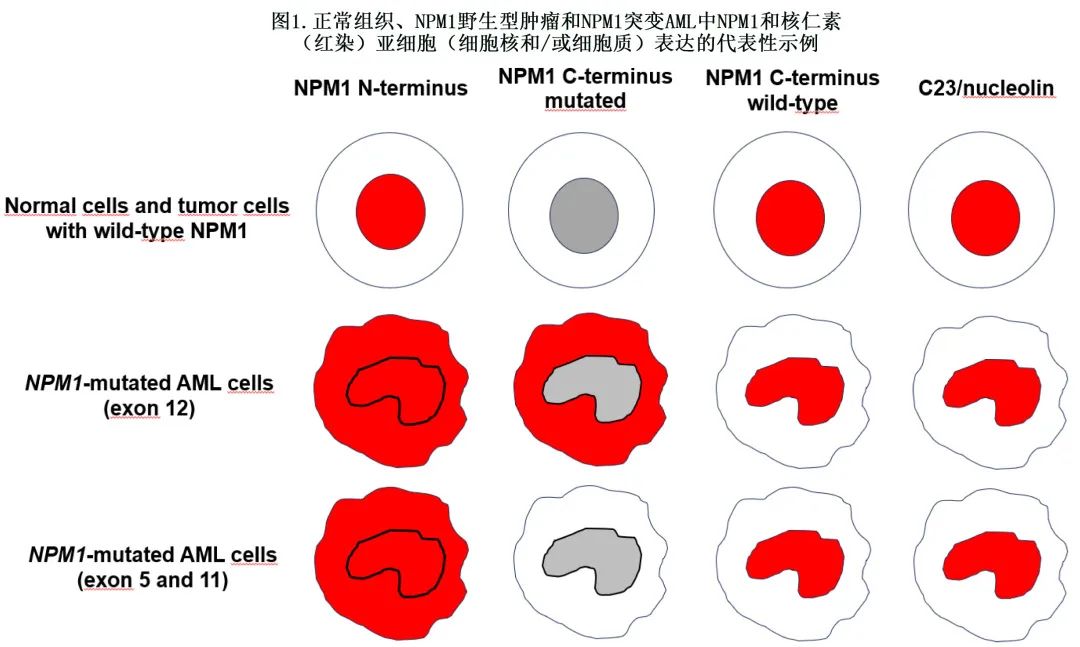
免疫组化对于定义多系发育异常、髓样肉瘤的诊断、识别再生障碍性或坏死性骨髓(导致干抽)病例和鉴别外显子12以外NPM1 突变患者(标准分子检测可能遗漏)至关重要(见下文)。当分子检测不可用时,该技术也可作为检测 NPM1 突变的替代方法。
使用特异性靶向 IDH1-R132H 突变蛋白的单克隆抗体,可通过分子免疫组化进一步表征 NPM1 突变的AML,因为 NPM1 突变与 IDH1-R132H 的相关性高于与其他氨基酸变化的相关性(即IDH1-R132C、R132G、R132S)。
流式细胞术检测NPM1突变蛋白
通过流式细胞术诊断 NPM1 突变AML 是基于细胞质 NPM1或特定表型的检测。最近的一项研究强调了与 NPM1 突变 AML 相关的独特的免疫表型模式,包括:i)未成熟的CD34lo/HLA-DR lo /CD15+/CD7+ AML细胞和/或,ii)中性粒细胞系 AML 细胞显示低CD34、CD71和CD64,同时上调 CD105 和/或,iii)单核细胞白血病细胞 CD34 lo和异步(CD300e+ CD14-;CD35+ CD14-)表型。此外,NPM1突变/FLT3-ITD 基因型与未成熟白血病细胞上的 CD7hiCD38 lo表型和/或中性粒细胞谱系定向 AML 细胞上的 CD117het和 CD123hi表达密切相关。
NPM1突变AML的诊断陷阱
如果在符合其他 AML 诊断标准的患者中检测到 NPM1 突变和/或 NPM1 的异常细胞质表达,则可诊断NPM1 突变AML。在分子学确认前可能有助于预测 NPM1 突变 AML 的其他特征包括:发生在中年或更老患者中、白细胞计数 (WBC) 较高但血小板数量相对保留、原始细胞伴粒单核细胞 (M4-M5) 分化、多系受累、杯状形态、CD34和 HLA-DR 阴性、细胞遗传学正常和皮肤受累。NPM1 和 FLT3-ITD 或 RAS 共突变的患者经常表现为高白细胞血症,并可能表现为星空模式,而无 FLT3 或 RAS 突变的 NPM1 突变 AML 通常表现为低-正常 WBC 计数。NPM1 突变 AML 的骨髓具有特征性的细胞过多,但网硬蛋白纤维通常未增加。NPM1 突变 AML 诊断中的陷阱讨论如下。
AML伴多系发育异常
约23%的 NPM1 突变 AML 表现为多系发育异常(即至少两个 BM 细胞谱系中发育异常≥50%的细胞),可能误诊为骨髓增生异常综合征 (MDS) 或AML/MDS。NPM1 突变可确立诊断,因为基因病变的重要性高于形态学。免疫组化通过显示红系和髓系前体甚至成熟巨核细胞中核磷蛋白的异常细胞质表达证实了多系参与。
诊断髓系肉瘤
NPM1 突变AML 中髓外受累并不罕见,皮肤是最常受累的解剖部位之一,尤其是在具有单核细胞或粒单核细胞特征的病例中。与 NPM1 突变 AML 相比,NPM1突变髓系肉瘤似乎表现出基因组突变谱的差异,包括细胞遗传学异常和影响表观遗传修饰因子(如ASXL1)的突变频率更高,PTPN11、DNMT3A和 IDH1 突变频率更低。NPM1 突变髓系肉瘤的总生存期也比 NPM1 突变AML 差。
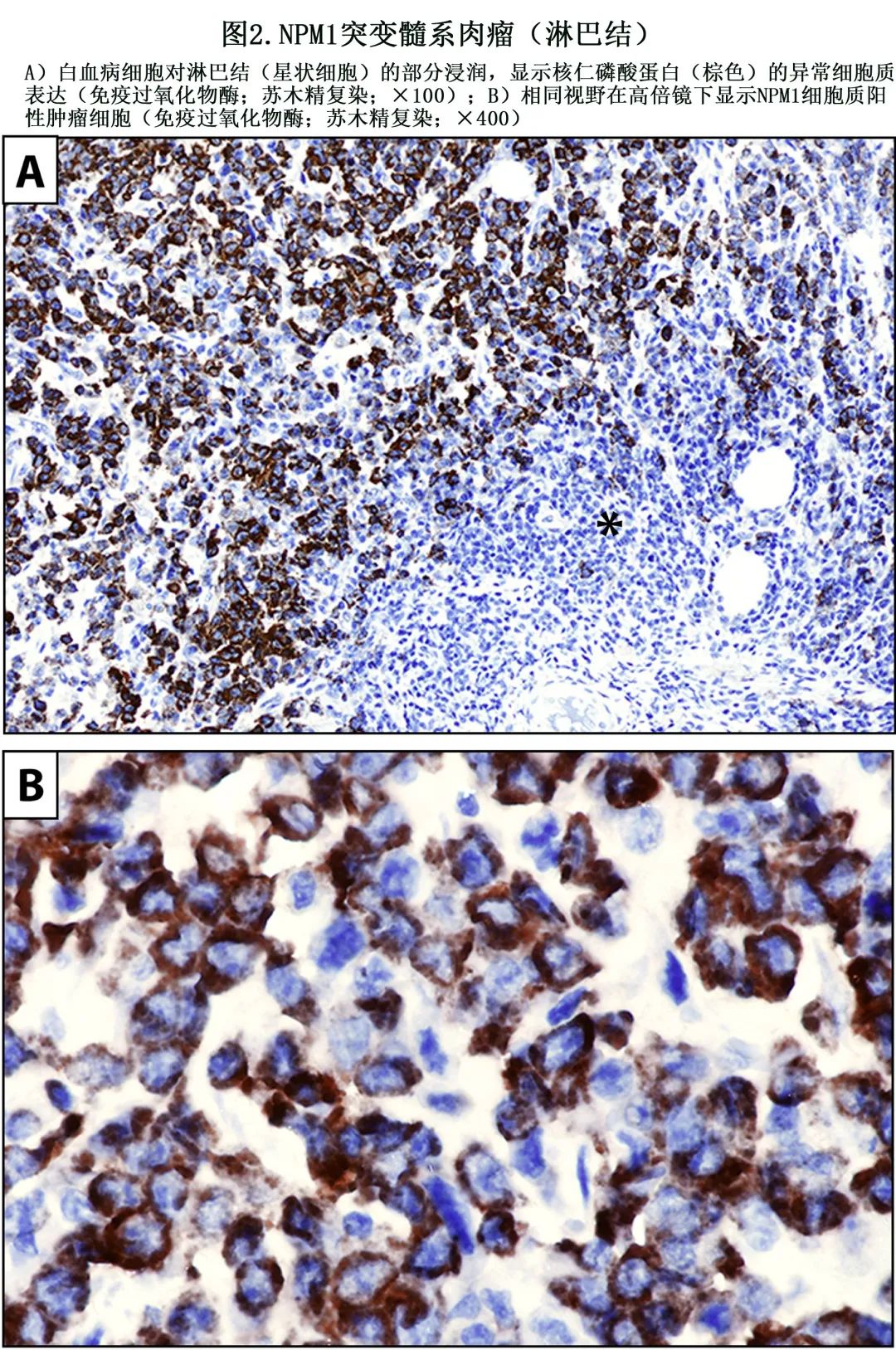
在确定 NPM1 突变髓系肉瘤的诊断时,细胞质 NPM1 的免疫组化检测比分子检测更可靠(图 2A 和B),特别是当只有小的活检样本可用于分析时(例如钻取活检)。髓外受累是否为NPM1 突变 AML 的不良预后因素仍存在争议。在一项>3000例 AML 患者的大型研究中,髓外病变并非独立预后因素(但未考虑突变状态)。髓系肉瘤和并发 BM 之间的分子不一致(定义为在任一样本中发生不同的突变)与较差的总生存期相关,可能是由于克隆异质性增加和治疗耐药。
鉴别外显子12外的NPM1突变
NPM1 突变几乎只影响外显子12,涉及外显子9、11和5的突变可能很少发生。与涉及的外显子无关,所有 NPM1 突变均导致 C 末端的类似变化,导致 NPM1 突变蛋白的输出增加及其在白血病细胞细胞质中的积累。为此,免疫组化是检测发生在外显子12以外的 NPM1 突变的极好方法。如果免疫组化和分子检测联合使用,两种技术之间的差异(即在外显子12无突变的情况下检测细胞质NPM1)应提示分析整个 NPM1 编码序列,以识别其他外显子的突变(图3)。通过针对 NPM1 N 末端的抗体而非NPM1 突变体特异性抗体鉴定外显子11和外显子 5 NPM1 突变体的异常细胞质定位(图1)。事实上,外显子11和外显子5突变可导致截短蛋白或更长突变体的翻译,保留与 NPM1 野生型相同的 C 末端序列。尽管 NGS 可以识别任何外显子中发生的突变,但许多市售 NGS panel仅靶向外显子12,因此可能需要定制panel来检测其他突变(图3)。
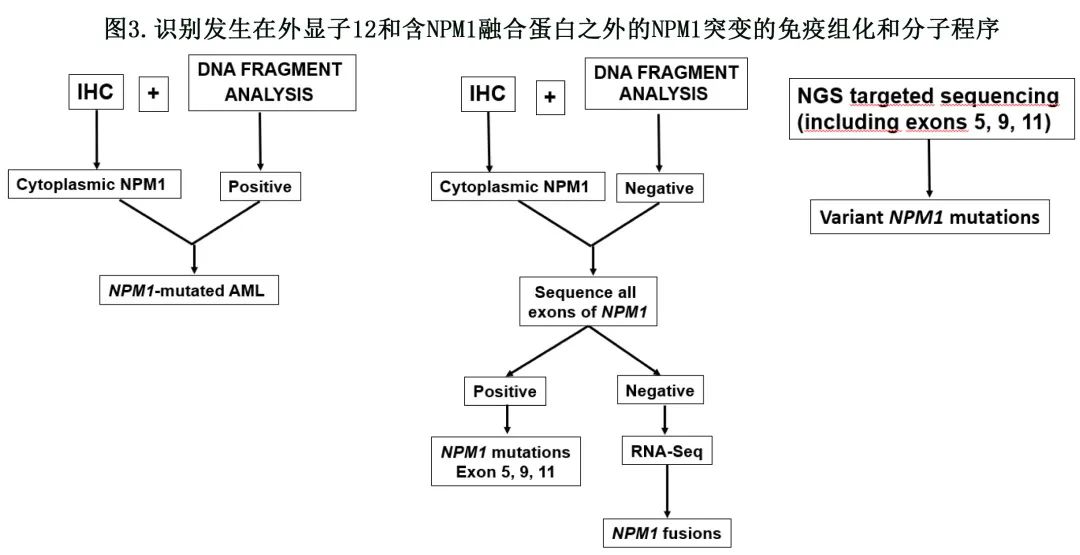
无法识别外显子11和5突变可能导致将这些病例错误分配至 ELN 中危组(NPM1 野生型伴无 FLT3-ITD),而非低危组(NPM1 突变伴无 FLT3-ITD)。由于分析的病例数量较少,仍不清楚这些患者是否与外显子 12 NPM1 突变的典型患者具有相同的预后。到目前为止,关于外显子12以外 NPM1 突变的 MRD 监测数据很少,需要患者特异性 RT-qPCR 检测。
伴随NPM1突变和BCR::ABL的AML
NPM1 突变与BCR::ABL1的相关性在 AML 中罕有报道,这些病例应归类为 NPM1 突变AML,并注释 BCR::ABL1的存在;该分类也得到了其CD34阴性的支持,CD34阴性在BCR::ABL1中不常见。NPM1 突变伴无 FLT3-ITD的AML 具有相对较好的预后,而伴BCR::ABL1的AML是一种高危白血病。ELN 未提供同时携带 NPM1 突变和BCR::ABL1病例的预后信息,这些病例在免疫表型和临床上的表现更像 NPM1 突变AML而非AML 伴BCR::ABL1,但需要进一步的研究来阐明该问题。
治疗相关NPM1突变AML
NPM1 突变是原发 AML 的特征。既往细胞毒化疗和/或放疗后发生的治疗相关 AML 病例中约15%携带 NPM1 突变,这些病例与原发NPM1 突变 AML 具有许多重叠的生物学和临床特征,始终表现出正常的细胞遗传学、DNMT3A和 TET2 突变、细胞质 NPM1 和以 HOX 基因上调和 CD34 下调为特征的基因表达谱。此外,治疗相关 NPM1 突变 AML 中负责化放疗驱动选择的 TP53 和 PPM1D 突变率(分别为3%和4%)远低于治疗相关 AML 伴野生型NPM1(分别为25%和高达20%)。最后,治疗相关和原发NPM1突变 AML 的生存期相似,但与治疗相关 AML 伴野生型 NPM1 的生存期存在显著差异。总的来说,这些发现清楚地表明,“治疗相关”NPM1突变 AML 的白血病机制不同于其他治疗相关AML,很可能代表着一种恰巧有既往治疗史的原发白血病。基于这些发现,治疗相关NPM1 突变 AML 现在在 2022 ICC 和 WHO-5 分类中均视为 NPM1 突变AML(添加“治疗相关”或“细胞毒性后治疗”作为限定条件)。应将无 FLT3-ITD 的治疗相关 NPM1 突变 AML 分配至 ELN 低危组,并在 MRD 评估的指导下决定移植,与典型原发NPM1 突变 AML 患者相同。
定义NPM1突变AML的原始细胞百分比
根据 WHO 第5版,无论原始细胞百分比如何,均可诊断为 NPM1 突变AML,而 2022 ICC 仍需要≥10%的原始细胞,因此如何诊断原始细胞<10%的 NPM1 突变髓系肿瘤的问题仍然悬而未决。以往通常将此类病例分为 NPM1 突变骨髓增生异常综合征 (MDS) 或 NPM1 突变慢性粒单核细胞白血病 (CMML),然而它们通常更类似于 NPM1 突变AML而非MDS 或 CMML伴野生型 NPM1。事实上,它们通常表现出正常的核型,缺乏定义 MDS 或 AML 伴骨髓增生异常相关突变的典型突变(ASXL1、BCOR、EZH2、RUNX1、SF3B1、SRSF2、STAG2、U2AF1和ZRSR2)。此外,它们显示 CD34 阴性,倾向于快速演变为AML,尤其是当 NPM1 突变等位基因负荷较高且对化疗反应良好,但对去甲基化药物反应欠佳时。总的来说,这些发现强烈提示原始细胞<10%的 NPM1 突变髓系肿瘤可能代表早期诊断的 NPM1 突变AML,且NPM1突变定义 AML 与原始细胞计数无关。BM 活检的免疫组化研究也支持这一概念,该研究显示 NPM1 细胞质原始细胞聚集,通常数量超过仅通过形态学标准可检测到的原始细胞,因此建议这些患者应作为典型的 NPM1 突变 AML 进行治疗。
NPM1突变的预后影响
基于遗传学的风险分层是 AML 患者管理常规检查的一部分。新诊断 AML 的致病变异中位数为4-5,常见情况为突变逐步累积,从克隆性造血相关突变开始(例如 DNMT3A 和TET2),随后为 AML 定义突变(如NPM1),而获得信号通路组分突变(如FLT3、NRAS、KRAS)作为白血病发生的最终事件。然而各种各样的突变组合(有时与继发性染色体异常有关)可能有助于 NPM1 突变 AML 的基因分型。
一旦确诊NPM1 突变 AML,应根据 ELN 2022 指南对患者进行风险分层。将无 FLT3-ITD 突变的 NPM1 突变患者分配至低危组,FLT3-ITD 突变(不考虑等位基因比率)分配至中危组,因为难以重现实验室间等位基因比率的测量结果,并且MRD 状态在风险分层中发挥着越来越重要的作用;此外将核型不良者分配到高危组。越来越多的证据表明,NPM1突变 AML 的预后可能因 FLT3-ITD 以外的伴随突变而异。因此需要对统一治疗的患者进行非常大规模的研究,以将风险相关性分配到突变亚组,但目前的数据在某些领域存在冲突,应视为暂时性的。在一项包括435例 NPM1 突变患者的研究中,患者被纳入序贯强化治疗方案,FLT3-ITD和 DNMT3A 共突变的患者 (n=93)预后特别差,而 NRAS 密码子12(n=69) 或RAD21(n=33) 突变的患者表现出总生存期改善。一项纳入297例 NPM1 突变患者的类似研究发现 WT1 突变患者的预后较差。使用来自多个协作组研究(包括1093例 NPM1 突变患者)的合并数据进行的分析显示,共突变之间存在复杂的相互作用,但再次确定 FLT3-ITD 和 DNMT3A 共突变患者的预后极差。在没有 FLT3-ITD 和 IDH1 的情况下,NRAS、KRAS、PTPN11和 RAD21 突变与良好的预后相关。
ICC 和 WHO AML 分类在共突变发生时优先考虑 NPM1 突变状态,而非骨髓增生异常相关 (MR)(“继发性”)突变(SRSF2、SF3B1、U2AF1、ZRSR2、ASXL1、EZH2、BCOR和STAG2)。ELN 小组的建议是骨髓增生异常相关突变不应推翻同时发生 NPM1 突变的有利影响,这进一步得到了最近一项研究的支持,该研究纳入了936例 NPM1 突变 AML 患者,其中骨髓增生异常相关突变不影响该队列的结局。与无共同突变的病例相比,同时发生骨髓增生异常相关突变的 NPM1 突变 AML 病例年龄显著更大、WBC和血小板水平更低;但完全缓解率 (CR)、无复发生存期 (RFS) 或总生存期 (OS) 无差异。因此,仍应将这些患者视为 ELN 低危并进行相应治疗。
迄今为止,ELN方案中未完全捕获的与不良结局一致相关的唯一基因型为NPM1、FLT3-ITD和 DNMT3A 突变的组合,然而目前仍不清楚这一发现是否或如何影响治疗。
关于缓解后治疗的决策通常以 ELN 方案为指导,但建议应使用 MRD 评估对患者进行重新分类,因此MRD反应不佳的低危患者可视为异基因造血干细胞移植 (allo-HSCT) 的候选者,而 MRD 反应良好的中危患者可潜在地避免移植。虽然迄今为止发表的有限数据支持这种策略,但选择 allo-HSCT 患者仍存在一定争议。目前没有直接证据表明,CR1 期MRD阳性的 NPM1 突变 AML 患者可从 allo-HSCT 中获益,但这些患者接受移植的试验方案的结果非常令人鼓舞。对于中危患者,ALFA 0702研究的事后分析表明,只有 MRD 缓解不佳的患者才能从 allo-HSCT 中获益。最近,HOVON和 GIMEMA 组的数据进一步支持了这一点,中危组的患者(不考虑基线 NPM1 状态)根据第二周期强化化疗后的 MRD 结果分配接受自体移植或异基因HSCT,结果 MRD 阳性组和阴性组之间的结局相同。然而在 NPM1 和 FLT3 ITD 突变患者中仍存在争议,因为早期研究显示移植获益,尤其是在高等位基因比率的患者中;然而这些研究未纳入 MRD 评估,因此对于 MRD 阴性的 NPM1 和 FLT3-ITD 突变患者,alloHSCT的获益仍不确定,但仅 MRD 阳性患者接受 allo-HSCT 的方案在该组中显示了极佳的结果。同样,对于其他高危基因型(包括“三打击”)患者,尚缺乏MRD 阴性患者的移植获益数据;然而在一项研究中,这些患者的预后相对有利(3年OS 70%)。
总之,虽然仍需要进一步的数据,但目前的 ELN 风险分层方案(基于 MRD 状态在低危和中危组之间进行适当的重新分类)应仍作为缓解后治疗决策的基础。
NPM1突变AML的分子MRD评估
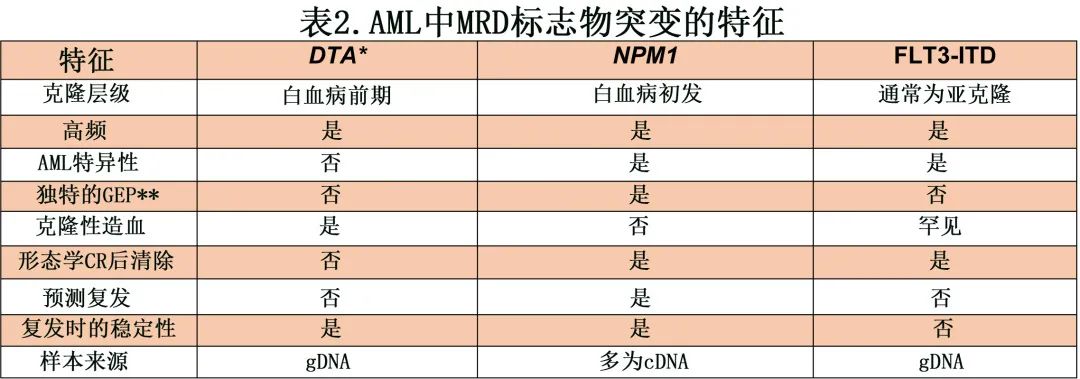
NPM1 突变是监测白血病亚临床水平(即可测量的残留病,MRD)的理想靶点,因为它们是常见的 AML 特异性突变、在正常组织中不表达、在白血病前状态(如克隆性造血)中不存在;此外,它们与治疗反应、疾病复发时的复发和 MRD 水平升高(称为 MRD 复发)相关,能够可靠地预测数周/数月内的临床复发,为抢先干预留出时间(表2,AML特异性FLT3-ITD应为否)。MRD 评价,包括 NPM1 突变转录本的 MRD 评价,目前被欧洲白血病网常规推荐用于评价 AML 治疗的分子学反应,而相关的白血病前突变“应从 MRD 分析中排除”。这种方法也可用于指导已获批用于 AML 的新型、毒性较小的药物的 MRD 靶向治疗。最后,NPM1 MRD作为监管终点的批准预期将显著改变临床试验前景,如生物标志物驱动的适应性设计。
NPM1 突变转录本几乎总是在一个小热点插入,使其成为以 RNA 为底物进行 RT-qPCR 检测的理想靶点,是目前推荐的方法。该方法可提供非常高的灵敏度,特别是当使用 BM 样本时(使用 PB 时灵敏度约低一个对数)。在最近的一项研究中,29个实验室报告了 NPM1 野生型样本中相当大比例的假阳性结果(CBFB::MYH11为4.3%,PML::RARA为4.5%,NPM1为26.1%)。假阳性结果可能导致错误的临床决策,例如计划不必要的额外化疗和/或异基因移植,从而导致发病和死亡的风险,因此当这些检测用于指导临床决策时,需要广泛的验证、严格的阴性对照和外部质量保证。
业内对使用数字液滴 PCR 和基于 NGS 的超深测序越来越感兴趣。数字液滴 PCR 的优点包括高灵敏度(当使用 RNA 作为输入时)和能够定量罕见突变(即非A、B或 D 型),而不需要标准曲线。基于 NGS 的策略可以检测所有类型的 NPM1 突变体,但目前缺乏标准化,目前灵敏度较低,特别是以基因组 DNA 为底物的策略时;因此目前仅在临床试验推荐。
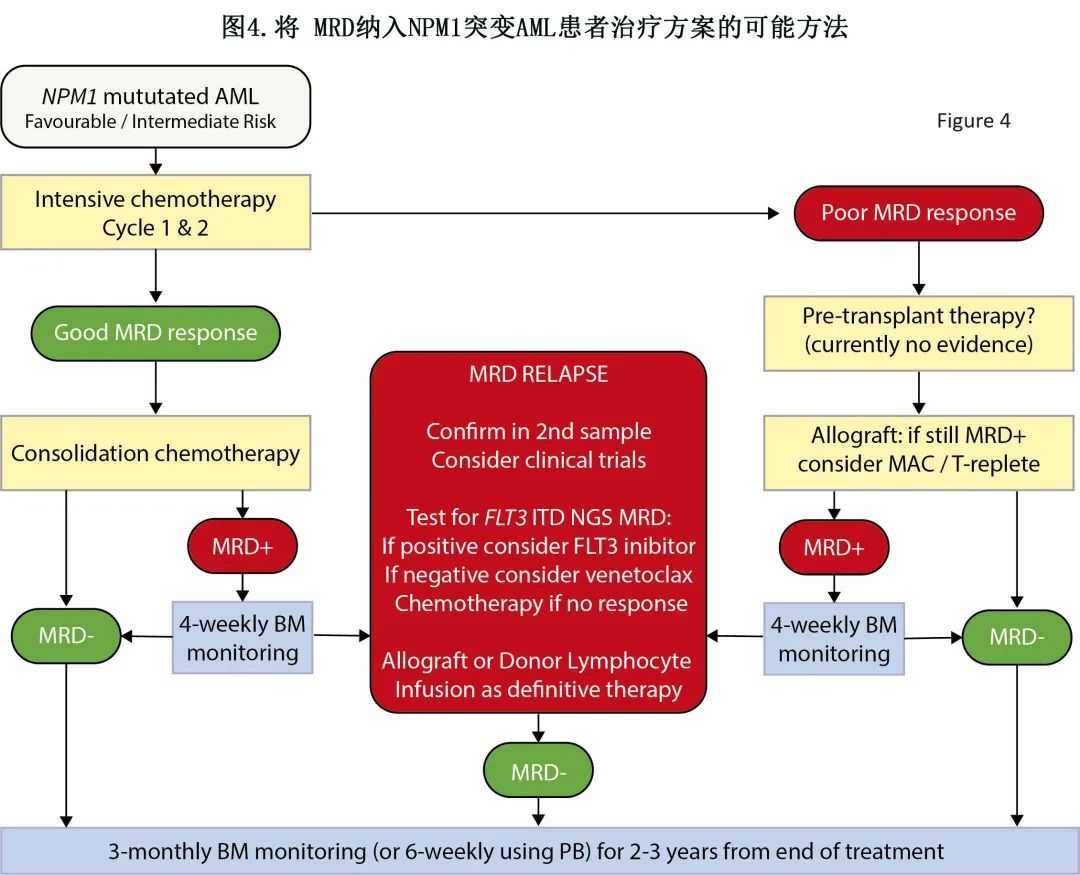
NPM1 突变 AML 的 MRD 分子评估有许多不同的临床应用:i)诱导后的 MRD 状态强烈预测复发和总生存期,因此可用于完善当前 ELN 方案内的风险评估,实现更合理地选择 allo-HSCT 患者;ii)移植前 MRD 评估对预后具有高度预测性,可为移植前管理提供信息;iii)连续 MRD 评估可检测 MRD 复发,其可预测即将发生的临床复发,提供抢先干预的窗口期;iv)可用于定义 CRMRD-的新反应类别,用于常规实践和临床研究;v)可作为替代终点,以加速药物检测和批准。将 MRD 纳入 NPM1 突变 AML 患者治疗方案的可能方法见图4。
多参数流式细胞术 (MFC) 在监测 NPM1 突变 AML 的 MRD 中的作用有限,因为白血病相关免疫表型 (LAIP) 并不完全具有特异性。此外,根除 NPM1 突变后的持续克隆型造血可能导致 MFC 对 MRD 的检测不准确。
诱导后时间点的NPM1 MRD评估
多项大型前瞻性临床试验已经证明了在早期时间点通过 RT-qPCR 测量的 MRD 的预后效果,尽管研究之间定义高危组的精确临界值不同。在德国 AMLSG 0704 研究中,第2周期后 BM 中达到 MRD 阴性的患者的4年累积复发率 (CIR) 为6% vs 53%,4年 OS 为90% vs 51%。随后的 AMLSG 0909 研究报告了第2周期后 BM MRD 阴性的4年 CIR 为25% vs 38%(n=370),还显示了 PB MRD 阴性的预后影响(4年 CIR 为18% vs 53%,n=341);该研究还确定 PB 和 BM 的3个对数减少具有预后重要性。法国 ALFA 0702 研究发现,第1周期后 PB MRD 降低>4个对数是预后的最强预测性(3年 CIR 为21% vs 66%,3年 OS 为92% vs 41%)。最后,英国 NCRI AML17 研究报告,第2周期后的 PB MRD 状态具有最强的预后影响(3年CIR 28% vs 83%,3年OS 77% vs 25%)。因此,尽管明确具有预后价值,但仍需要进一步的工作来确定最能预测不良预后的统一阈值。
NPM1 MRD 监测在接受维奈克拉为基础的非强化治疗的患者中具有很强的预后价值。特别是,在第4周期结束时达到 BM MRD 阴性的患者的2年 OS 为84%,而如果 MRD 阳性则为46%。在多变量分析中MRD阴性是最强的预后因素。
NPM1 突变 AML 表现出 CD33 的高表达和对gemtuzumab ozogamicin (GO) 的良好反应。在ALFA-0701 研究中,与未接受 GO 治疗的患者相比,接受 GO 治疗的 NPM1 突变患者在多个时间点的 MRD 缓解更深。在 AMLSG 09-09 研究中也观察到了相同的结果,该研究还显示接受 GO 治疗的患者的4年 CIR 较低且无复发生存期 (RFS) 较高。
治疗结束时NPM1 MRD评估
尽管治疗结束时 MRD 阳性与复发风险增加相关,但其中部分患者将保持长期缓解,部分患者甚至在未接受进一步治疗的情况下转化为CRMRD-。持续性 NPM1 突变的分子检测与携带突变等位基因的细胞类型明显无关。因此至少对于部分NPM1 突变转录本持续低表达的患者来说,残留的 NPM1 突变细胞可能包括至少一个无法驱动复发的亚群。这与治疗后 MRD 阳性样本的免疫组化显示终末分化单核细胞成分和成熟巨核细胞伴 NPM1 细胞质表达的观察结果一致,这些分化的细胞类型有助于测量突变的 NPM1 转录本,但可能与复发风险无关。因此,治疗结束时 MRD 阳性不应自动触发进一步治疗。
在英澳的一项研究中,治疗结束时可检测到 NPM1 突变转录本的患者中有42%在一年时仍保持无进展状态,其中30%自发实现分子学阴性。进展的风险因素包括基线 FLT3 ITD 和 MRD 较诊断降低<4.4个对数;同时存在这2个因素的患者93%在1年内复发并死亡。AMLSG 0704 研究确定了20拷贝/104 ABL 的阈值,对复发的特异性为100%;但是该阈值在 AMLSG 0909 研究中的特异性似乎较低(4年CIR 67%)。因此目前仍需要努力确定统一的干预阈值。这里一个主要的问题在于,可能会过度治疗非复发患者的风险,但MRD阳性必须及时进行更密切的监测(例如每4-6周一次),以便在 MRD 复发时进行干预。
移植前NPM1 MRD评估
虽然许多研究表明移植前 MRD 与不良预后密切相关,但很少有研究专门在 NPM1 突变AML 中研究这一点。MRD与预后之间的关系似乎更为复杂,受到 MRD 水平和 FLT3 突变状态的影响。在 NCRI AML17 研究 (n=107) 中,PB中200拷贝/105 ABL 或 BM 中1000拷贝的阈值可定义预后较差的组(3年OS 13%)。在一项德国研究中确定了相同的 BM 阈值(n=67,5年OS 40% vs 89%)。在 AML17研究中,基线时低于该水平的 MRD 阳性和 FLT3 ITD 阴性患者的预后与 MRD 阴性患者相同(2年 OS 率为82%),而基线时存在 FLT3 ITD 患者的预后较差(2年 OS 率为17%)。使用基于敏感 NGS 的 FLT3 ITD MRD 分析法进行的一项后续研究进一步对患者结局进行分层:移植前样本中检测,仅 NPM1 MRD-、仅 NPM1 MRD+及NPM1和FLT3 ITD MRD+患者的2年 OS 率分别为82%、68%和25%。美国“Pre-Measure”研究也显示,移植前可检测到 NPM1 MRD 的患者预后较差(3年CIR 63% vs 22%,3年OS 35% vs 66%)。该研究使用基于基因组 DNA 的测定法和灵敏度较低的 PB 样本,支持阈值效应的概念,并证实了 FLT3 MRD 状态的额外预后影响(仅检测NPM1 MRD+和检测NPM1和FLT3 MRD+的患者,3年 CIR 分别为64%和75%,3年 OS 分别为40%和25%)。
清髓性预处理能否降低 NPM1 MRD 阳性患者的复发风险仍存在争议。在一项研究中,清髓性 HLA 半相合移植联合常规 T 细胞过继治疗,显示可显著降低累积复发率。评价在挽救治疗期间使用去甲基化药物加维奈克拉的研究也令人感兴趣,特别是因为 NPM1 突变AML 对该联合治疗特别敏感。
MRD复发的序贯监测
无论一线治疗方法和 MRD 状态如何,所有患者在治疗后的前2-3年内仍处于非常重要的复发风险中。序贯 MRD 监测可用于可靠识别即将复发的患者,以便进行抢先干预。然而不会复发患者的过度治疗仍是主要问题,因此提出了诊断 MRD 复发的严格标准。对于之前在>1份技术上足够的样本中检测过 MRD-的患者,需要两个连续样本来确认从 MRD-到MRD+的转换;否则的话需要在第二份样本中确认1个对数增加。
MRD 复发患者的最佳治疗仍不明确。虽然标准挽救性化疗似乎有效,MRD阴性率约为60%,但靶向治疗可提供毒性较低的替代治疗,且无需住院。MRD 靶向治疗(不包括急性早幼粒细胞白血病)的第一个例子是使用阿扎胞苷治疗分子学复发或 allo-HSCT 后分子学复发的 NPM1 突变 AML 患者(2期 RELAZA2 研究)。在后一项研究中,53例患者中的60%携带 NPM1 突变,31例 (58%) 患者达到 MRD 缓解,其中19例 (36%) 达到 MRD 阴性。值得注意的是,58%的患者在治疗开始后6个月时保持无复发,2年 RFS 为46%。
维奈克拉为基础的治疗方案也被应用于 MRD治疗,尤其是在 NPM1 突变 AML 中,它公认为是对维奈克拉反应的预测生物标志物。在小型回顾性研究中,维奈克拉联合阿扎胞苷或低剂量阿糖胞苷的分子阴性率为80-90%。基于这些发现,在 NPM1 突变 MRD 阳性适合 AML 患者中回顾性评价了维奈克拉+阿扎胞苷作为桥接至移植策略的超说明书联合治疗。中位2个周期后,9/11例患者 (81.8%) 达到 MRD 阴性CR。所有11例患者均进行了allo-HSCT;10/11例患者存活,9/10例患者处于 MRD 阴性状态。
在基线 FLT3 突变患者中进行的一项回顾性研究显示,60%的患者对 FLT3 抑制剂产生分子应答(MRD降低>1个对数),45%的患者 MRD 阴性。FLT3 ITD NGS MRD 可识别更可能缓解的患者。对于 allo-HSCT 后 MRD 复发的患者,供体淋巴细胞输注 (DLI) 可为根除 MRD 提供额外的选择,有证据表明针对突变 NPM1 蛋白来源的表位免疫应答。
MRD 复发可能为新型靶向药物的早期评价提供极为有用的环境,而历史上的早期研究通常在明显复发的患者中开展。MRD 复发的主要潜在优势包括通常基线造血功能正常(消除疾病与治疗相关血液学毒性和感染的去卷积[deconvoluting]困难)和基线疾病负荷较低(降低克隆演变或其他适应性治疗耐药的机会)。此外,序贯 MRD 监测可为疗效评价提供了一种快速、客观和高灵敏度的方法。预计将有开发新的靶向药物和免疫治疗的研究,以在未来几年利用这些优势。
参考文献
Falini B,Dillon R.Criteria for diagnosis and molecular monitoring of NPM1-mutated AML.Blood Cancer Discov . 2023 Nov 2. doi: 10.1158/2643-3230.BCD-23-0144.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












