生信科研小白想发文?绝非难事儿!一文学会「肿瘤预后」研究套路!
2022-07-06 Catherine MedSci原创
这是一款经典的肿瘤预后研究套路,值得借鉴,让我们一起看看吧。
今天给大家带来一篇肿瘤预后相关的纯生信文章, 题目为Development and validation of a hypoxia-related gene signature to predict overall survival in early-stage lung adenocarcinoma patients. 这是一款经典的肿瘤预后研究套路,值得借鉴,让我们一起看看吧。

一、研究背景
肺腺癌(LUAD)是非小细胞肺癌(NSCLC)最常见的亚型。目前,个体 LUAD 患者的治疗决策主要基于患者和癌症特异性因素,例如肿瘤-淋巴结转移 (TNM) 分期和分化等级。然而,预后的预测能力和准确性往往不足。除了传统策略外,迫切需要为早期 LUAD 寻找更准确的预测因子,以区分可能受益于全身治疗的高风险亚群。
肿瘤晚期中的缺氧环境是氧气供应减少和氧气需求增加之间失衡的结果,后者被广泛认为与抗药性有关。目前还没有基于缺氧用于早期高危患者筛查的方法。
在这项研究中,作者不仅将癌症的各种标志中的缺氧确定为相对早期(p期I 和 II 期)LUAD 总体存活的主要风险因素,而且还结合了不同的方法来筛选稳健的生物标志物并建立用于预后的缺氧相关基因特征。此外,我们在四个独立队列中验证了基因特征的预后价值。最后,开发了一个基于基因特征和临床病理学特征的综合模型,以提高预测能力和准确性。
二、研究思路及数据来源
研究思路大致为:单样本基因集富集分析(SsGSEA)→缺氧相关基因预后signature筛选→预后模型构建与验证→HRS与临床病理特征分析→结合临床病理特征构建决策树及诺模图
文章的数据是从GEO数据库获取1072名符合早期(I-II期)标准的LUAD患者的RNA-Seq数据和临床信息,将数据集分为训练集和验证集;
从癌症基因组图谱(TCGA)获取389名符合早期(I-II期)标准的LUAD患者的RNA-Seq数据和临床信息,作为外部验证集。
三、研究方法及结果
1、缺氧是早期LUAD总体生存的主要危险因素
基于RNA-Seq数据和分子签名数据库(MSigDB)中的标记基因集,通过单样本基因集富集分析(SsGSEA)来量化训练集中癌症特征(如缺氧、细胞周期、信号通路、上皮-间充质转化、血管生成、细胞凋亡等)的ssGSEA评分。再通过ssGSEA评分和患者生存信息的Cox回归分析评估不同癌症特征在早期LUAD中的显著性。结果发现,与其他癌症特征相比,缺氧对存活率的影响最大。接下来,作者基于缺氧ssGSEA的评分将训练集中样本分为高低评分组。生存分析发现高评分组的总体存活率较低。
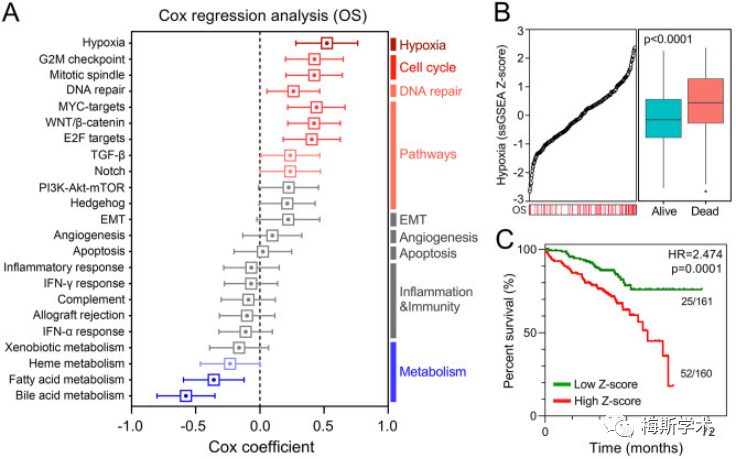
2、建立用于预后的缺氧相关基因标记
作者通过WGCNA分析筛选出与缺氧ssGSEA评分相关性最高的基因模块,并从中提取出HUB基因。接下来,利用COX回归分析确定了16个对预后影响最大的基因作为影响预后的缺氧相关基因(hypoxia-related gene Signature,HRS)。最后,基于筛选到的signatures构建早期肺腺癌患者预后模型。

3、HRS可作为早期LUAD患者总体生存的风险因素
接下来,作者对HRS是否可作为早期LUAD患者预后生存的独立风险因素进行了探究。首先,利用MSigDB中的低氧基因集,GSEA分析证实了高HRS组与低HRS组相比处于低氧状态。然后发现,与活着的患者相比,随访期间死亡的患者的风险评分显著升高。接下来,生存分析显示,HRS越高,预后越差。最后,基于各种临床病理特征,多因素Cox回归模型发现HRS是总存活率最准确的预测因子。为了证实缺氧相关基因签名预测的稳健性,作者在四个独立的数据集中进行验证。在验证集中的分析得到了类似的结果。

4、HRS既是预后较差的指标,也是潜在的治疗耐药的有效标志物
将训练集和验证集数据合并,将1369例患者分成HRS高低两组。Meta分析显示,HRS高的患者比HRS低的患者预后差。

已有研究表明,缺氧会导致肿瘤对治疗的抵抗力,因此,作者进一步探究了HRS是否可作为治疗耐药的标志物。GSEA分析表明,高HRS与不同疗法(包括化疗、放射治疗和训练组中的靶向治疗)的抵抗力显著相关。landscape图和气泡热图显示,在LUAD细胞系中,基因表达与药物反应IC50有显著的相关性。S100A2、PACS1和PPARD表现为耐药,PDIK1L、TXLNG和ELAC1表现为药敏。随后,作者又用来自TCGA的治疗信息和临床数据进行验证。结果发现,HRS较高的患者预后生存较差。

5、HRS结合临床病理特征进一步改善风险分层和生存预测
采用年龄、性别、TNM分期和HRS四个临床病理参数构建决策树,结果显示决策树中只剩下TNM分期和HRS,确定了三个不同的风险亚组。Kaplan-Meier生存曲线表示,三个风险亚组之间的总体存活率有显著差异。
为了量化早期LUAD患者的风险评估和生存概率,作者结合HRS和其他临床病理特征,建立了一个诺模图。校准分析发现诺模图的准确度很高,与其他指标相比,诺模图对生存的预测能力最强、最稳定。
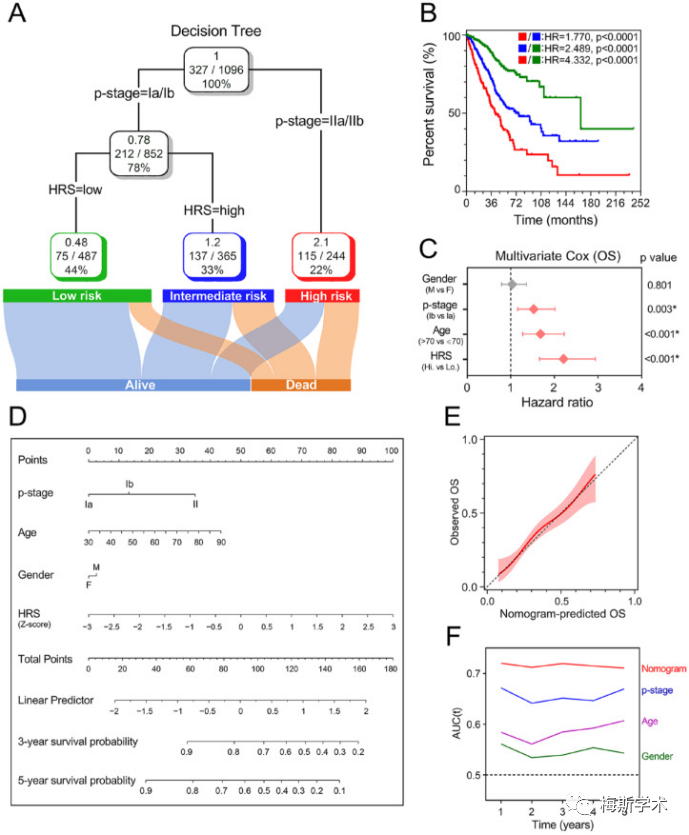
四、总结
在该研究中,作者建立了一种新的缺氧相关基因特征来区分早期 LUAD 的高危患者。将其与临床病理学特征相结合,构建了一个决策树来优化总体生存的风险分层,并构建了一个列线图来量化个体患者的风险评估。基于缺氧基因特征的模型可以成为选择可能从辅助治疗中受益的高风险早期患者的有用工具,从而促进 LUAD 的个性化管理。
本研究也存在一些局限性:首先,这是一项回顾性研究,因此缺氧相关基因特征的预后稳健性和临床实用性需要在更大的前瞻性试验中进一步验证。其次,需要进一步的实验研究来阐明 LUAD 基因特征背后的肿瘤缺氧相关生物学功能。
梳理一下本篇文章的研究思路:首先SsGSEA分析量化与肿瘤相关通路的ssGSEA评分,再以ssGSEA评分为表型通过WGCNA分析挖掘与关注通路相关的基因,接下来就是预后模型的常规套路了(筛选出与预后相关的signature,构建预后模型,预后模型验证,风险评分与临床病理的相关性分析)。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#期刊论坛##学习#
102
不错的文章
112
学习到了
93
好文章,谢谢分享。
77