mBio:单纯疱疹病毒诱发铁死亡及病毒性脑炎的机制
2022-12-25 “生物世界”公众号 “生物世界”公众号 发表于上海
铁死亡是2012年由哥伦比亚大学 Brent. R. Stockwell 实验室发现的一种新型细胞程序性死亡方式,依赖于铁介导的脂质自由基的形成和积累。
众所周知,多细胞生物在发育过程中,存在着多种预定的、受到精确控制的细胞程序性死亡,例如细胞凋亡(Apoptosis)、程序性坏死(Necroptosis)、细胞焦亡(Pyroptosis),以及铁死亡(Ferroptosis)等。
铁死亡是2012年由哥伦比亚大学 Brent. R. Stockwell 实验室发现的一种新型细胞程序性死亡方式,依赖于铁介导的脂质自由基的形成和积累,其形态特征,作用方式以及分子机制与其他程序性死亡方式截然不同。
近日,中国科学院武汉病毒研究所病毒学国家重点实验室研究员周溪、邱洋团队,广州市妇女儿童医疗中心教授徐翼团队以及厦门大学教授林树海团队合作,在 mBio 上发表了题为:Herpes Simplex Virus 1-Induced Ferroptosis Contributes to Viral Encephalitis 的研究论文。
该研究首次证实单纯疱疹病毒1型(HSV-1)可以诱发铁死亡,并揭示HSV-1诱发铁死亡的分子机制及铁死亡在病毒性脑炎中的作用。

在这项研究中,研究团队发现HSV-1感染人的神经胶质细胞和小鼠脑部组织后可以检测到铁死亡的特异性指标,从而证明HSV-1可以诱发铁死亡;发现HSV-1通过降解Nrf2蛋白,抑制下游抗氧化基因,从而扰乱细胞氧化还原稳态,促进铁死亡的发生的机制。研究团队进一步深入探究了HSV-1抑制Nrf2的分子机制,发现HSV-1通过泛素化-蛋白酶体途径降解Nrf2表达,其泛素化途径依赖于Keap1蛋白,并确定此泛素化类型是K48泛素化。
此外,研究团队在HSV-1小鼠脑炎模型中确定了HSV-1诱发的铁死亡与病毒性脑炎的发生过程密切相关,使用铁死亡抑制剂(Fer-1)或蛋白酶体抑制剂(MG132)抑制Nrf2表达可以有效地抑制HSV-1型脑炎的发生;同时,铁死亡引发HSV-1型脑炎的机制是通过激活PTGS2/PGE2通路,使用PTGS2抑制剂(IND)可以有效抑制HSV-1导致的多种炎性因子表达。该研究阐述了HSV-1诱发铁死亡的分子机制,为HSV-1型脑炎的发病机制提供了新的见解。
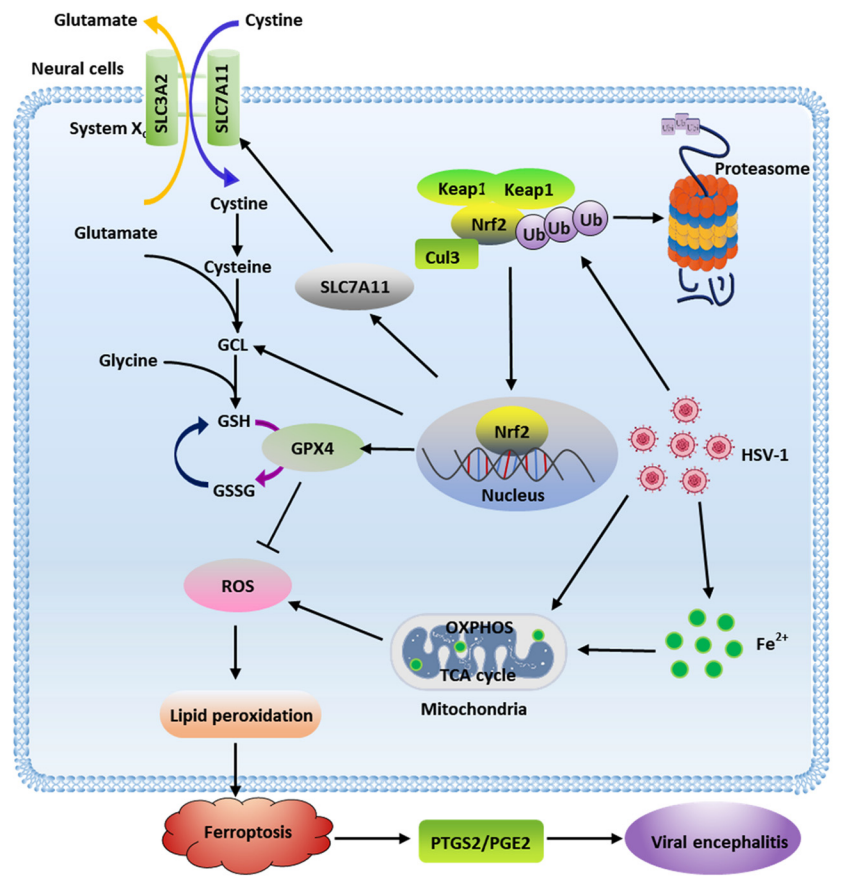
HSV-1诱发铁死亡导致病毒性脑炎的机制研究
原始出处:
Xi-Qiu Xu, Tongran Xu, Wenting Ji,et al. Herpes Simplex Virus 1-Induced Ferroptosis Contributes to Viral Encephalitis. mBio, 2022.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言