BLOOD:侵袭性B细胞淋巴瘤CD19 CART治疗失败后的结局,来自法国DESCAR-T登记研究
2022-09-27 聊聊血液 聊聊血液
CD19 CAR T细胞疗法是复发/难治性侵袭性 B 细胞非霍奇金淋巴瘤(R/R侵袭性BCL)患者治疗的主要治疗进展。在关键研究和真实世界经验中均观察到有价值的缓解率。然而CAR T 细胞治疗后的失败
CD19 CAR T细胞疗法是复发/难治性侵袭性 B 细胞非霍奇金淋巴瘤(R/R侵袭性BCL)患者治疗的主要治疗进展。在关键研究和真实世界经验中均观察到有价值的缓解率。然而CAR T 细胞治疗后的失败仍然是一个主要障碍,存在未满足的医疗需求。
在 JULIET 研究中,近60%的患者在 CAR T 细胞输注后6个月进展;ZUMA 1和 TRANSCEND 研究显示,约50%的患者在6个月时复发;这些数据在多个真实世界研究中也得到证实。Pasquini 等报告了 tisagenlecleucel(tisa-cel) 治疗后6个月失败率为60%;Nastoupil等报道,axicabtagene ciloleucel(axi-cel)输注后失败率约为45%;Bethge 等报告,在6个月时26%的患者出现疾病进展、64%的患者复发;Kwon 等报告,约30%的患者在 CAR T 细胞治疗后失败;Iacoboni 等报告,12个月时复发率约为70%;在一项多中心法国研究中,超过半数的患者在 CAR T 细胞治疗后6个月失败。
DESCAR-T 登记研究是 LYSA/LYSARC 设计的法国国家登记研究,旨在收集 CAR-T 细胞输注后15年内商业 CAR-T 细胞(axi-cel和tisa-cel)的真实世界数据。从2018年8月到2021年4月,DESCAR-T已登记了680例R/R侵袭性B细胞淋巴瘤(BCL)患者。
法国Catherine Thieblemont教授牵头分析了在 DESCAR-T 中登记的 CAR T 细胞输注后进展/复发的患者的结局,并确定该人群的预后标志物和 CAR-T 后的治疗选择,深入研究了复发时的治疗策略与 CD19 CAR T 失败后结局之间的关系。结果近日发表于《BLOOD》。
患者
从2018年8月至2021年4月12日,DESCAR-T登记研究连续登记了680例R/R侵袭性BCL患者,其中550例在分析时接受了输注,患者接受axicabtagene-ciloleucel(axi-cel,n=350)或tisagenlecleucel(tisa-cel,n=200)治疗。
中位随访7.9个月后,312例患者未进展,包括完全缓解 (CR,n= 181;58%)、部分缓解 (PR,n = 35;11%) 或疾病稳定 (SD,n = 3;1%);其余238例(43.4%)患者在接受CD19 CAR T 细胞治疗后出现疾病进展/复发,是本分析的目标人群:136例患者在 axi-cel 治疗后出现疾病进展/复发(中位随访时间9.0个月),102例患者在 tisa-cel 治疗后出现疾病进展/复发(中位随访时间7.8个月)。人口统计学特征总结见表1。
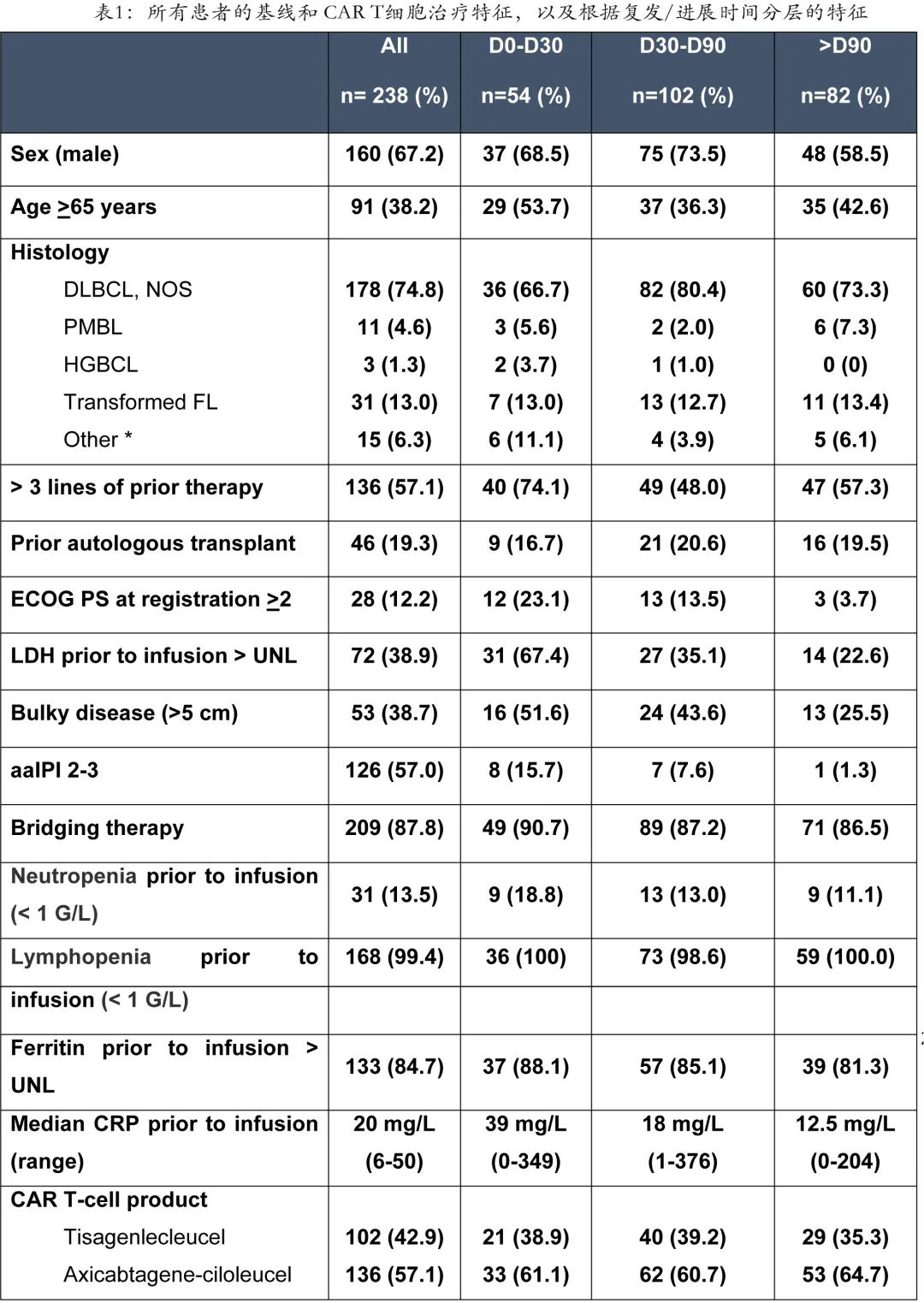
在决定治疗时/清淋前,大多数患者 (n= 178,74.8%) 为弥漫大 B 细胞淋巴瘤 (DLBCL) aaIPI 2-3的比例高(n = 126,57.0%),并且多数(n= 136,57.1%)在 CAR T 治疗前接受了超过3线治疗,既往移植患者48例 (20.1%)(自体造血干细胞移植46例,异基因造血干细胞移植2例)。209例 (87.8%) 接受了桥接治疗,包括常规免疫化疗176例 (84.2%),较轻方案(皮质类固醇、单克隆抗体不伴化疗)24例 (11.5%),放疗9例 (4.3%)。输注时有138例患者 (66%) 出现 PET 扫描确定的疾病进展 (PD),72例患者 (38.9%) 的 LDH 水平升高。
在238例 CAR T 细胞治疗后复发/疾病进展的患者中,54例患者 (22.7%) 是在第30天前复发(极早期),102例患者 (42.9%) 为早期 (D31-D90) 进展/复发,82例患者 (34.5%)为晚期 (> D90) 进展/复发。CAR T治疗后失败的中位时间为2.7个月。
CAR T失败时的治疗及其缓解
为进一步描述 CAR T 细胞治疗后复发/进展患者的治疗特征,作者分析了后续的治疗和类型。在238例CD19 CAR T 治疗后失败的患者中,154例患者 (64.7%) 的新治疗线数据可用:59例患者 (38.3%) 接受来那度胺单药治疗或联合治疗,11例患者 (7.1%) 接受双特异性抗体治疗,33例患者 (21.4%) 接受靶向治疗,17例患者 (11%) 接受放疗,31例患者 (20%) 接受不同联合方案(R-DHAX、R-ICE、Pola-R-Benda等)免疫化疗(表2)。值得注意的是,治疗失败时接受 axi-cel 的患者 (n= 136) 在 D30 和 D90 的3/4级血细胞减少发生率高于接受 tisa-cel 的患者 (n= 102)(p< 0.001),而D30 时的血细胞减少不影响后续治疗的选择(p= 0.812)。
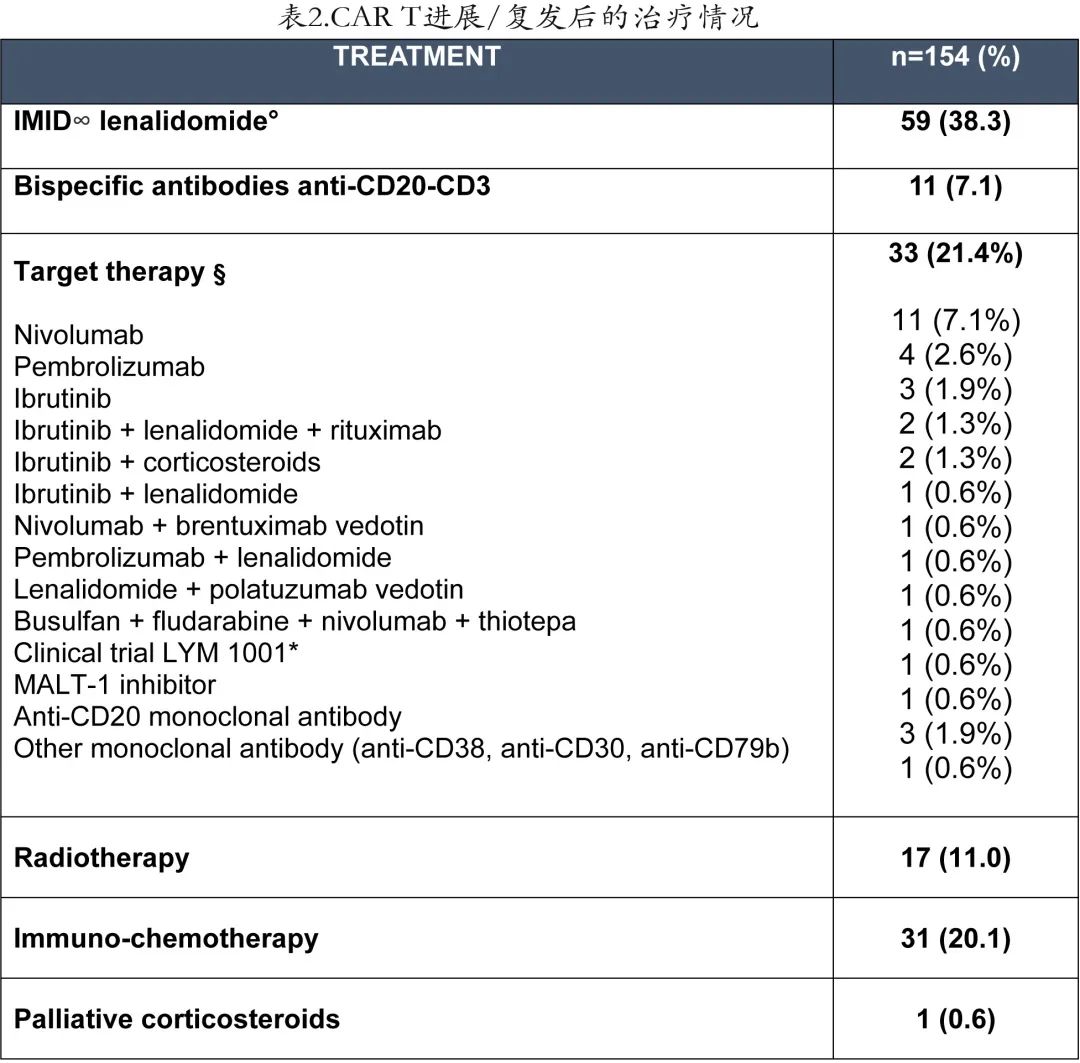
154例 CAR T 治疗后复发/进展的患者中,120例 (77.9%)患者可评估缓解,其中14.1%的患者 (17/120) 中观察到总体缓解 (CR + PR),CR率为6.6%(8/120),PR率为7.5%(9/120),另有0.8%(1/120) 的患者SD,70.8%(85/120) 的患者显示疾病进展为最佳缓解。
CAR T治疗失败后不同治疗类型的疗效结局
作者进一步分析了 CAR-T 复发后的缓解率和生存结局,并按类别对治疗进行分组(图1)。
 双特异性抗体、来那度胺、靶向治疗和免疫化疗治疗后的中位 PFS-2 分别为3.7个月、3.8个月、2.1个月和2.4个月,不同治疗策略未发现统计学显著优势 (p= 0.104)。接受双特异性抗体、来那度胺、靶向治疗和免疫化疗的患者的中位 OS-2 率分别为8.5个月、7.5个月、4.5个月和3.7个月 (p= 0.32)。放射治疗仅适用于出现局部病变的患者 (n= 12),中位 PFS-2 为3.7个月,中位 OS-2 为9.6个月。
双特异性抗体、来那度胺、靶向治疗和免疫化疗治疗后的中位 PFS-2 分别为3.7个月、3.8个月、2.1个月和2.4个月,不同治疗策略未发现统计学显著优势 (p= 0.104)。接受双特异性抗体、来那度胺、靶向治疗和免疫化疗的患者的中位 OS-2 率分别为8.5个月、7.5个月、4.5个月和3.7个月 (p= 0.32)。放射治疗仅适用于出现局部病变的患者 (n= 12),中位 PFS-2 为3.7个月,中位 OS-2 为9.6个月。
结局
在接受 CAR T细胞治疗的总体患者人群中,中位 PFS 为4.6个月(6个月 PFS 为44.5%)。550例治疗患者中356例响应患者的中位 DOR 为11.1个月(6个月时 DOR 为57.7%)。
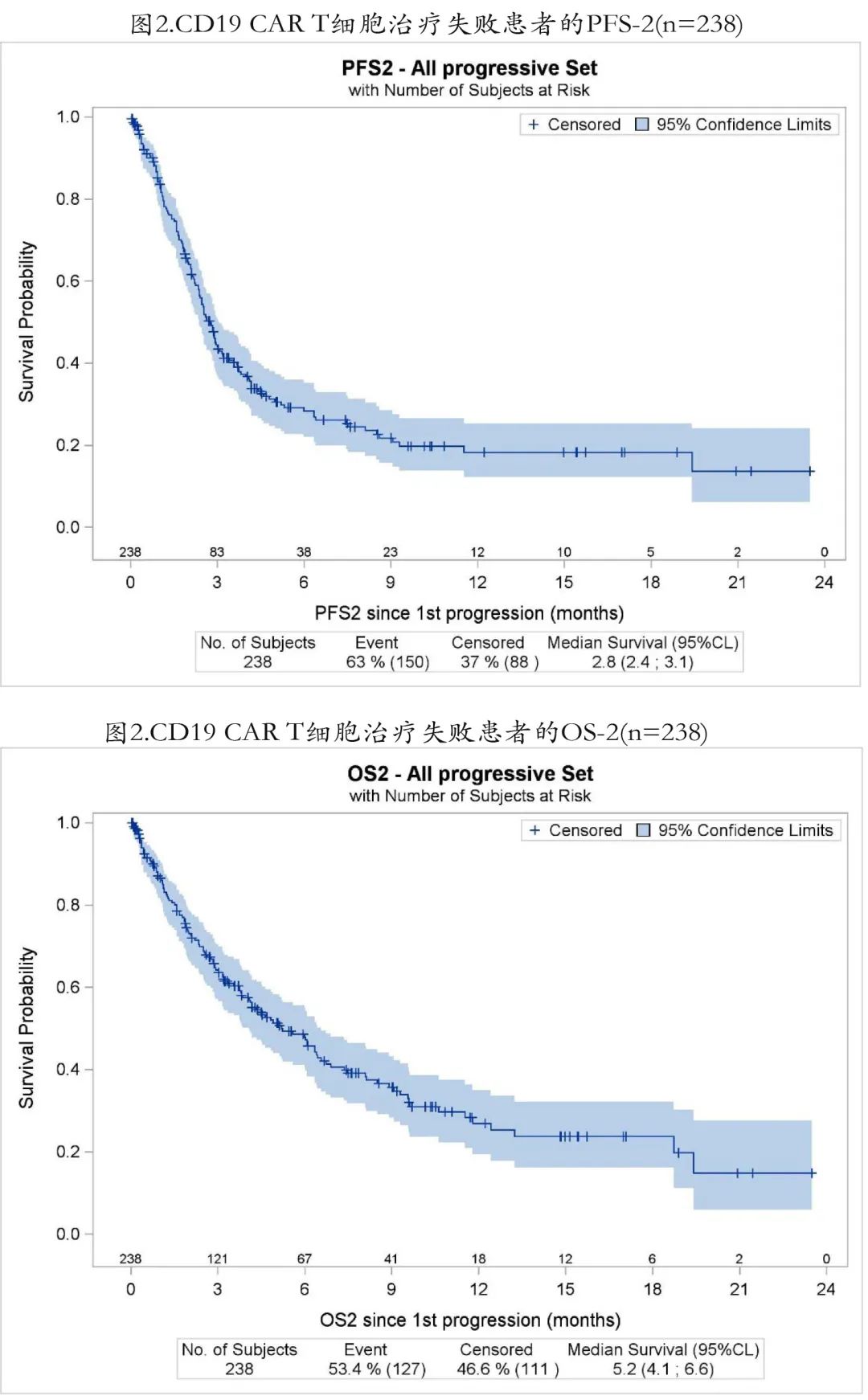
对于失败的238例患者,自 CAR T 细胞输注后复发/进展计算的PFS-2为2.8个月;6个月和12个月时分别有71.6%和81.8%的患者发生进展/复发(图2);CAR T细胞输注后复发/进展后的OS-2同样始终较差,中位仅5.2个月;6个月时仅47.9%的患者存活,12个月时26.9%的患者存活(图3)。
作者还根据CAR T治疗失败时间分析了 CAR T 细胞输注后复发/进展时间的 PFS-2 和OS-2:极早期进展/复发患者的中位 PFS-2 为1.7个月,D31-D90失败患者为2.6个月 (p< 0.0001),D90后复发患者为4.2个月(图4)。同样,极早期进展/复发患者的中位 OS-2 为1.9个月,而 D31-D90 期间 CAR T 细胞治疗失败患者的中位 OS-2 为6.1个月(p< 0.0001),D90 后复发的患者的中位 OS-2 为9.6个月(图5)

预后因素
在单变量模型中,与PFS-2较差显著相关的因素包括,输注时高LDH(p< 0.0001,HR= 2.66)、输注时ECOG PS≥2 (p= 0.0067,HR= 1.94)、极早期进展 (D0-D30,p= 0.0002,HR= 1.98) 和输注时 CRP 和铁蛋白水平异常(CRP:p= 0.0187,HR= 1.03;铁蛋白:p= 0.0002,HR= 1.01);而CAR T 后的治疗类型与 PFS-2 无显著相关性:双特异性抗体(p= 0.07,HR= 0.45)、来那度胺 (p= 0.10,HR= 0.66) ,靶向治疗 (p= 0.8,HR= 0.95)。
与 OS-2 较差相关的因素包括,高LDH(p< 0.0001,HR= 2.66)、输注时ECOG PS≥2 (p= 0.0008,HR= 2.37)、极早期进展 (D0-D30,p< 0.0001,HR= 2.59)、输注时 CRP 和铁蛋白水平异常(CRP:p= 0.0006,HR= 1.05;铁蛋白:p= 0.0002,HR= 1.01);CAR T 后的治疗类型同样与OS-2无显著相关性:双特异性抗体 (p= 0.2,HR= 0.51)、来那度胺 (p= 0.06,HR= 0.60) ,靶向治疗 (p= 0.7,HR= 0.91)。
多变量分析中,与较差 PFS-2 相关的因素包括输注时 LDH 较高 (p< 0.0001,HR= 3.42) 和输注时铁蛋白水平异常 (p= 0.01,HR= 1.02)(表3);CAR T后的治疗类型与 PFS-2无显著相关性:双特异性抗体(p= 0.98,HR = 未达到)、来那度胺 (p= 0.07,HR= 0.55,具有改善的趋势) ,靶向治疗 (p= 0.3,HR= 0.69)。

OS-2 的多变量分析确定了以下与较差结局相关的因素(表3):高LDH (p= 0.01,HR= 2.10)、CRP升高 (p= 0.003,HR= 1.11)、极早期进展 (D0-D30,p= 0.0009,HR= 2.93)。CAR T 后的部分治疗类型与OS-2无显著相关性:双特异性抗体 (p= 0.15,HR= 0.22) 或靶向治疗 (p= 0.078,HR= 0.47),但来那度胺治疗与OS-2 更优显著相关 (p= 0.01,HR= 0.42)。
讨论
CD19 CAR T细胞疗法R/R 侵袭性 BCL 治疗的重要突破,但输注后失败也很常见,在关键临床研究和真实世界报道中的复发率高达66%。高复发风险患者的特征包括总代谢肿瘤体积、LDH、PS、CD19状态等,此外CAR T 细胞产品的特性,如动力学、剂量与肿瘤内在因素也有影响。
本 DESCAR-T 登记研究证实,CAR T细胞治疗后失败患者的结局仍然极差,并且如果在第一个月内失败则结局更差。替代治疗策略(双特异性抗体,来那度胺)可改善这些患者的 PFS 率。总的来说,CD-19 CAR T 细胞治疗后失败的 R/R 侵袭性 BCL 患者仍存在未满足的医疗需求,需要进一步的创新策略来改善此类患者的结局。
参考文献
Roberta Di Blasi,et al. Outcomes of patients with aggressive B-Cell lymphoma after failure of anti-CD19 CAR T-Cell Therapy: A DESCAR-T analysis. Blood . 2022 Sep 19;blood.2022016945. doi: 10.1182/blood.2022016945.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言