JACS:ABPP平台助力发现靶向蛋氨酸的CDK4共价抑制剂
2022-12-17 精准药物 精准药物 发表于上海
针对特定氨基酸残基的共价小分子及探针能够帮助发现新的药物并提供作用机制的信息,目前这种基于活性的蛋白质组分析技术中使用的探针大多针对亲核性的半胱氨酸、赖氨酸、谷氨酸/天冬氨酸等。
大家好,今天分享一篇发表在JACS上的文章An Activity-Based Oxaziridine Platform for Identifying and Developing Covalent Ligands for Functional Allosteric Methionine Sites: Redox-Dependent Inhibition of Cyclin-Dependent Kinase 4。通讯作者是来自美国UC Berkeley化学系的F. Dean Toste教授和Christopher J. Chang教授。

针对特定氨基酸残基的共价小分子及探针能够帮助发现新的药物并提供作用机制的信息,目前这种基于活性的蛋白质组分析技术中使用的探针大多针对亲核性的半胱氨酸、赖氨酸、谷氨酸/天冬氨酸等。本文作者此前则开发过针对蛋氨酸的生物共价偶联标记方法——氧化还原激活化学标记ReACT,通过使用氧氮环丙烷在生理pH值下对蛋氨酸进行标记,这一平台极大帮助了针对蛋氨酸相关生物学问题的研究。在本文中,作者希望将ReACT以及ABPP策略结合使用来帮助寻找靶向特定关键蛋白的药物开发。
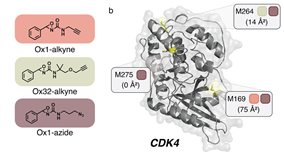

作者们选择在癌症药物治疗中关键蛋白CDK4作为研究对象。在CDK4纯蛋白上,三种ReACT试剂标记了不同的蛋氨酸,其中新发现的的高反应性M169和已知功能性磷酸化位点T172接近。接下来,作者们设计并合成了一组含有氧氮环丙烷的共179个成员的共价配体库,将它们在体外和CDK4处理后使用蛋氨酸探针Ox1-azide竞争,通过荧光信号来评价共价配体和CDK4的反应性。作者在其中发现了1oxF11这个配体,它以剂量依赖性的方式和CDK4结合并和探针产生信号竞争,但对CDK4的同系物CDK1/6的没有剂量依赖性的结合作用。
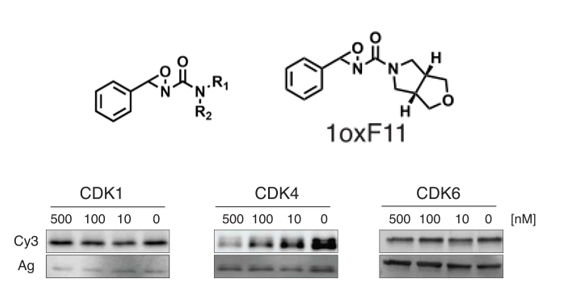
通过质谱实验,他们证明M169是最主要的1ox F11修饰位点,M264为次要修饰位点;而在活性上,1oxF11可以抑制CDK4的活性,M169L突变则导致IC50有所升高,说明1oxF11可以通过共价修饰M169来抑制CDK4活性、而M264则可能通过其他途径来影响活性。在细胞层面上,1oxF11导致MCF7细胞存活率下降,而M169突变会导致细胞对1oxF11处理敏感度下降。由于M169和细胞周期中关键磷酸化位点T172相邻,作者认为M169可能是细胞周期中的一种氧化还原开关。作者通过2D电泳分离pCDK4不同蛋白形式、用pCDK4-T172特异性抗体进行分析,从中发现1oxF11对M169的修饰可以通过阻止T172磷酸化来抑制CDK4活性,支持了上述观点。
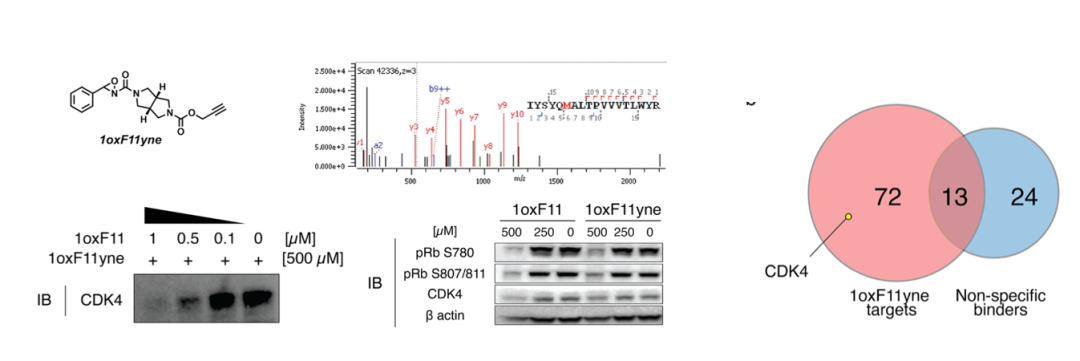
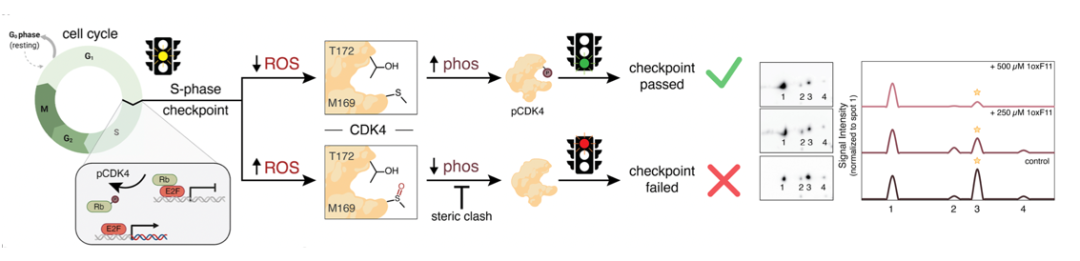
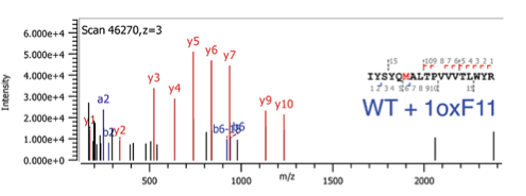
为了进一步研究1oxF11影响细胞存活的机理,作者们设计了1oxF11yne,发现1oxF11yne也修饰在CDK4 M169位,也可以如1oxF11一样抑制CDK4活性、降低其底物蛋白的磷酸化水平,其标记信号也可以被1oxF11竞争。使用1oxF11yne探针,作者进一步结合ABPP技术和还原二甲基化定量技术研究了其细胞内靶点,从中发现了包括CDK4在内的59个1oxF11yne靶标蛋白,可以用于后续进一步优化提高1oxF11对CDK4的选择性。
总之,文章作者发展了一种靶向蛋氨酸的ABPP平台,能够帮助发现新的功能性蛋氨酸位点并设计相关共价配体。利用这一平台,作者发现了靶向CDK4的1oxF11,能够通过修饰M169影响附近T172磷酸化,调节细胞周期。
本文作者:MYZ
责任编辑:Guo ZH
原文链接:https://pubs.acs.org/doi/10.1021/jacs.2c04039
原文引用:DOI:https://doi.org/10.1021/jacs.2c04039
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言