新型人源化BCMA CAR T细胞C-CAR088治疗RRMM的I期研究结果
2022-09-27 聊聊血液 网络
CAR T细胞疗法是血液肿瘤的重要突破,其中BCMA CAR T 细胞疗法在复发或难治性多发性骨髓瘤(RRMM) 患者中的总缓解率 (ORR) 可达85.2%,完全缓解 (CR) 率可达47.0%。
CAR T细胞疗法是血液肿瘤的重要突破,其中BCMA CAR T 细胞疗法在复发或难治性多发性骨髓瘤(RRMM) 患者中的总缓解率 (ORR) 可达85.2%,完全缓解 (CR) 率可达47.0%。C-CAR088 细胞是经过基因修饰的抗 BCMA 自体 CAR T 细胞,李建勇教授和邱录贵教授等评估了C-CAR088细胞疗法在氟达拉滨和环磷酰胺清淋后治疗 RRMM 患者的安全性和疗效,研究结果近日发表于《Journal for ImmunoTherapy of Cancer》,通讯作者为李建勇教授,第一作者为屈晓燕教授和安刚教授。

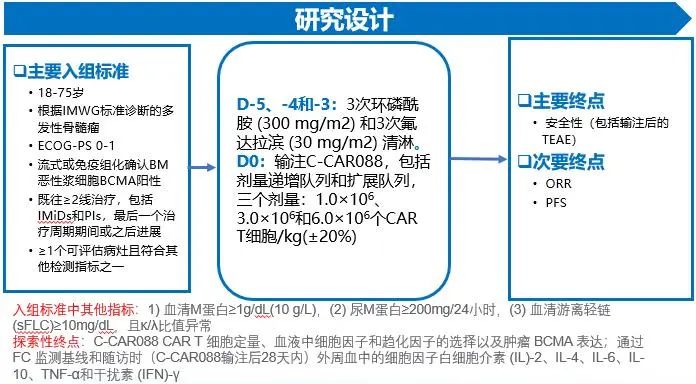
研究设计
靶向 BCMA 的第二代 CAR 的结构如图 1A 所示。本项为C-CAR088首次应用于人体的1期、单臂、开放标签、剂量递增和扩展研究,在中国4家临床中心(江苏省人民医院、中国医学科学院血液病医院、河北燕达陆道培医院、北京协和医学院)的 RRMM 患者中评价了 C-CAR088 的安全性和疗效。
研究结果
患者和疾病特征
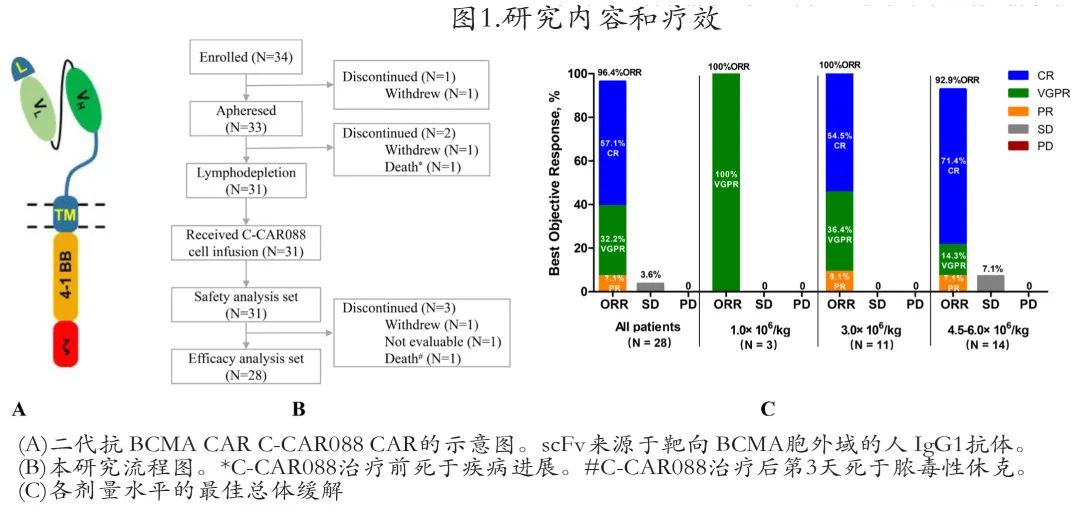
共筛选34例,其中31例患者接受了 C-CAR088 治疗(图1B)。基线患者和疾病特征见表1。
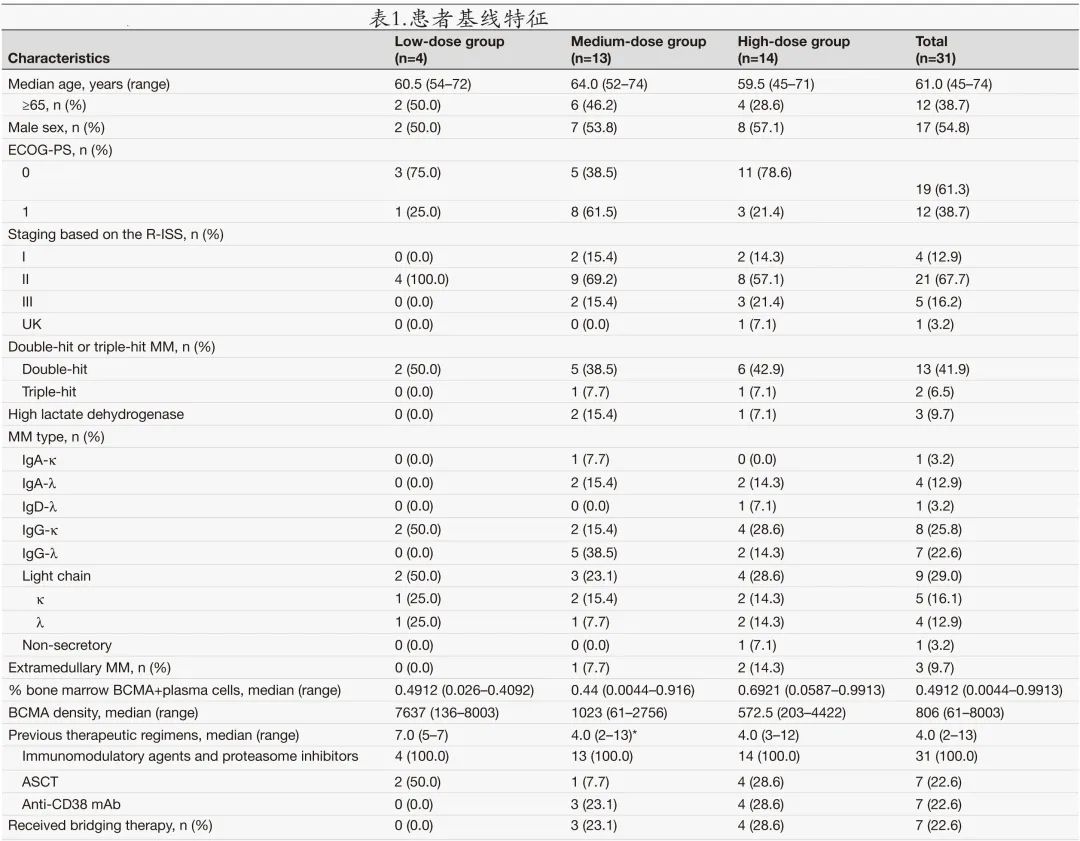
患者中位年龄为61岁,17例 (54.8%) 患者为男性,14例 (45.2%) 为女性;分别有19例 (61.3%) 和12例 (38.7%) 患者的 ECOG-PS 评分为0和1;分别有4例 (12.9%)、21例 (67.7%) 和5例 (16.2%) 患者为R-ISS I、II和 III 期;最常见的 MM 类型为IgG(15例,48.4%)、轻链型(9例,29.0%)、IgA(5例,16.1%)、IgD(1例,3.2%)和非分泌型(1例,3.2%);3例 (9%) 患者伴髓外病变,15例 (48.4%) 为双打击或三打击MM,定义为存在两种或三种高危基因异常,包括t(4;14)、t(14;16)、t(14;20)、del(17p) 和 p53 突变或 1q gain。
既往治疗线的中位数为4。所有31例 (100%) 患者既往均接受过免疫调节剂和蛋白酶体抑制剂,7例 (22.6%) 接受过ASCT,7例 (22.6%) 接受过抗 CD38 单抗治疗。7例患者在 C-CAR088 输注前接受了桥接治疗。基线时对30例 (96.8%) 患者的 BM 穿刺进行了分析,1例抽吸失败(干抽),28例患者在基线时 BM 中有异常浆细胞,1例患者有髓外病变。BCMA 阳性异常浆细胞的中位比例为49.12%,BM 中 BCMA 阳性恶性浆细胞的中位 BCMA 密度为836分子/细胞。
安全性
31例治疗患者中位随访时间为9.4个月,未观察到剂量限制性毒性。常见≥3级不良事件见表2。
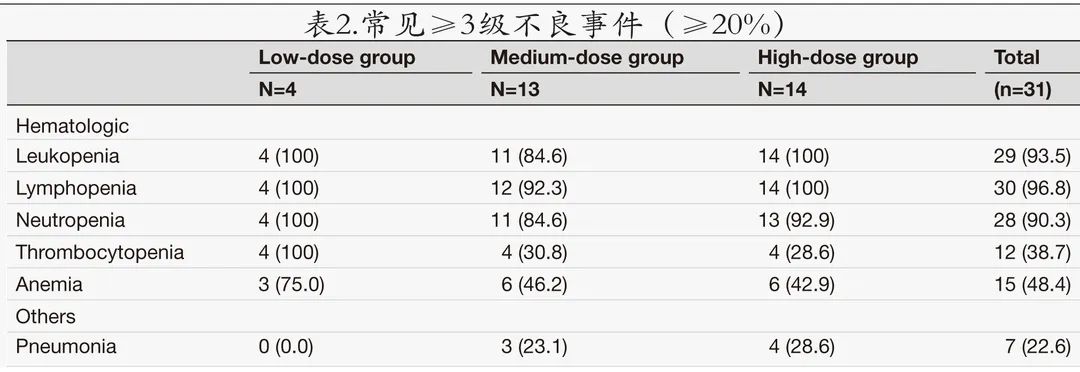
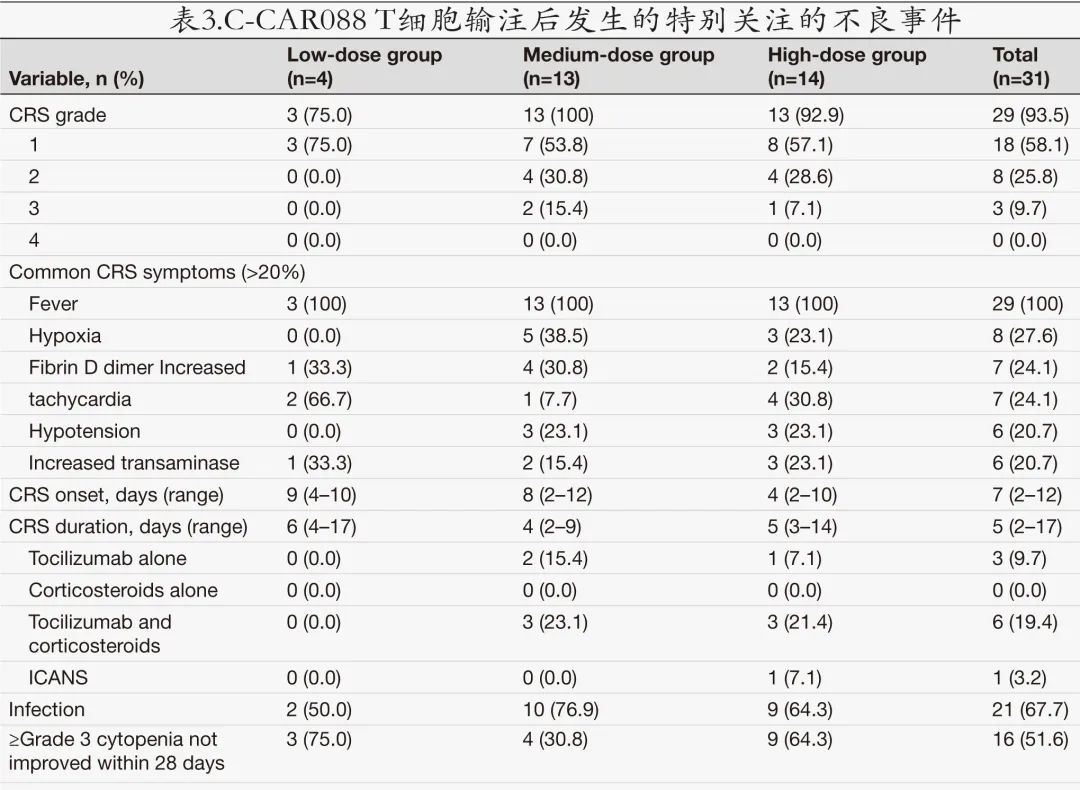
最常见的不良事件为血液学毒性,包括中性粒细胞减少(100%)、白细胞减少 (100%)、血小板减少 (90.3%) 和贫血 (83.9%)。清淋化疗的毒性作用符合预期。常见的≥3级不良事件主要为血液学毒性。16例 (51.6%) 患者出现长期血细胞减少,定义为治疗后28天未恢复的≥3级中性粒细胞减少或血小板减少。29例 (93.5%) 患者发生CRS,中位首发时间为6天,中位持续时间为5天;多数 CRS (26/31,83.9%) 为1-2级,3例 (9.7%) 为3级,无4级。最常见 (≥20%) 的 CRS 症状为发热 (29/29,100%)、低氧血症 (8/29,27.6%)、D-二聚体升高 (7/29,24.1%)、心动过速 (7/29,24.1%)、低血压 (6/29,20.7%) 和转氨酶升高 (6/29,20.7%)。高剂量组1例患者在治疗第8天出现1级ICANS,持续24 h,给予糖皮质激素治疗后痊愈。共3例 (9.7%) 患者使用托珠单抗单药,6例 (19.4%) 患者使用托珠单抗和皮质类固醇。发生感染21例 (67.7%)。具体安全性数据见表3。
临床疗效
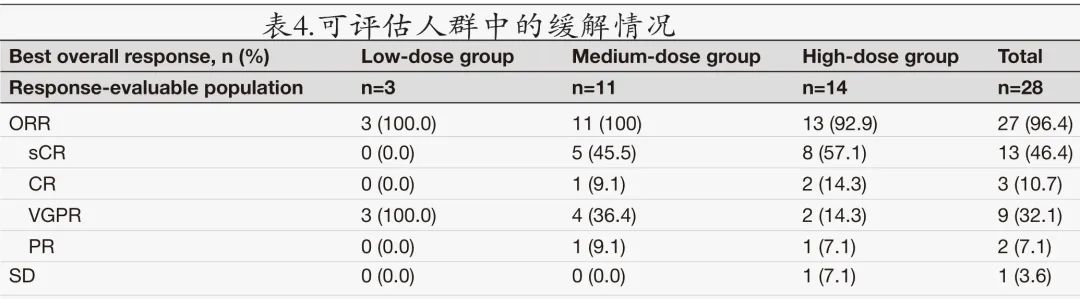
本研究在随访≥1个月的患者中的回输后第28天评估治疗应答。1例患者在第2周中止治疗,1例患者在 C-CAR088 输注后第3天死于霍乱弧菌感染引起的感染性休克,1例患者无法评估。
在28例可评估患者中,ORR为96.4%(13例sCR,3例CR,9例VGPR),且随着剂量增加,CR/sCR 率增加至高剂量组的71.4%(图1C,表4)。低剂量组3例 (100%) 患者的最佳缓解为VGPR;而中剂量组 (N = 11) 和高剂量组 (N = 14) 的 CR/sCR 率分别为54.5%和71.4%, ORR 分别为100%和92.9%。中位至 CR 时间为2.0个月。
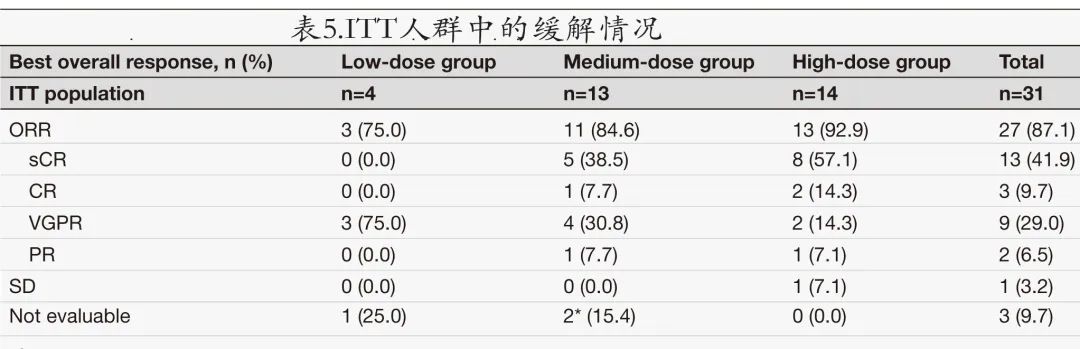
在意向治疗人群 (ITT,n = 31) 中,ORR为87.1%(13例sCR,3例CR,9例VGPR)(表5)。
在15例至少有2种高危基因异常的可评估患者中,ORR为93.3%(sCR、CR和 VGPR 分别为33.3%、13.3%和46.7%),其中13例患者接受中剂量或高剂量治疗,ORR为92.3%(sCR、CR和 VGPR 分别为38.5%、15.4%和38.5%)。此外2例三打击患者均获得CR(中剂量和高剂量组各一例)。
3.0–6.0 × 106/kg剂量队列中有7例 (22.6%) 患者在 C-CAR088 治疗前接受过抗 CD38单抗治疗,所有患者均对 C-CAR088 有反应,且4例 (57.1%) 达到sCR;此外在这些剂量队列中,既往接受或未接受抗 CD38单抗治疗的患者之间的PFS(HR= 1.39,p = 0.7) 和DOR(HR= 1.56,p = 0.6) 亦无显著差异。至截止日期,仅报告了1例死亡,因此没有足够的数据点来运行 OS 的 Cox 比例风险回归模型,但PFS、OS和DOR曲线趋势均表明,C-CAR088在两个患者组(既往接受或未接受抗 CD38单抗治疗)中疗效相似。
接受中等+高剂量的队列中位随访时间为9.5个月,12个月 PFS 和 OS 率分别为69.5%和94.4%,中位PFS、OS和DOR均未达到(图2A–C)。
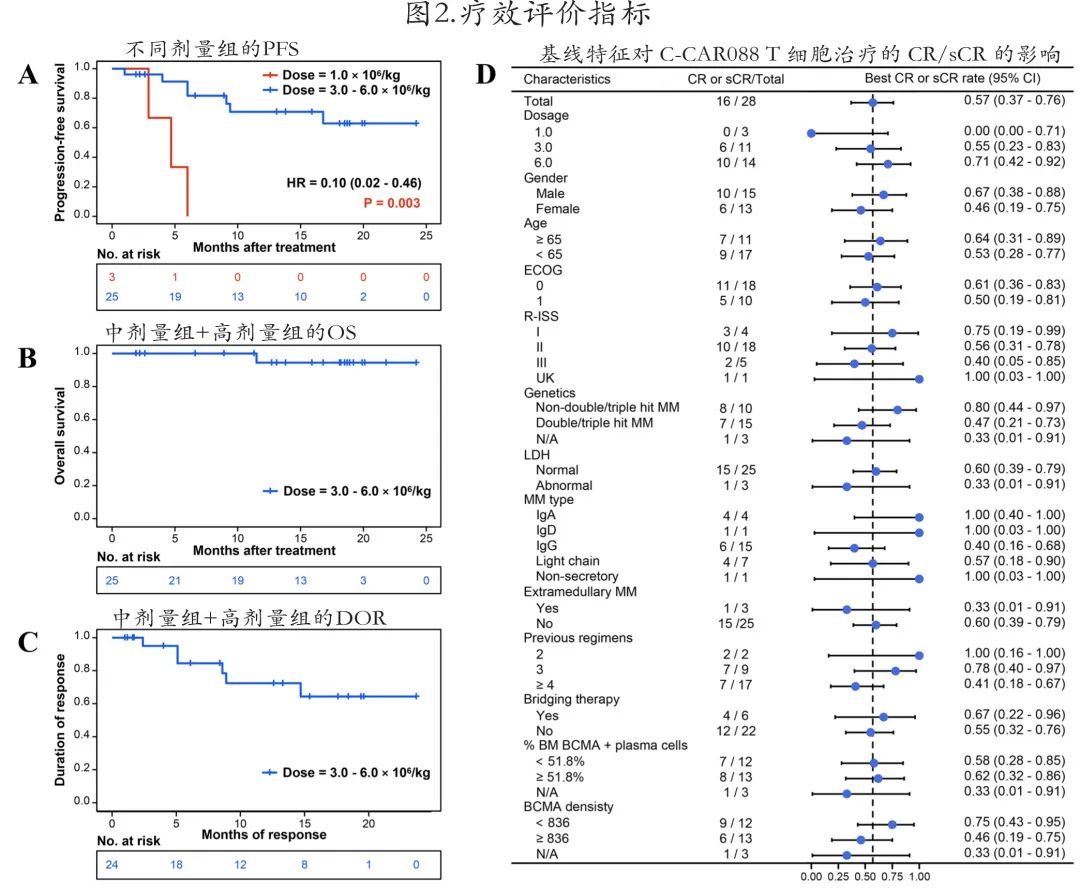
在评估多个因素(包括基线临床和治疗特征)对 CR/sCR 的影响的亚组分析中(图2D),中剂量组和高剂量组患者更易达到CR/sCR。
MRD
作者在 CR 患者中测定了MRD。低剂量组患者均未达到CR及以上缓解,中剂量组和高剂量组13例 sCR 和3例 CR 中有15例 (93.7%) 患者达到 MRD 阴性。此外有7例伴≥2个高危基因异常的患者达到 MRD 阴性CR,但在中位随访9.4个月后,有2例患者分别在 CR 后200天和255天复发。
C-CAR088 的药代动力学和药效学特征
作者通过测定外周血中 C-CAR088 基因拷贝数来评估 C-CAR088 的药代动力学特征,30例患者有可评估数据。C-CAR088的药代动力学参数(包括Cmax、Tmax、AUC0-28和Tlast)如图 3A 所示。
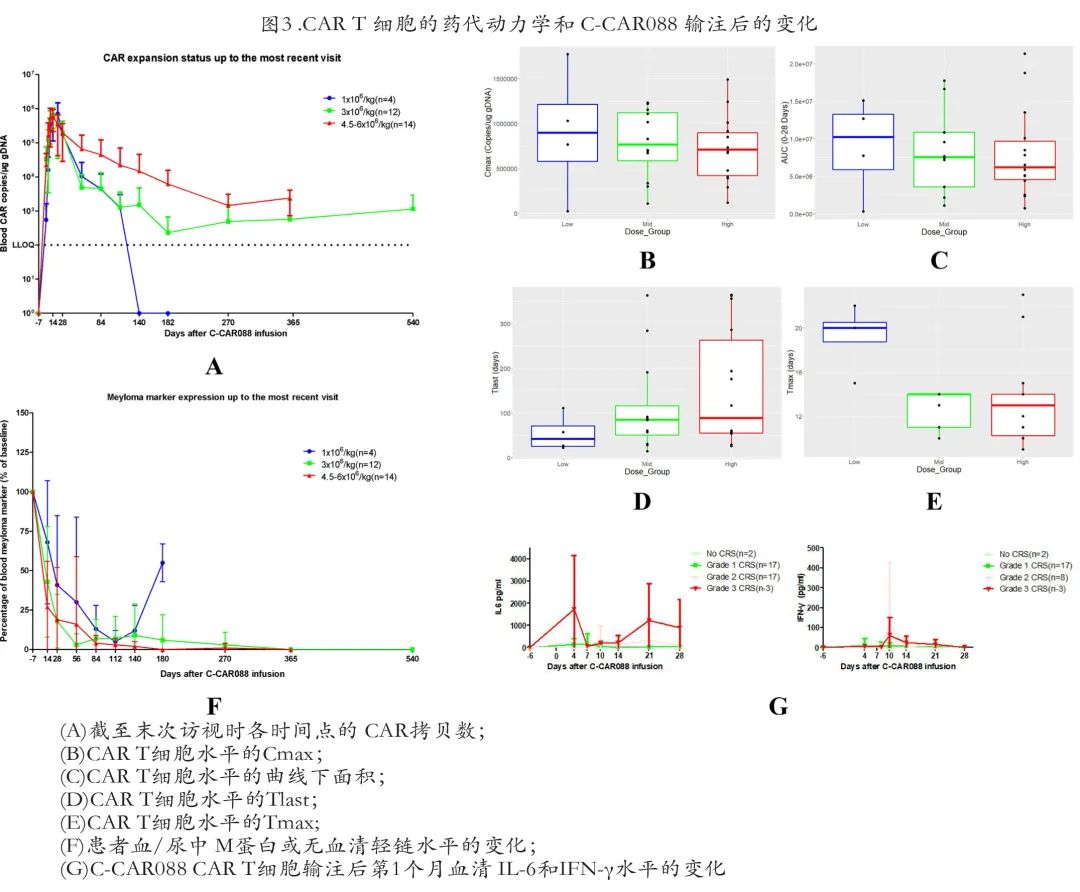
中位 Tmax 为14天,中位 Cmax 为750061拷贝/μg基因组DNA(gDNA),中位 AUC0-28为7558634拷贝/μg gDNA/天。Tlast 范围为14+ 至566+天。各组间这些指标差异均有统计学意义。采用 Tukey 真实显著性差异检验分析组间 C-CAR088 的药代动力学,中剂量组和高剂量组的 Tmax 显著缩短 (p< 0.05),其他动力学参数则无显著组间差异(图3B–E)。
使用血液/尿液 M 蛋白和 sFLC 水平变化作为 CAR088 的药效学生物标志物,将 C-CAR088 输注后的血/尿 M 蛋白和 sFLC 水平与基线进行比较。在低剂量组中,输注后2、4、8、12和16周,平均血/尿 M 蛋白或 sFLC 水平分别降低至基线的68±39%、41±44%、30±54%、13±15%和5±7%,而输注后20周和6个月时血/尿 M 蛋白或 sFLC 水平分别为基线的12±16%和55±12%。这些结果提示最低剂量无法完全抑制肿瘤细胞。
在中剂量组的12例患者中,第2、4、8、12、16和20周、6个月和9个月时,平均血液/尿液 M 蛋白或 sFLC 水平分别降低至基线水平的43±35%、18±17%、3±7%、7±12%、7±14%、9±20%、6±16%和3±8%,在12个月和18个月时,血液/尿液 M 蛋白或 sFLC 无法检测。
在高剂量组的14例患者中,2、4、8、12、16、20周、6个月和9个月时的平均血/尿 M 蛋白或 sFLC 水平分别降至27%±29%、19%±33%、16%±43%、4%±5%、3%±4%、2%±3%、0%±0%、1%±3%,输注后12个月时未检出血液/尿液 M 蛋白或 sFLC 。提示血液/尿液中 M 蛋白或 sFLC 水平的降低与 C-CAR088 扩增呈负相关(图3F)
输注后30天内血清 IL-6 和IFN-γ水平一过性升高。IL-6和IFN-γ的峰值水平倾向于与 CRS 严重程度相关(图3G)。
结论
本研究表明,C-CAR088在 RRMM 患者中具有良好的安全性和较高的抗肿瘤活性,是RRMM一种有前景的治疗选择,但仍有必要进行大型多中心临床试验来进一步证实。
参考文献
Xiaoyan Qu, Gang An, Weiwei Sui,et al. Phase 1 study of C-CAR088, a novel humanized anti-BCMA CAR T-cell therapy in relapsed/refractory multiple myeloma. J Immunother Cancer . 2022 Sep;10(9):e005145. doi: 10.1136/jitc-2022-005145.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言