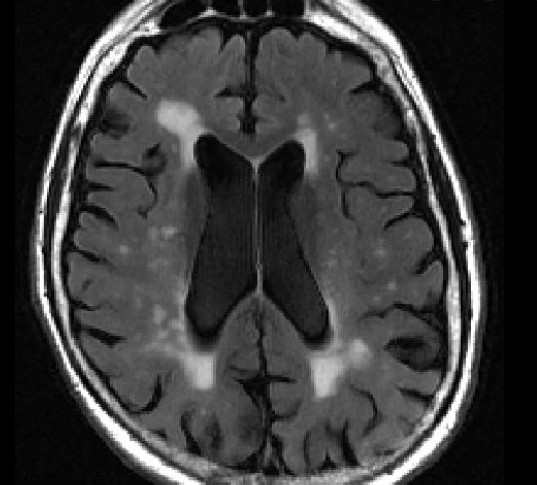
Neurology:突触和轴突完整性,对灰质萎缩影响巨大
2022-09-21 Freeman MedSci原创
基线CSF NfL和纵向颞顶萎缩之间的联系因突触功能障碍而加速,因突触的完整性而缓冲
神经变性通常用结构性磁共振成像上的纵向脑萎缩来衡量,表明神经细胞的累积性减少。然而,在MRI上可观察到的萎缩之前,神经完整性和功能会发生动态的分子改变。脑脊液(CSF)标记物能捕捉到神经结构的离散成分,特别是轴突和突触蛋白,增强了对这些失调的神经通路的描述。神经丝轻(NfL)是一个被充分研究的大口径有髓轴突变性的标志物。
图1: 论文封面图
最近的工作强调了突触退化和功能障碍的重要作用,通过量化反映突触前囊泡机制(突触体相关蛋白-25[SNAP-25]和突触标记-1[SYT-1])、突触后钙介导的信号通路调节(神经粒蛋白)和轴突外生长调节(生长相关蛋白43[GAP-43])的蛋白质。作为神经结构和功能的补充标志,NfL和突触蛋白的联合建模可能有助于我们对针对轴突和突触的病症中明显的大脑结构变化之前的神经损伤的分子理解和检测。
CSF NfL和突触蛋白越来越多地被纳入大脑老化和阿尔茨海默病(AD)的生物标志物模型中,以改善易受未来萎缩的大脑区域的预后。与AD蛋白病(CSF Aβ42和ptau181)无关,CSF NfL和突触蛋白的浓度都比较高(反映了更大的轴突和突触. 未经授权禁止转载本文)可预测轻度认知障碍(MCI)的全球和海马体积损失,以及认知障碍者更陡峭的海马萎缩、记忆衰退和未来转换为MCI。
虽然突触功能障碍伴随着AD和其他神经退行性疾病的恶化,但越来越多的证据表明,突触保护是认知复原力的核心组成部分,特别是针对AD蛋白病。在对病理性AD患者的尸检研究中,那些表现出更正常的突触蛋白水平的人在死亡时比那些有突触障碍的人更有可能没有认知障碍,尽管AD病理学的负担相似。
CSF AD蛋白异常对内侧颞叶和总灰质体积的有害影响只在CSF突触蛋白水平高(更异常)的人中检测到,甚至在临床上正常的成年人中也是如此。一项纵向分析同样表明,低基线CSF Aβ42与颞叶萎缩和皮质变薄之间的关系被基线CSF神经粒蛋白所缓和,神经粒蛋白是参与海马和新皮质可塑性的突触后蛋白。尽管保持突触的完整性可能会减弱Aβ42和tau181与结构性神经影像的不良关联,但突触过程如何潜在地缓冲和/或促成早期轴突变化和萎缩率还不清楚。
在一个无认知障碍的成人队列中,最近UCSF的Rowan Saloner等研究了基线CSF NfL与纵向灰质萎缩之间的关系。然后,使用突触前和突触后蛋白的CSF组合,评估了突触完整性对这种关系的调节作用。
核心假设:与NfL相关的灰质体积下降在较低的突触功能障碍水平上会减弱,即使考虑到AD病理学(CSF ptau181/Ab42比率)。
临床上正常的老年人参加了加州大学旧金山分校记忆和老龄化中心的Hillblom老龄化网络观察研究,完成了基线腰椎穿刺和纵向脑MRI(平均扫描[随访]=2.6[3.7年])。CSF被检测为突触蛋白(synaptotagmin-1、突触体相关蛋白2[SNAP-25]、神经粒蛋白、生长相关蛋白43[GAP-43])、轴突损伤(NfL)和核心AD生物标志物(ptau181/Aβ42比率;反映AD蛋白病)。10个被证明对临床AD敏感的双侧颞顶灰质ROI被加在一起,生成一个复合的颞顶ROI。线性混合效应模型测试了基线突触蛋白对基线NfL相关的颞叶轨迹的统计调节作用,控制了ptau181/Aβ42的比率。
46名临床正常的老年人(平均年龄=70岁;43%为女性)被纳入。突触蛋白与NfL表现出小到中等的相关性(r范围:0.10至0.36)。

图2:论文结果图
较高的基线NfL,但不是ptau181/Aβ42比率,预示着更陡峭的颞顶萎缩(NfL x时间:b=-0.08,p<.001;ptau181/Aβ42 x时间:b=-0.02,p=.31)。SNAP-25、neurogranin和GAP-43对NfL相关的萎缩轨迹有明显的调节作用(-0.07≤bs≥-0.06,ps<.05),因此NfL在高(更异常)而非低(更正常)突触蛋白浓度下与颞顶萎缩有关。
在高NfL浓度下,突触蛋白浓度低(b范围:-0.21至-0.07)的萎缩轨迹比高(b范围:-0.33至-0.30)的萎缩轨迹要弱1.5至4.5倍。
该研究的重要意义在于发现了:基线CSF NfL和纵向颞顶萎缩之间的联系因突触功能障碍而加速,因突触的完整性而缓冲。除了AD蛋白外,同时检查体内轴突和突触的生物标志物可能会改善对AD敏感脑区明显结构变化之前的神经改变的检测。
原文出处
Saloner R, Fonseca C, Paolillo EW, et al. Combined Effects of Synaptic and Axonal Integrity on Longitudinal Gray Matter Atrophy in Cognitively Unimpaired Adults. _Neurology_. Published online August 30, 2022:10.1212/WNL.0000000000201165. doi:[10.1212/WNL.0000000000201165](https://doi.org/10.1212/WNL.0000000000201165)
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言