Eur Heart J 陈厚早/唐小强/闫波合作解码血管衰老表观修饰机制
2023-07-11 论道心血管 论道心血管 发表于上海
研究首次揭示了内源性表观修饰酶在血管衰老中的关键功能。
衰老是心血管疾病的重要风险因素。随着我国人口老龄化的加剧,衰老相关的心血管疾病已经成为导致城乡居民死亡的首位原因。在老年个体中,全身的血管会发生病理性重塑,从而增加罹患冠心病、心力衰竭、高血压、动脉粥样硬化和动脉瘤等老年相关心血管疾病的风险。已有大量证据显示,可以通过调控衰老相关的信号通路来改善血管健康从而促进生命健康并延长寿命。因此,可以通过促进血管“再年轻化(Rejuvenation)”来抵抗衰老和相关疾病的发生,这需要我们对血管衰老本身有深刻的理解。
衰老过程伴随着代谢的重塑和代谢小分子缓冲池(Metabolite Pool)的失衡。代谢小分子和表观修饰酶的变化驱动了表观修饰的重塑和衰老的发生。然而,内源性表观修饰酶在血管衰老中的功能尚不清楚。
2023年6月28日,中国医学科学院陈厚早研究员、四川大学唐小强副研究员和济宁医学院闫波教授合作在European Heart Journal发表了题为“Sirtuin 2 deficiency aggravates ageing-induced vascular remodelling in humans and mice”的研究论文,首次揭示了内源性表观修饰酶在血管衰老中的关键功能。

细胞内代谢物(如NAD+)的失调是血管衰老的重要风险因素。其中,NAD+可以作为翻译后修饰的辅助因子,通过Sirtuin (SIRT)家族和PARP参与生理和病理过程。Sirtuin家族是调节代谢、寿命和心血管疾病的去酰基化酶家族,但它们在血管衰老中的作用仍有待确定。基于衰老人群和小鼠数据,该研究首次证明了SIRT2作为一种表观遗传调节因子可以通过细胞质-线粒体穿梭机制调控血管衰老。
首先,作者利用人群和小鼠动脉组学数据分析了表观修饰酶Sirtuin家族在血管中的表达谱,发现血管中SIRT2表达丰度最高,而不是大家熟知的SIRT1和SIRT6。在衰老过程中,血管中的SIRT2蛋白表达和酶活性均下降,而这种变化发生于中膜的血管平滑肌细胞中(图1)。
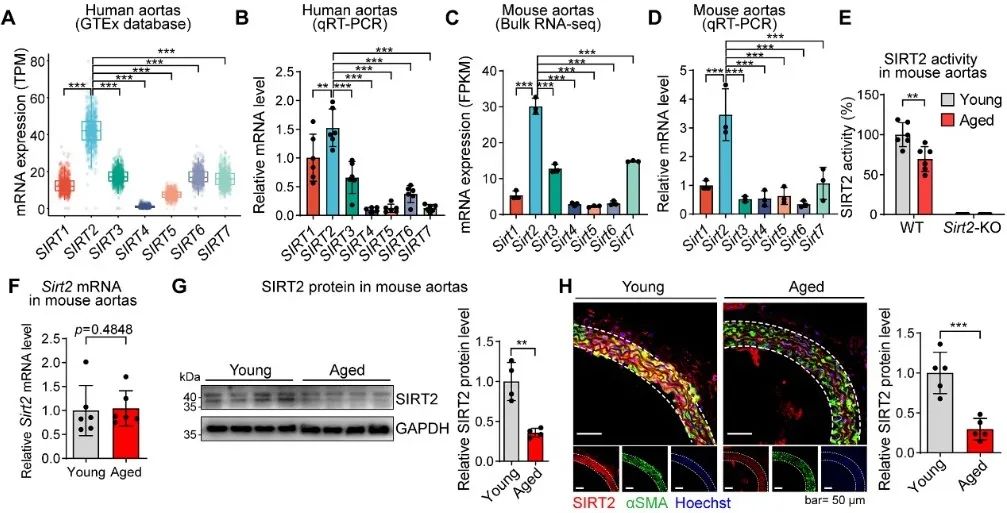
图1. 表观修饰酶Sirtuin 在血管中的表达谱
为了进一步探讨SIRT2在衰老诱导的血管功能障碍中的作用,作者构建了Sirt2敲除(Sirt2-KO)的自然衰老小鼠模型(24个月)。与野生型(WT)老年小鼠相比,Sirt2-KO衰老小鼠的脉搏波速度(PWV)、血管收缩舒张等功能性指标均表现得更差,提示衰老相关的SIRT2缺失加重了增龄引起的血管硬化和收缩舒张功能障碍。深入的解剖学和病理学分析结果显示,SIRT2的缺失增加了衰老导致的血管重塑,包括中膜厚度增加、弹力纤维断裂、胶原降解、炎症浸润增加和巨噬细胞不平衡的极化等。上述结果表明,SIRT2缺失促进了血管衰老(图2)。
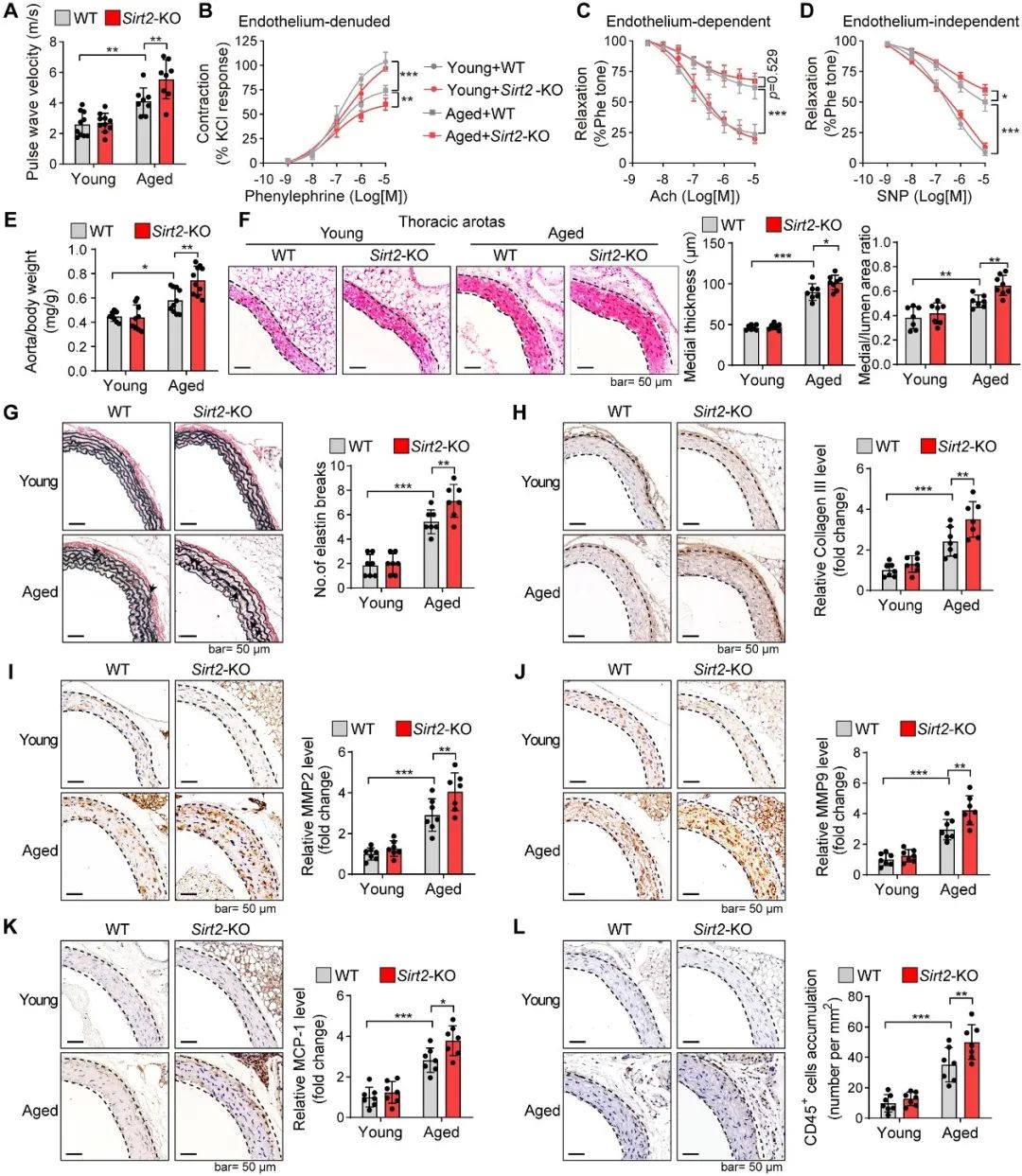
图2. SIRT2缺失促进血管衰老
为了探索表观修饰酶SIRT2参与血管衰老的机制,作者首先基于Sirt2-KO和WT老年小鼠血管的转录组数据进行了分析,发现SIRT2 的缺失虽然并没有直接诱发血管疾病的发生,但是显著促进了血管疾病相关通路的富集,提示SIRT2的缺失会显著增加罹患血管性疾病的风险。为了探索SIRT2 参与血管衰老的机制,作者对SIRT2影响的关键信号通路进行了分析和验证,发现氧化还原相关信号在其中扮演了重要角色(图3)。
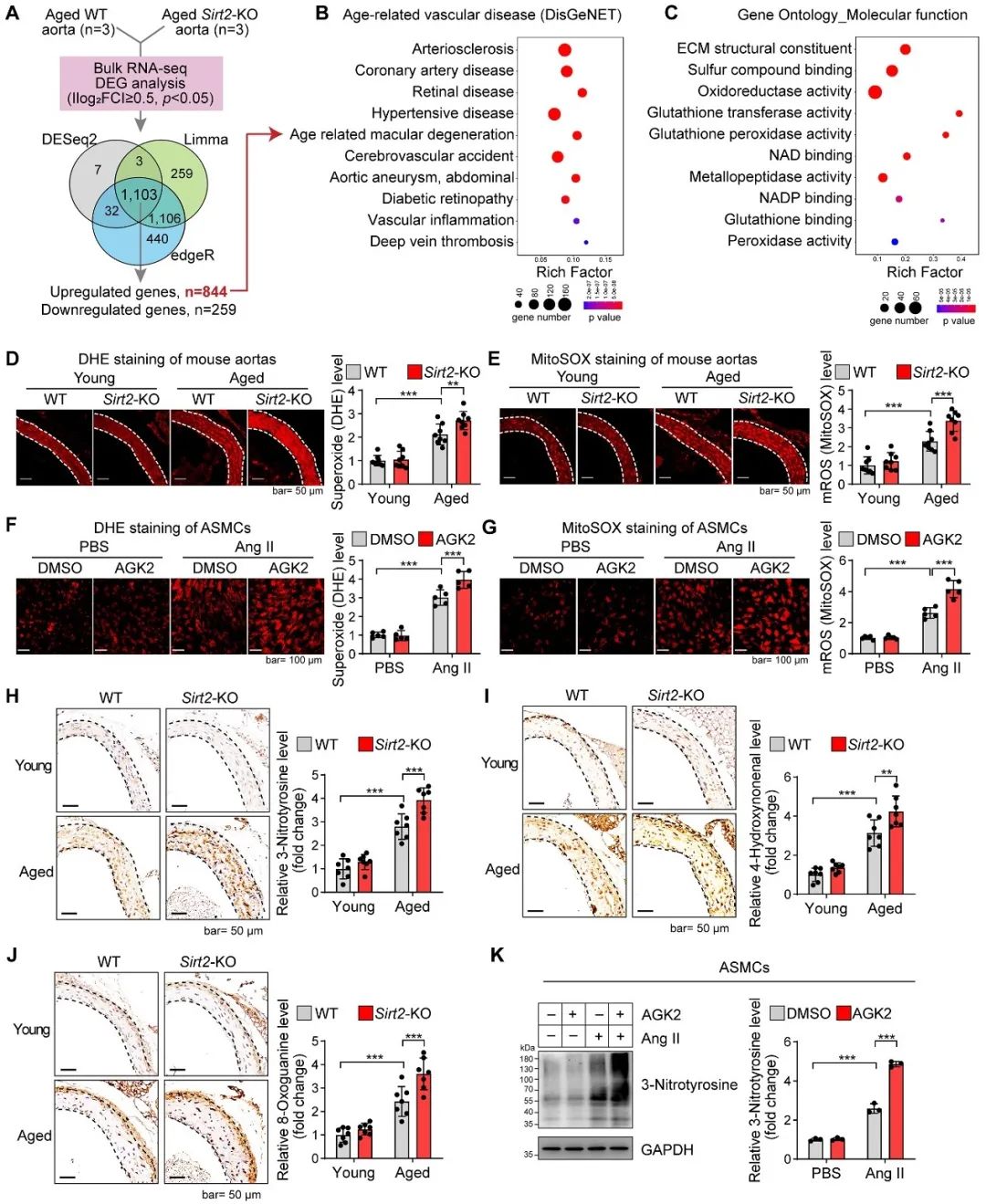
图3. SIRT2调控血管氧化应激与老化相关疾病基因集
然而后续进一步结果发现,抗氧化系统不参与SIRT2抗血管衰老的功能,且SIRT2的功能并不依赖于对组蛋白修饰的影响。因此,作者猜测SIRT2可能影响了某个非组蛋白且这个非组蛋白具有促氧化应激功能。作者通过筛选验证,鉴定到关键蛋白p66Shc。p66Shc可穿梭于细胞浆-线粒体,在线粒体中促进过氧化氢的产生来参与血管衰老和寿命调控(7)。SIRT2去乙酰化p66Shc来抑制其磷酸化和活性。因此,SIRT2基于乙酰化-磷酸化偶联修饰机制调控了p66Shc在细胞浆-线粒体穿梭和氧化应激通路的活化,进而重塑血管细胞转录组来调节血管衰老(图4)。
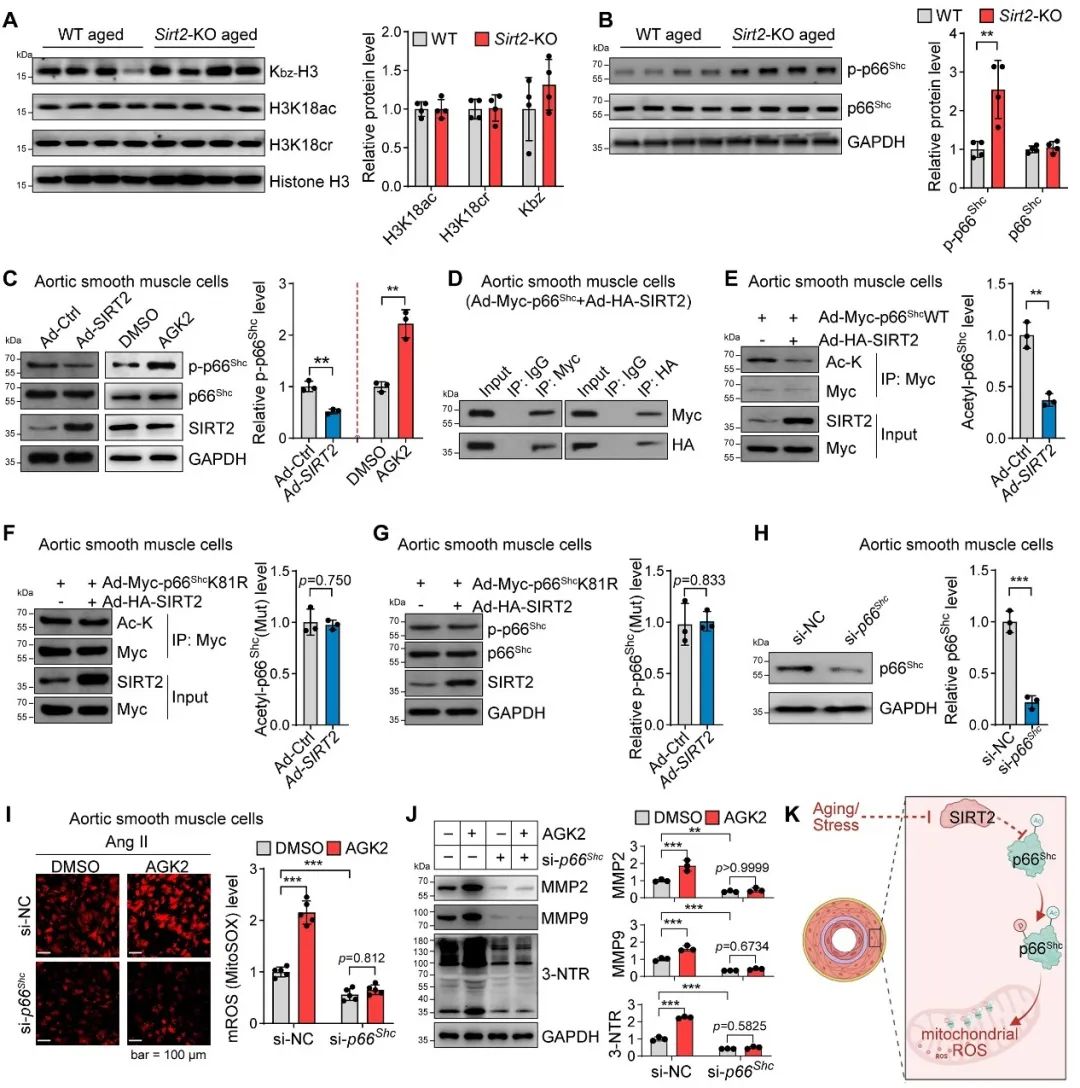
图4. SIRT2通过p66Shc调节线粒体氧化应激和血管细胞重构
接下来,作者进一步探索了在衰老和SIRT2缺失的情况下,干预线粒体ROS是否可以逆转血管衰老?作者在自然衰老的小鼠中给予线粒体ROS抑制剂MnTBAP进行治疗。结果显示,MnTBAP能改善衰老小鼠血管的PWV、血管舒缩功能以及衰老相关重塑,并且可以在一定程度上逆转SIRT2缺失引起的衰老相关分泌表型(SASP)。这些证据进一步证实了线粒体氧化应激通路参与了SIRT2在血管衰老中的功能,并且提示抗线粒体氧化应激可参与逆转血管衰老(图5)。
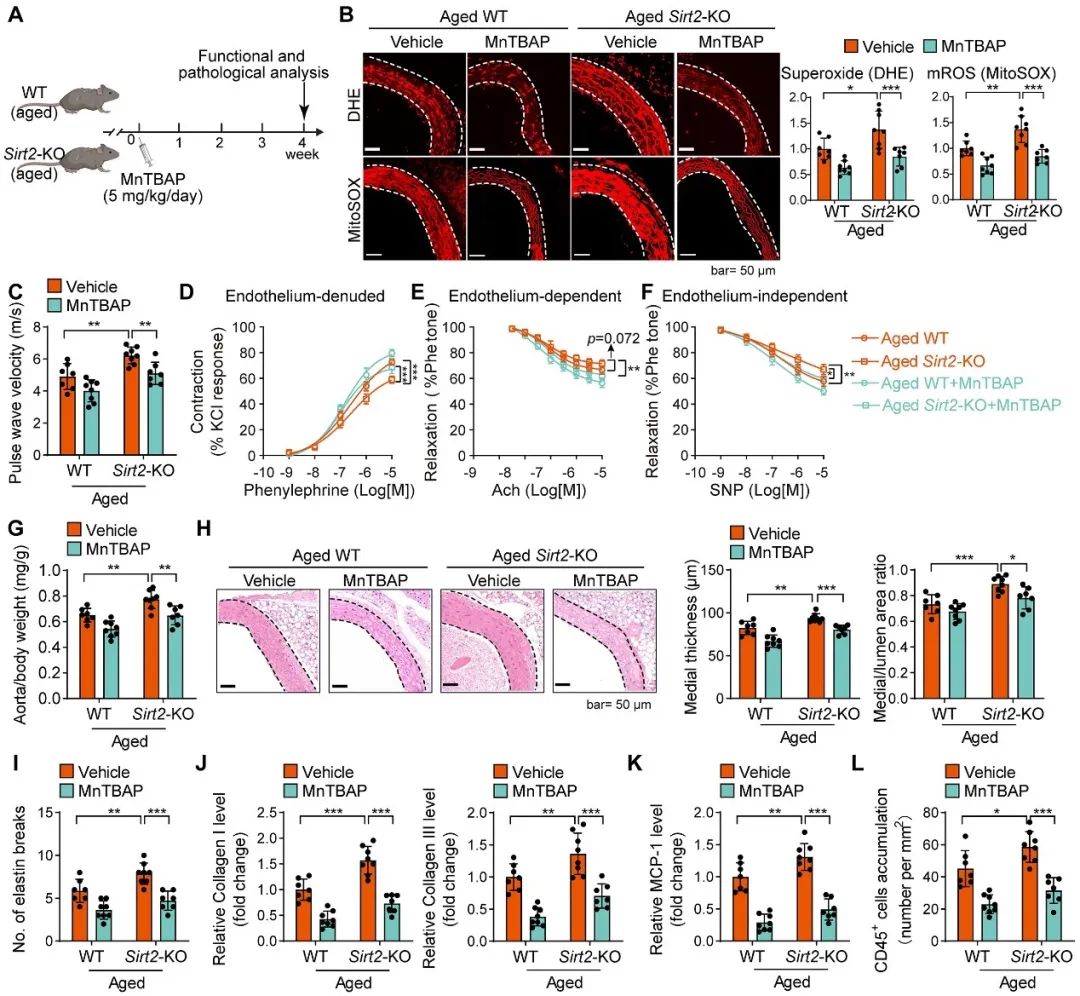
图5. 线粒体抗氧化剂MnTBAP抵抗SIRT2缺失导致的血管老化
为了进一步在人群中研究SIRT2在血管衰老与疾病中的功能,作者对包括4263个蛋白质组、607个转录组和52882个单细胞转录组在内的多组学数据进行整合分析,发现血浆SIRT2在衰老过程中逐渐降低,且血管中SIRT2共表达模块也随着增龄而降低。因此,SIRT2共表达模块可能参与动脉瘤和动脉硬化等衰老相关血管疾病的发生。此外,作者还发现在人群和小鼠动脉血管中,SIRT2共表达模块均与细胞代谢和氧化还原系统相关,提示SIRT2通过表观修饰机制调节氧化还原系统来抵抗血管衰老,这是一种进化上保守的抗衰老机制(图6)。
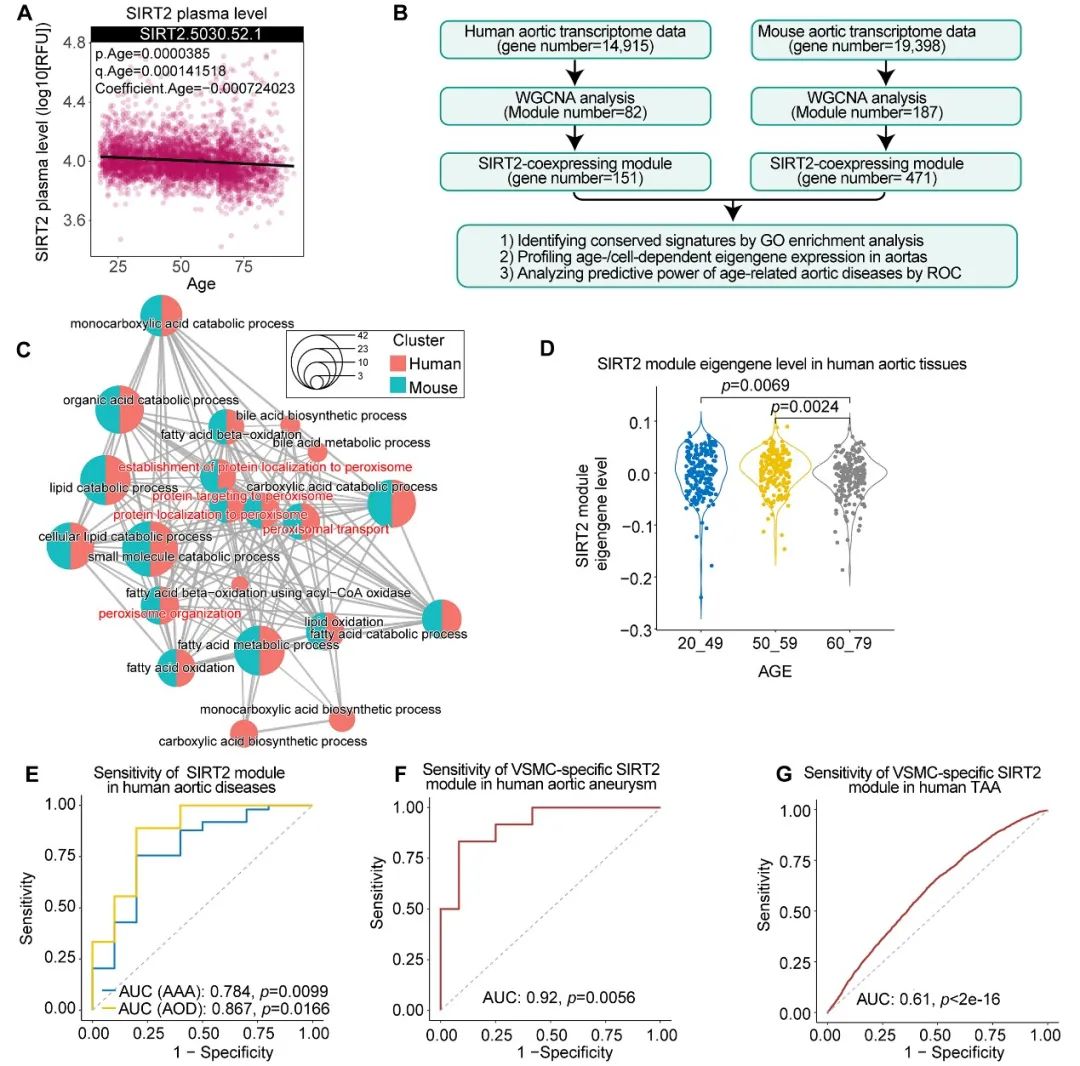
图6. SIRT2参与人群血管老化与疾病
综上所述,在机体衰老时,SIRT2蛋白的表达水平和活性下降,导致其对p66Shc蛋白去乙酰化降低,从而引起p66Shc磷酸化增加,活化后p66Shc转位至线粒体中,与呼吸链相耦合,产生大量的线粒体活性氧(mROS),引起血管转录组的重塑并加重衰老诱导的血管重塑及相关疾病的发生。该研究揭示了胞浆-线粒体中的SIRT2-p66Shc-mROS轴可作为维持血管年轻化和治疗衰老相关血管疾病的靶点(图7)。
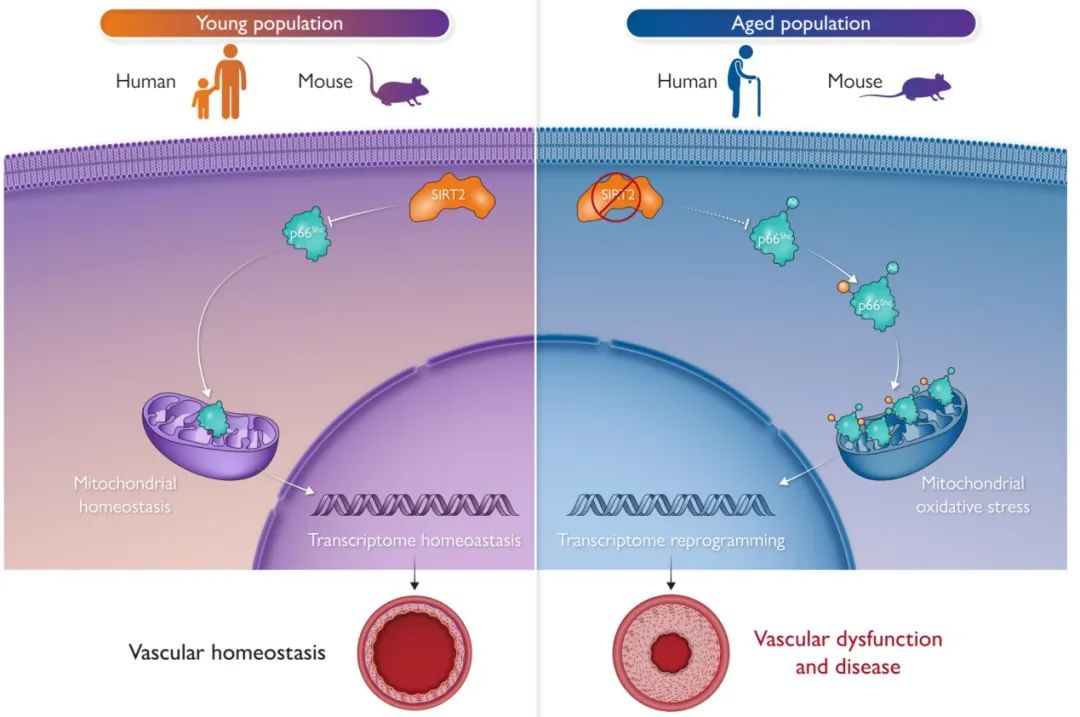
图7. SIRT2解码血管衰老
该论文上线当天,European Heart Journal杂志为本文配发了特别评述:《Sirtuin 2 in Vascular Ageing: the Forsaken Child?》。该评述称:“The current study provides an important additional contribution to solve the mystery of vascular ageing and to embark on the future where growing old is inevitable, but ageing is optional”。
中国医学科学院基础医学研究所陈厚早研究员、四川大学华西二院唐小强副研究员、济宁医学院精准医学研究院闫波教授为本文共同通讯作者,中国医学科学院基础医学研究所张阳博士(现为复旦大学附属中山医院住院医师)、王小满博士、李勋凯博士和博士生吕双杰为本文共同第一作者。本研究得到了国家重点研发计划、国家自然科学基金、中国医学科学院医学与健康科技创新工程等项目资助。中国医学科学院刘德培教授、清华大学罗永章教授、复旦大学钱菊英教授和孙爱军教授等为本研究提供了大力支持和帮助。
此前,中国医学科学院基础医学研究所刘德培/陈厚早团队在《循环》(Circulation)杂志报道了表观修饰酶SIRT2调节心脏衰老(Circulation. 2017; 136: 2051-2067;入选“十三五期间中国心血管病十大基础研究”;唐小强副研究员为第一作者)。这一系列研究加深了对心血管衰老机制的理解,提示SIRT2是防治心血管衰老的潜在靶点。
参考文献
1. 国家心血管病中心,《中国心脑血管健康与疾病报告2022》, (2023).
2. M. Grunewald et al., Counteracting age-related VEGF signaling insufficiency promotes healthy aging and extends life span. Science 373, eabc8479 (2021).
3. Y. Chen et al., Aging reprograms the hematopoietic-vascular niche to impede regeneration and promote fibrosis. Cell metabolism 33, 395-410. e394 (2021).
4. C. Correia-Melo et al., Cell-cell metabolite exchange creates a pro-survival metabolic environment that extends lifespan. Cell 186, 63-79 e21 (2023).
5. J. H. Yang et al., Loss of epigenetic information as a cause of mammalian aging. Cell 186, 305-326 e327 (2023).
6. M. O. J. Grootaert, M. R. Bennett, Sirtuins in atherosclerosis: guardians of healthspan and therapeutic targets. Nat Rev Cardiol 19, 668-683 (2022).
7. J. F. Pei et al., Diurnal oscillations of endogenous H(2)O(2) sustained by p66(Shc) regulate circadian clocks. Nat Cell Biol 21, 1553-1564 (2019).
原文链接:
https://doi.org/10.1093/eurheartj/ehad381.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言