Nature子刊:邓宏魁团队建立全新胰岛移植策略,解决干细胞治疗糖尿病的关键难题
2023-01-11 生物世界 生物世界 发表于上海
该研究开发了一个全新的胰岛移植策略,有效支持人多能干细胞分化的胰岛细胞在体内存活、功能成熟以及功能长期维持。

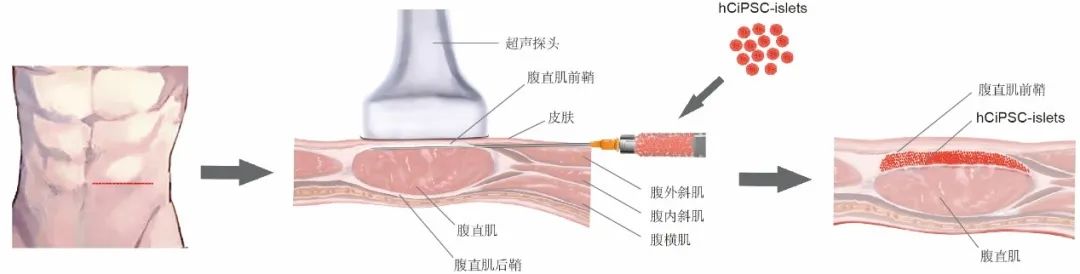
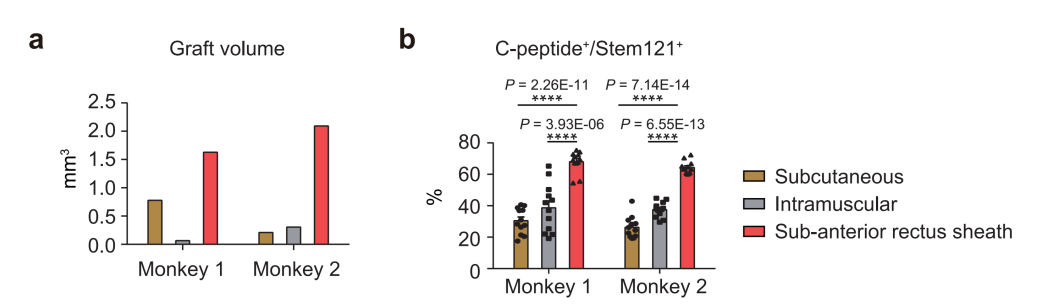
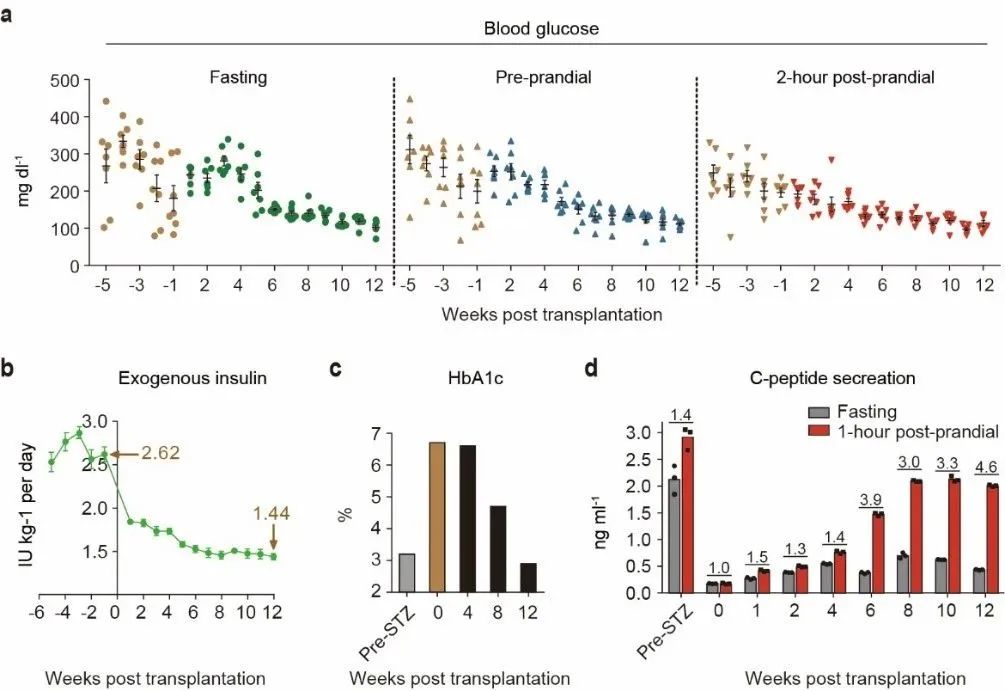
论文审稿专家之一,糖尿病研究领域的国际著名专家 Gordon Weir 教授对本项研究予以高度评价:该研究有力地证明了腹直肌前鞘下作为诱导多能干细胞(iPS)分化的胰岛细胞的移植场所的潜在价值。这个移植位点可能扩展应用到任何来源的细胞移植。在该部位的移植组织的存活率和功能令人印象深刻。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言