Cancer Discovery:有望精准治疗急性髓系白血病!张笑天/万里玲/种莎莎发布最新发现
2023-02-19 周 “ iNature”公众号 发表于上海
该发现揭示了NPM1c作为白血病基因表达的转录放大器的新形态功能,并为治疗干预开辟了新的范式。
iNature
核磷蛋白1(NPM1)是一种广泛表达的核仁蛋白,在30%的急性髓系白血病(AML)中,NPM1的末端外显子经常被发现突变,导致核输出信号的添加和蛋白转移到细胞质(NPM1c)。携带该突变的AMLs具有HOXA/B基因的异常表达,其过表达导致白血病转化。
2023年2月14日,德克萨斯大学张笑天、宾夕法尼亚大学万里玲及加州理工大学种莎莎共同通讯在Cancer Discovery(IF=38)在线发表题为“Mutant NPM1 hijacks transcriptional hub to maintain pathogenic gene programs in acute myeloid leukemia”的研究论文,该研究表明突变NPM1劫持转录枢纽以维持急性髓系白血病的致病基因程序。

NPM1是一种多功能核仁蛋白,参与核糖体生物发生、核糖体RNA (rRNA)转录、着丝粒维持和组蛋白伴侣活性。它包含一个内在无序区(IDR),并通过液-液相分离(LLPS)与RNA和其他核仁蛋白进行多价同型和异型相互作用参与核仁的形成。在急性髓系白血病(AML)中,NPM1最后一个外显子的碱基对插入导致突变的NPM1蛋白具有额外的核输出信号(NES)。突变的NPM1蛋白(NPM1c)从核仁转移到细胞质,激活AML中的HOXA/B簇基因。
人们提出了多种假说来解释突变体NPM1c在正常造血干细胞和祖细胞(HSPC) 转化中的作用。来自基因工程小鼠模型的数据表明,NPM1的缺失诱导骨髓发育不良,而在小鼠中,转基因NPM1c或在造血谱系中条件敲入NPM1c导致AML的发展。这些小鼠模型的病谱差异表明,AML的发展需要NPM1c突变,而不是NPM1的缺失。但是,NPM1c激活HOXA/B聚类基因的确切的分子机制尚不清楚。各种数据表明,过渡的NPM1c可将HOXA/B抑制元件隔离到细胞质中。因此,这些提出的模型表明NPM1c作为68个转录沉默基因的去抑制因子。
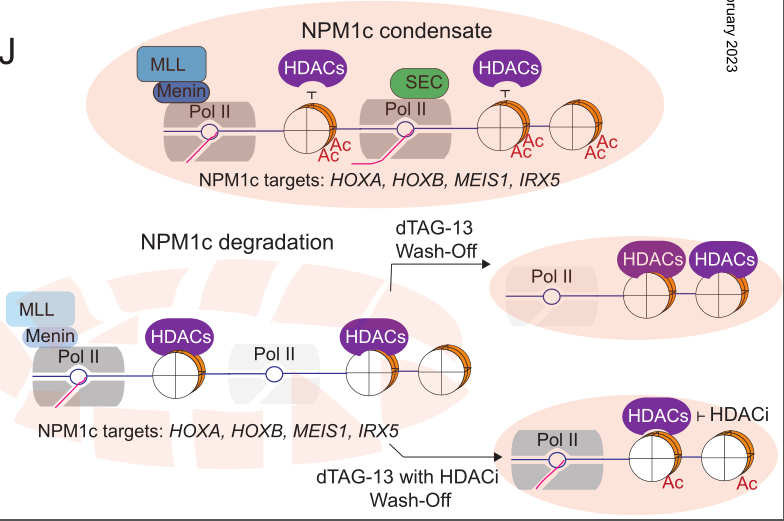
NPM1c的转录调控和HDAC对染色质白血病基因表达的拮抗模型(图源自Cancer Discovery )
其他数据表明,NPM1c或NPM1野生型(WT)蛋白可以通过一种未知但潜在的染色质相关机制直接调节基因表达。这些数据表明NPM1c和/或NPM1-WT是基因表达的直接激活因子。鉴于这些相互矛盾的数据,到目前为止,还没有研究能够全面描述NPM1c是如何调节基因表达的。特别是,尚无关于NPM1c突变性质的研究。对基因表达的影响是否归因于NPM1-WT的一个等位基因的缺失,还是NPM1c具有新胚性功能尚不清楚。重要的是,NPM1c+ AMLs中,NPM1-WT和/或NPM1c是否在HOXA/B聚类基因和MEIS1等关键白血病基因的异常表达中发挥作用尚不清楚。这种不透明性阻碍了NPM1c驱动白血病转化机制的研究和新疗法的开发。
该研究首次全面证明了NPM1c与NPM1c AMLs中的活性基因启动子亚群结合,包括众所周知的白血病驱动基因-HOXA / B簇基因和MEIS1。NPM1c通过协调转录中心来维持关键靶基因的活性转录,并通过抑制组蛋白脱乙酰酶的活性来维持活性染色质景观。总之,这些发现揭示了NPM1c作为白血病基因表达的转录放大器的新形态功能,并为治疗干预开辟了新的范式。
David Wang, 范丹丹(温州医科大学), 韩沁钰(加州理工大学),刘易曼(宾夕法尼亚大学)为本项研究的共同第一作者。苏建忠博士课题组(温州医科大学)在这项研究中做出了重要贡献。张笑天博士是本项研究的最后通讯作者。
原始出处:
Xue Qing David Wang, et al. Mutant NPM1 Hijacks Transcriptional Hubs to Maintain Pathogenic Gene Programs in Acute Myeloid Leukemia. Cancer Discov OF1–OF22.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言