重磅!国内首个治疗腱鞘巨细胞瘤关键性III期临床试验积极结果公布
2024-11-13 小药说药 网络 发表于上海
Pimicotinib显著提高了腱鞘巨细胞瘤(TGCT)患者的客观缓解率(ORR)。第25周时,Pimicotinib组的ORR为54.0%,而安慰剂组为3.2%。
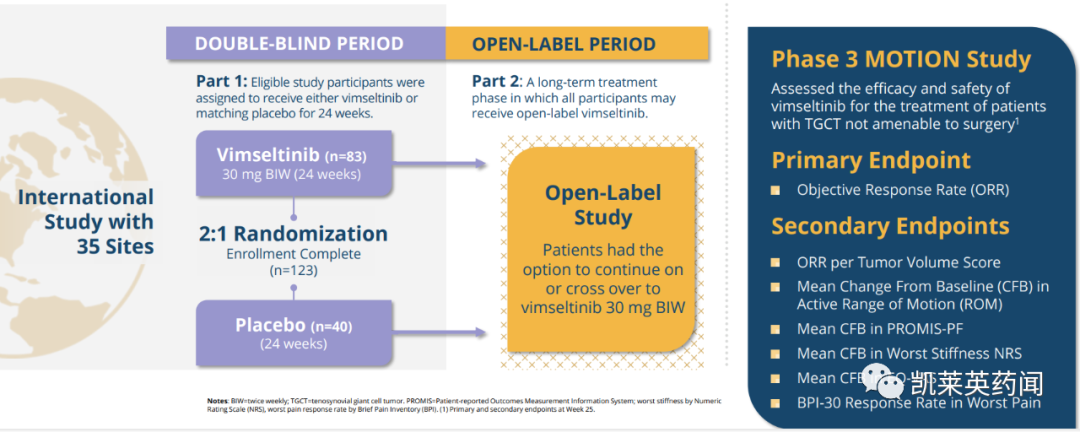
2024年11月12日,全球领先的科技公司默克对外披露MANEUVER研究III期数据。该研究是由和誉医药开展的一项评估Pimicotinib(匹米替尼)在不可手术成人腱鞘巨细胞瘤(TGCT)患者中有效性和安全性的随机、双盲、安慰剂对照、多中心III期临床研究,也是首个实现亚洲和欧美TGCT患者均衡招募的国际多中心研究。
研究结果显示,Pimicotinib显著提高了腱鞘巨细胞瘤(TGCT)患者的客观缓解率(ORR)。第25周时,Pimicotinib组的ORR为54.0%,而安慰剂组为3.2%。值得注意的是,研究还显示,Pimicotinib在TGCT患者重要临床结局相关的次要终点表现出具有统计学和临床意义的显著改善,包括数字评分量表(NRS)评估的僵硬程度和简明疼痛量表(BPI)评估的疼痛度。
在 MANEUVER 研究中,Pimicotinib展现出良好的耐受性,安全性数据与先前报告的数据一致,未观察到胆汁淤积性肝毒性发生。治疗中Pimicotinib组出现的不良事件 (TEAE)导致治疗终止和剂量下调的患者分别是1.6%(1名)和7.9%(5名)。
此前,Pimicotinib已获得中国国家药品监督管理局(NMPA)、美国食品药品监督管理局(FDA)所授予的突破性疗法认定以及欧洲药品管理局(EMA)所授予的优先药物资格认定及孤儿药资格认定,用于治疗不可手术的腱鞘巨细胞瘤。
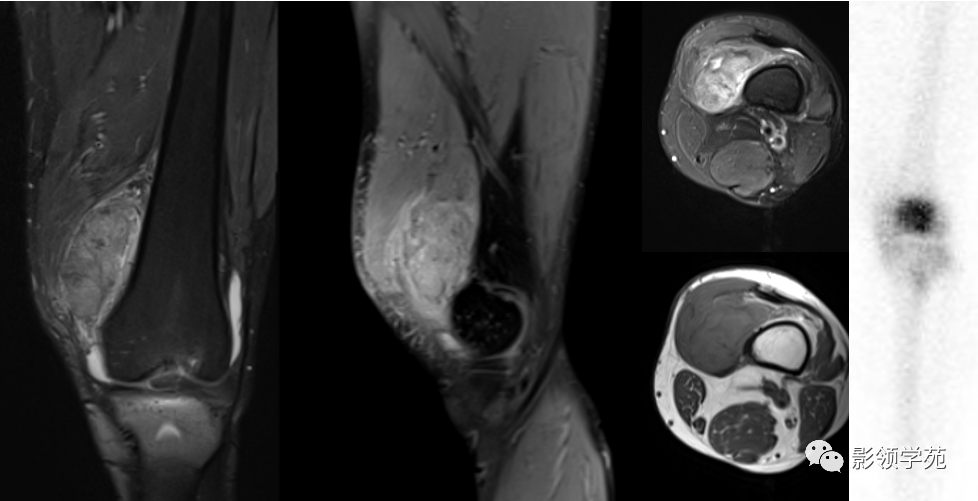
TGCT是一种罕见的良性侵袭性肿瘤,主要分为局限性腱鞘巨细胞瘤和弥漫性腱鞘巨细胞瘤两个亚型,通常出现在手、足、踝、膝等关节滑膜、滑囊或腱鞘中。据统计,每年每百万人中约有11人会罹患该疾病,患者多在20至50岁之间确诊,且女性患者数量居多。
TGCT引起的关节肿胀、疼痛、僵硬和行动受限会严重影响患者的日常生活,严重时还会导致骨骼、关节和周围组织的不可逆损伤。有数据显示,TGCT患者从初次感到不适到确诊,平均需要耗费2.9至3.7年。目前TGCT治疗方法多为手术治疗。但术后易复发,局限性TGCT术后复发率约为10%-14%,弥漫性TGCT术后复发率约为9%-25%,且反复手术可能带来诸如关节功能丧失或继发性骨关节炎等严重并发症。更为棘手的是,对于不可手术的TGCT患者,目前国内尚无系统性治疗药物,存在巨大、未被满足的临床需求。
“腱鞘巨细胞瘤往往多发于年轻人。这种罕见的良性肿瘤生长在关节内部和周围,主要影响处于工作年龄的年轻人和中年人。腱鞘巨细胞瘤主要表现为关节肿胀、疼痛、僵硬和活动受限,会严重影响日常活动能力,限制患者的工作和社交生活。其一般需要通过手术进行治疗,但是术后的高复发率以及反复手术可能带来的并发症给患者带来了巨大挑战,因此迫切需要能够控制肿瘤生长的系统性疗法。”北京积水潭医院骨与软组织肿瘤诊疗中心主任牛晓辉教授表示,“基于MANEUVER研究的最新数据以及匹米替尼对CSF-1R的高选择性和有效抑制作用,加上每日一次的口服给药方式还有助于提高患者的长期依从性,匹米替尼有可能为腱鞘巨细胞瘤患者建立一种新的治疗模式。
“对于主要由CSF-1过表达引起的TGCT,临床上迫切需要有效且耐受性良好的系统性治疗,该疾病会导致关节组织增厚和过度生长,严重影响患者的生活。MANEUVER的III期数据证实了和誉医药I期研究的结果,表明Pimicotinib靶向CSF-1有望为患者提供新的治疗选择。我们将与和誉医药合作并审阅该研究数据,准备和中国的监管机构分享研究结果,我们的共同目标是尽快将Pimicotinib带给有需要的患者。”默克医药健康全球研发负责人兼首席医学官Danny Bar-Zohar表示。
此前,默克中国医药健康董事总经理张巍接受媒体采访时曾表示,秉持“齐心为病患”的初心,默克聚焦未被满足的临床需求,积极助力肿瘤的精准诊疗,力求推动科学创新成果在临床实践中的广泛应用。在强化自身研发实力的同时,默克在积极拓展和本土创新药企的合作,实现“自研”与“引入”的双翼驱动,致力于成为医疗健康领域的“首选合作伙伴”。
在此战略引领下, 2023年12月4日,默克与和誉医药就Pimicotinib达成许可协议。该协议授予默克在中国内地、中国台湾、中国香港和中国澳门的Pimicotinib(ABSK021)商业化许可,并拥有全球其余市场的选择权。
和誉医药董事长兼CEO徐耀昌博士表示:“MANEUVER 是一项具有里程碑意义的全球性研究。它是首个在多个地区以均衡比例招募亚洲和西方腱鞘巨细胞瘤患者的全球性试验。这样就可以进行详细的结果比较,有助于更深入地了解不同人群的疾病特征和潜在的反应差异。匹米替尼代表了新兴CSF-1R抑制剂类别的关键进展,有望为全球的腱鞘巨细胞瘤患者提供新型口服小分子药物治疗方案。我们期待和默克团队紧密合作,共同推动匹米替尼的注册申报,让匹米替尼成为系统性治疗腱鞘巨细胞瘤的首选方案!”
参考资料
[1] de Saint Aubain Somerhausen iN, van de Riin M.Tenosyno giant cell tumour,diffuse type.Inc Fletcher CDM,Bridge J,Hogendoom P,eds.World Health Organization Classification of tumours of Soft tissue and Bone. 4th ed.Lyon. France. IARC.Pess:2013;102-103.
[2] Staals EL, Ferrari S, Donati DM, Palmerini E. Diffuse-type tenosynovial giant cell tumour: Current treatment concepts and future perspectives. Eur J Cancer. 2016 Aug;63:34-40.
[3]李伟华,胡鹏,毕树雄.色素沉着绒毛结节性滑膜炎的研究进展[J].国际骨科学杂志,2021,42(1):5.
[4]OttavianiS,AyralX,DougadosM,GossecL.Pigmentedvillonodularsynovitis:aretrospectivesingle-centerstudyof122casesandreviewoftheliterature.SeminArthritisRheum.2011Jun;40(6):539-46.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#腱鞘巨细胞瘤# #Pimicotinib#
21