【协和医学杂志】实现重症医学科导管相关血流零感染不是梦
2024-06-27 协和医学杂志 协和医学杂志 发表于上海
本文阐述了CRBSI防控的核心技术,探讨如何在临床实践中落实防控措施以避免和减少CRBSI的发生,甚至使其零感染。
随着重症救治理论、技术和方法的不断更新,重症医学科患者在应用各种机械辅助及多个血管内导管治疗原发病、保障器官功能的同时,也为细菌入侵建立了可能通路,极大提高了导管相关血流感染(CRBSI)的发生率[1-2]。
美国疾病控制与预防中心(CDC)指出,重症医学科平均住院天数<7 d的患者其CRBSI的发生率显著增加[3],且12%~25%的患者死于CRBSI[4-5]。我国CRBSI的发生率相对较高,每千导管日感染发生率为9.8‰[6],其中80%以上发生于重症医学科,而国际医院感染控制联盟(INICC)每千导管日感染发生率为6.8‰ [6]。
患者在重症医学科接受治疗的过程中频繁插入多个导管、经常因特殊治疗紧急置管、频繁使用接头、导管长时间留置、免疫功能低下及完全胃肠外营养等,均是导致CRBSI发生的主要危险因素[7-10]。我国重症医学科发生CRBSI的最常见致病菌为大肠埃希菌、肺炎克雷伯菌、表皮葡萄球菌、金黄色葡萄球菌和人葡萄球菌[10-11]。留置外周静脉导管的感染发生率最低约为1%,经颈内静脉或锁骨下静脉短暂置管的感染发生率约为3%~5%,用于血液透析的中心静脉导管感染发生率最高约为10%[7]。
CRBSI既是重症医学科致命的医源性感染,也是危重患者病情恶化、死亡的主要原因之一,但其是可预防的[12]。有效预防CRBSI是导管使用的前提,而重症感染防控策略是其治疗的基石。医务人员应认识到“防大于治”至关重要,没有感控就没有治疗的基础,更没有医疗安全可言。
CRBSI防控的核心技术包括:从细菌侵入血液机制着手,进行节点控制、封闭入路、阻断侵入途径;完善环境清洁及消毒,避免耐药菌交叉传播;合理使用抗生素,尽早恢复胃肠功能,保护肠道正常菌群;积极去除感染诱因,彻底清创,充分引流。本文阐述了CRBSI防控的核心技术,探讨如何在临床实践中落实防控措施以避免和减少CRBSI的发生,甚至使其零感染。
1 从细菌侵入血液机制着手,进行节点控制,封闭入路,阻断侵入途径
导管对皮肤屏障功能的破坏,导致细菌感染成为可能。从细菌侵入血液的机制(图1)可以看出[13],引发CRBSI的微生物可来自输液污染或(a)血流感染污染导管端口,但大部分来自于(b)患者的皮肤(60%),因缺乏皮肤消毒导致穿刺部位的皮肤细菌移行至皮下导管,或来自于(c)导管尾端接口(catheter hub)部位的污染(12%)。
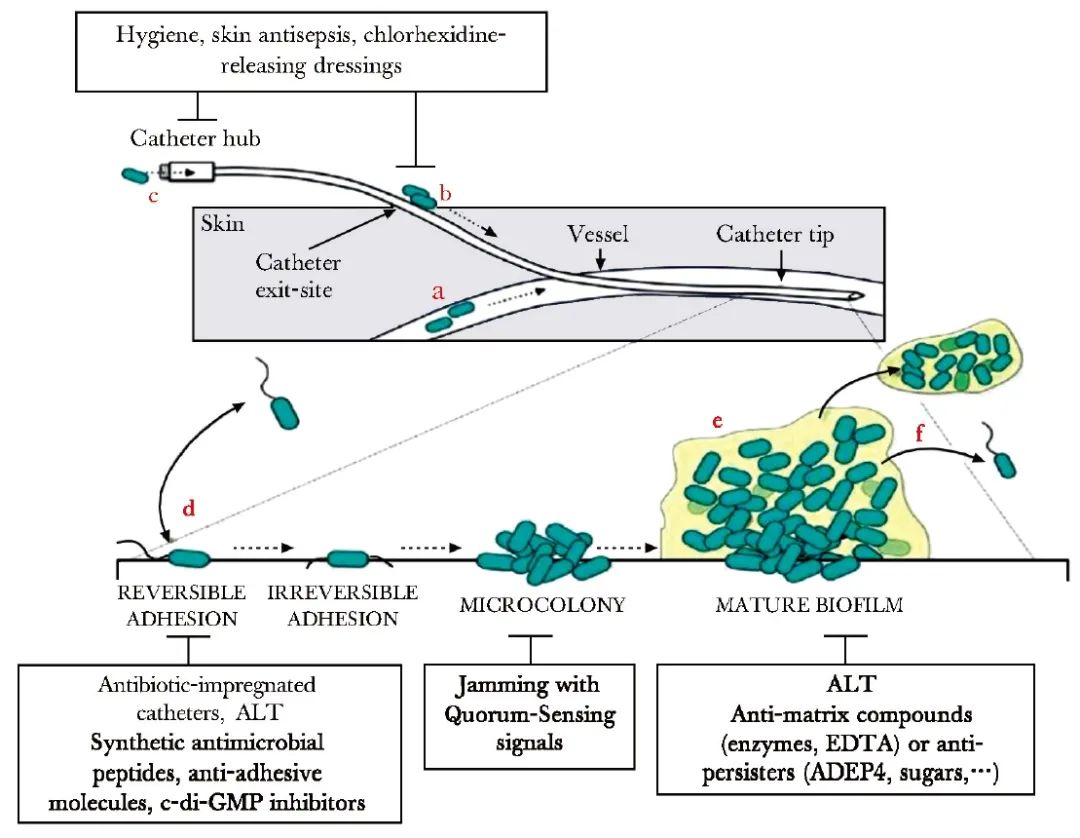
图1 细菌侵入血液的机制[13]
后两种途径的污染可引起细菌在导管腔外和腔内定植,微生物黏附于(d)导管表面,经繁殖后形成小菌落。通过矩阵生产和细菌群体感应信号,随后发展为成熟的(e)生物被膜。而(f)生物被膜碎片或个别细胞扩散,可造成血流感染,最终导致感染播散。导管表面微生物定植非常迅速,24 h内即可完成[14]。
导管置入0~4 h内,病原体黏附于导管表面生长;导管置入4 h后,微生物定植,继而生物被膜生成,病原菌弥散进入血液导致CRBSI。研究指出,在使用时间<14 d的导管中,细菌以导管外覆着为主(70%),沿导管外表面向外移行生长;在使用时间>14 d的导管中,细菌则以导管腔内覆着为主(20%~30%),在导管内移行和生长[15]。
目前,重症医学科的CRBSI预防方案已基本完善,并建立了中心静脉导管置入和维护过程中预防感染的国家标准[2]。本文以国家卫生健康委员会2021年发布的《血管导管相关感染预防与控制指南》[15]及美国感染性疾病学会2023年发布的《血管内导管相关感染诊断和处理的临床指南》[16]为依据,以制度为准绳,基于细菌侵入血液的机制对CRBSI进行核心防控,控制节点,封闭入路,阻断细菌通过导管开放侵入体内的途径。
监测、控制的节点具体包括以下方面:医务人员的手卫生、穿刺置管位置的选择、穿刺点皮肤的清洁及消毒、最大无菌化屏障的落实、穿刺点辅料的护理、导管尾端接口技术的改进和无菌操作及配液的质控。这些既是发生感染的重要环节,也是预防感染的关键环节。
对于重症医学科的CRBSI防控,医务人员明确知道应该做什么和怎么做,但为何其感染发生率依旧居高不下?面对上级主管部门的医院感染检查,医务人员常常能够顺利通过考核,但为何重症医学科的CRBSI仍然普遍存在?CRBSI真的防不胜防吗,还是防而不实?重症医学科的CRBSI零感染到底能否实现?这些问题值得深思和探讨。
内容与形式是辩证法的一对基本范畴。任何事物既有其内容,也有其形式,二者是辩证统一的。内容决定形式,形式则服从内容,并随内容的变化而变化。重症医学科临床工作中对于CRBSI的防控也存在内容和形式的体现,应坚持从内容出发,根据内容确定形式,而不能从形式出发,忽略内容的实质,必须根据医院感染防控的要求变换形式去落实内容。
1.1 手卫生的内容与形式
在手部皮肤定植菌中,通常80% 为非致病的常居菌(如凝固酶阴性葡萄球菌、棒状杆菌类、白假丝酵母菌、不动杆菌属等),20% 为来源于环境的暂居菌(如金黄色葡萄球菌、肠球菌、克雷伯杆菌、呼吸道病毒等),其与医院感染密切相关。
常居菌可通过皮肤脱屑或出汗等途径转化为暂居菌,暂居菌可通过长期皮肤污染,进入毛囊、汗腺和皮脂腺内,成为常居菌。加强手卫生管理可最大限度减少常居菌、消除暂居菌,从而达到感染防控的目的。重症医学科医务人员手部革兰阴性杆菌的携带率为80%,在执行操作过程中医务人员每分钟可获得16 cfu/cm2的细菌,一个简单的操作即可使手部细菌增加100~1000 cfu/cm2[17]。
医务人员手部的带菌量为108 cfu/cm2,一般情况下不致病,但对于免疫功能低下的患者,103 cfu/cm2甚至更少的带菌量即可致病[17]。且大多数革兰阴性杆菌引起的CRBSI,均是以医务人员的手为媒介将细菌传播至患者引起的,因此手卫生是一切感控措施有效实施的前提和基础。
手卫生的内容即手部要干净,包括普通洗手、卫生手消毒、外科手消毒。笔者对重症医学科医务人员随机进行了一次手卫生测试,在其洗手前后分别采集标本,并放置平板培养皿进行培养。结果显示:洗手前,10个培养皿培养出细菌,5个培养出真菌;而洗手后,培养皿的细菌数量明显下降,且2个培养皿未出现任何微生物,仅1个培养皿出现真菌。由此可见,手卫生对于感染防控至关重要。手卫生的形式体现在洗手的时间、工具、方式、监督措施、效果评价等。应从手卫生的形式去落实其内容,但在临床实践中,医护人员的手卫生依从性较差。
相关研究针对重症医学科医护人员的手卫生依从性现状进行调查,结果发现护士的手卫生依从性为67.8%,医生为62.9%,接触患者前手卫生的依从性为42%,接触患者后为63.2%[18]。研究表明,增加手卫生依从性与降低CRBSI发生率存在相关性[19]。因此,重症医学科医务人员应在多次感染暴发中反思手卫生的重要性。
为加强手卫生的依从性,除进行多方位监督(如同事、患者、监控、感控员及院感办监督等)外,还可借助多样化形式落实手卫生内容。研究表明,积极实施手卫生监督干预措施,每千导管日CRBSI发生率可由干预前的3.9‰下降至干预后的1.0‰(P<0.001),CRBSI的平均天数由干预前的9 d下降至干预后的6.5 d[20]。
1.2 最大无菌化屏障的内容与形式
最大无菌化屏障可明显降低CRBSI的发生率[21],其内容本质是无菌化,形式则包括全合一无菌包的使用时间、覆盖范围、使用方式等。临床工作中重症医学科医务人员在实施有创操作时,体现出对最大无菌化屏障的内容和形式不统一,忽视最大无菌化屏障及无菌操作,导致CRBSI的发生。医院感控部门检查与否或上级医师监督与否,有创操作时最大无菌化屏障及无菌操作流程的落实存在较大差别,这实际上是形式主义的突出表现,其本质是对感染防控内容在思想认识上的缺失。
1.3 导管穿刺的内容与形式
导管穿刺对于CRBSI的发生至关重要,其内容是导管穿刺和皮肤消毒,其形式是穿刺部位的选择、穿刺部位皮肤的消毒方法及消毒剂选择等。
1.3.1 导管穿刺
导管置入的常见位置为颈内静脉、锁骨下静脉和股静脉。选择穿刺位置时,除考虑穿刺相关机械损伤并发症(如气胸、血胸、血栓形成、误穿动脉)外,还应考虑穿刺部位的感染风险。研究表明,股静脉置管并发血流感染的发生率较颈内静脉及锁骨下静脉高[22]。
也有研究表明,股静脉置管并发血流感染的发生率低于颈内静脉[23]。临床情况复杂多变,在连续性肾脏替代治疗(CRRT)置管时,对于肥胖与瘦弱者、气管切开与否、导管穿刺位置选择是否一致,应具体问题具体分析,寻找最理想的穿刺部位。
此外,医务人员置管技术的熟练程度也是影响CRBSI发生的危险因素。研究发现,放置锁骨下静脉导管<50根的医生置管后发生导管性脓毒症的风险高于操作熟练医生的2倍以上[24]。对于困难置管,可变换形式落实内容,如反复穿刺3次均失败则应更换穿刺部位,或采用床旁二维超声、多普勒超声等定位引导技术实施血管穿刺,以增加操作的成功率,提高穿刺速度,减少穿刺引起的机械性损伤等并发症,有效避免因多次穿刺引发CRBSI[25]。
1.3.2 皮肤消毒
穿刺部位皮肤消毒前要视皮肤污染情况进行不同程度的清洁,彻底清洁是保证消毒效果的前提。对于皮肤消毒剂的选择,2%洗必泰、75%酒精、碘酊、次氯酸的消毒效果优于碘伏[26],且消毒剂需持续足够的作用时间以保证消毒效果,2%洗必泰、75%酒精及碘酊的作用时间仅30 s,而碘伏为1.5~2 min。
相较于其他消毒剂,2%洗必泰具有较强的广谱抑菌、杀菌作用,是一种较好的杀菌消毒剂,其对革兰阳性及阴性菌的杀菌效果更好,作用时间短,干燥速度快,残留作用更持久。但因洗必泰价格较高,临床可获得性低,故75%酒精的临床应用较广泛,其作用时间短,抗菌谱广,可杀死几乎所有细菌、真菌及大部分病毒。值得注意的是,不应形式上单纯追求对消毒剂的选择,还应关注每次消毒后的待干过程,不宜擦干、蘸干或吹干。若消毒剂未干透,则达不到彻底消毒效果,此时穿刺置管的直接后果是皮肤上的细菌污染导管尖端进而进入血管。
1.4 导管维护的内容与形式
导管维护的内容是无菌,而形式则是维护,包括敷料的选择、何时更换敷料、导管尾端接口的消毒等。国外大样本临床对照试验研究比较了透明敷料与纱布在预防外周静脉导管相关感染方面的作用,结果显示透明敷料组导管的细菌定植率为5.7%,纱布组为4.6%,两组间差异无显著统计学意义[27]。Meta分析研究显示,关于透明敷料与纱布对CRBSI发生率的影响,二者间差异无统计学意义[27]。
CRBSI防控指南指出,导管穿刺部位透明敷料出现任何出汗潮湿、渗血及移动,均应及时更换;导管暂时中断时应注意封管,减少导管口的暴露;注意保护管路,应安全固定,以防留置导管滑脱。导管维护的核心内容是无菌,但临床工作中经常出现固定工作、固定时间的形式化敷料更换操作,而对于随时出现的置管敷料处渗血、潮湿等情况,未能做到及时更换,使渗血处成为细菌营养丰富的培养基,导致CRBSI的发生。经导管端口静脉操作后未及时封闭端口,使得菌落数较多的头皮部位细菌极易经导管端口侵入血液,进而导致CRBSI。上述对于导管维护形式的忽视,是造成CRBSI发生的危险因素。
CRBSI防控指南明确指出了导管接头的维护方式,强调消毒时应多方位、用力摩擦15 s和待干。研究表明,分别采用未消毒、用力摩擦5 s、用力摩擦10 s和用力摩擦15 s四种操作方法维护导管接头,经荧光效应可观察到导管接头部的细菌菌落依次明显减少[28-29]。但用力摩擦15 s这一操作看似简单却很难落实,临床工作中一般仅用棉签轻擦数秒,这种流于形式的操作可能受抢救时争分夺秒等急救因素的影响,更多源于医护人员对无菌操作内容的忽视。实际上,应用消毒液棉片或棉球对导管接头部位多方位、用力摩擦的“榨柳橙式”操作,以及导管接头与消毒液的接触时间,比消毒剂种类的选择更为重要。
1.5 导管拔除的内容与形式
导管拔除的内容为阻断感染途径,形式为导管的评估、更换及抗菌导管的使用。导管留置时间是CRBSI的独立危险因素,留置时间越长其感染率越高[30-31]。重症状态导致机体防御机制的破坏是重症医学科医院感染的根本原因,积极救治重症患者使其尽快脱离危险状态是避免和治疗CRBSI的基础。同时,尽早拔除不必要的中心静脉导管也是预防CRBSI的重要措施,但客观上难以落实“尽早拔除”理念。
对于拔管时机,应实时评估导管情况,出现红、肿、热、痛、不通,或每次使用导管时患者均出现发热/发冷,应立即拔除导管,且重新置入导管时不建议在引导丝原位更换导管。在急救场景下,若无法保证无菌操作且又不能拔除导管,应立即给予经验性抗菌药物输注以作为补救措施。
此外,还应关注CRRT管路的凝血管理,避免因凝血产生不必要的停机、更换管路等操作,导致更多CRBSI的发生。CRBSI防控的关键在于导管的留置和使用,严格无菌操作是预防导管感染的关键,不提倡形式化预防性定期更换中心静脉导管,形式化定期更换导管并不能预防感染,反而会因多次置管操作增加CRBSI的发生机会。
对于抗感染导管的使用,指南推荐当预计置管时间超过5 d时,建议使用洗必泰/磺胺嘧啶银或四环素/利福平涂层的CVC导管(IA类推荐)[20]。相关研究证实,洗必泰涂层的CVC导管可显著降低常见耐药菌的定植,具有明显的抑菌效果[32],并可显著抑制导管生物被膜的形成,效果可持续5周,减少重症医学科内79%的CRBSI[33]。
1.6 配液输液质控的内容与形式
配液输液质控的内容是无菌配液,形式为配液方式。医院的配液中心及重症医学科的无菌配液室是配液输液质控的保障。但在临床工作中,重症医学科重症患者的紧急治疗随时出现,仍需自主配液,在药物配置过程中多次加药及穿刺均可导致微粒污染,极易发生交叉感染,经导管输注后可出现血流感染的暴发。据英国医院肿瘤科、重症医学科和透析室的研究数据显示,护士采用无菌空针从单剂量瓶溶液中抽吸药液并注射至配置的沖洗液中,其污染概率高达 8%[34]。
2 严格遵守接触隔离,完善环境清洁消毒,降低菌负荷,避免耐药菌交叉传播
多重耐药菌因习性不同,传播机制亦存在差异,主要应对方式为加强监测及严格遵守接触隔离,完善环境清洁及消毒,降低菌负荷,避免耐药菌交叉传播,以降低CRBSI防治的难度,改善患者预后。人体全身各部位均存在大量常驻菌,以腋窝处最多,其次为头发及头皮部位,常驻菌多为葡萄球菌、丙酸杆菌等。对于CRBSI的防控,还应关注如何降低菌负荷,如每日更换床单,每周更换所有被服,每周床上洗头及适度理发等。若定植菌负荷降低,即使常驻菌污染了导管,可能因菌量少而暂不发生CRBSI。
3 合理应用抗生素,尽早启动胃肠功能,保护正常菌群
重症医学科多重耐药菌的产生存在抗生素诱导、筛选等因素。因此,抗菌药物的使用应尽可能做到合理,降低其对多重耐药菌的筛选压力,同时避免诱导新的耐药菌产生。无论是预防用药还是治疗用药,明确的指征、确切的诊断、规范的评估是精准使用抗感染药物的基础。对于突发的寒战高热,建议规范留取血培养标本并及时送检,积极进行降温处理,合理应用抗生素,避免不必要的抗生素使用进而诱导耐药菌产生,一旦发现疑似CRBSI,应立即启用具有杀菌活性的抗菌药物治疗[35]。同时,应尽早恢复胃肠功能,促进胃肠动力,维持肠道菌群平衡,避免耐药菌的筛选。需注意的是,抗感染药物的应用仅是CRBSI治疗过程的一个环节,做好医院感染防控可避免CRBSI的重复发生。
4 积极寻找并去除感染诱因,彻底清创,充分引流
若患者感染持续存在,需考虑其他感染灶存在的可能,积极应用影像学和外科手术等方式,寻找并去除其他感染灶,彻底清创,充分引流,避免感染播散至血流,导致细菌覆着在导管端口引起CRBSI。
重症医学科感染与重症如影随形,无论起因是否源于感染,重症患者的感染问题均贯穿病程始终。没有无缘无故的感染,更没有无缘无故的重症感染,追本溯源,关注交叉感染及屏障功能破坏是关键。皮肤黏膜结构和功能的破坏是发生CRBSI的主要始动因素,而感染控制的缺失则是CRBSI发生的根本原因。重症医学科多个导管的置入和频繁使用,破坏了患者皮肤黏膜的屏障保护作用,导致CRBSI的易感性增加。故由CRBSI引发的重症感染治疗有别于其他普通感染,在应用抗菌药物治疗的同时应更多关注感染控制措施的落实,提高CRBSI引发重症感染的治愈率。
需特别注意,导管穿刺造成屏障破坏并不意味着感染一定会发生,重症医学科发生CRBSI说明中心静脉导管在置管和使用过程中无菌操作存在缺陷,应针对相应操作过程查找原因。实施每项医疗护理操作均应遵循感染控制原则,重点关注CRBSI核心感染控制措施的落实情况,从而有效预防和避免CRBSI的发生。
5 小结
面对重症医学科患者的CRBSI,医护人员应时刻进行灵魂拷问:你意识到该做什么了吗?你真的做了该做的吗?你真的做到了该做的吗?除结果导向外,CRBSI防控更应强调过程管理,通过多种方法让医疗护理操作符合既定的感染控制标准,做到知行合一。只有感染控制核心技术得到彻底落实,CRBSI的发生率才能彻底降低,甚至实现CRBSI零感染。多学科诊疗团队的共同参与和努力,管理者的重视、医护的责任心、防控意识的提升、感染控制培训的加强、防控制度的执行和监督等,优化整个感染控制过程,在临床实践中切实落实各项规范,使整个CRBSI防控形成闭环管理,实现CRBSI零感染将不是梦!
参考文献
[1]Hollenbeak C S. The cost of catheter-related bloodstream infections: implications for the value of prevention[J]. J Infus Nurs, 2011, 34(5): 309-313.
[2]中华人民共和国国家卫生和计划生育委员会. 重症监护病房医院感染预防与控制规范: WS/T 509-2016[S]. 北京: 中国标准出版社, 2017.
[3]Centers for Disease Control and Prevention. 2016 National and state healthcare-associated infections progress report[R/OL]. [2024-02-06]. https://www.cdc.gov/hai/pdfs/progress-report/2016-Progress-Report-Executive-Summary-H.pdf.
[4]Centers for Disease Control and Prevention (CDC). Vital signs: central line-associated blood stream infections--United States, 2001, 2008, and 2009[J]. MMWR Morb Mortal Wkly Rep, 2011, 60(8): 243-248.
[5]O'Grady N P, Alexander M, Burns L A, et al. Guidelines for the prevention of intravascular catheter-related infections, 2011[M/OL]. [2024-02-06]. https://www.cdc.gov/hai/pdfs/bsi-guidelines-2011.pdf.
[6]李骏, 喻莉, 杨军辉, 等. 重症医学科中心静脉导管相关性血流感染的调查及危险因素分析[J]. 中华医学杂志, 2015, 95(9): 659-662.
[7]王淑颖, 聂世姣, 费莹, 等. 患者导管相关性血流感染的病原学变化研究[J]. 中华医院感染学杂志, 2016, 26(11): 2510-2512.
[8]中国心胸血管麻醉学会围术期感染控制分会. 麻醉科导管相关性血流感染预防专家共识[J]. 中华医学杂志, 2023, 103(23): 1733-1738.
[9]European Centre for Disease Prevention and Control. Healthcare-associated infections in intensive care units-annual epidemiological report for 2017[R]. Stockholm: ECDC, 2019.
[10]陈云波, 嵇金如, 应超群, 等. 2020年全国血流感染细菌耐药监测 (BRICS) 报告[J]. 中华临床感染病杂志, 2021, 14(6): 413-426.
[11]中国细菌耐药监测网. 2019年CHINET中国细菌耐药监测结果[EB/OL].[2024-02-06]. http://www.chinets.com.
[12]Zimlichman E, Henderson D, Tamir O, et al. Health care-associated infections: a meta-analysis of costs and financial impact on the US health care system[J]. JAMA Intern Med, 2013, 173(22): 2039-2046.
[13]Beloin C, Fernández-Hidalgo N, Lebeaux D. Understanding biofilm formation in intravascular device-related infections[J]. Intensive Care Med, 2017, 43(3): 443-446.
[14]Safdar N, Maki D G. The pathogenesis of catheter-related bloodstream infection with noncuffed short-term central venous catheters[J]. Intensive Care Med, 2004, 30(1): 62-67.
[15]中华人民共和国国家卫生健康委员会. 国家卫生健康委办公厅关于印发血管导管相关感染预防与控制指南 (2021年版) 的通知[EB/OL]. (2021-03-30)[2024-02-06]. http://www.nhc.gov.cn/yzygj/s7659/202103/dad04cf7992e472d9de1fe6847797e49.shtml.
[16]美国感染性疾病学会. 血管内导管相关感染诊断和处理的临床指南[EB/OL]. [2024-02-06]. http://wenku.so.com.
[17]中华人民共和国国家卫生健康委员会. 医务人员手卫生规范: WS/T 313-2019[S]. 北京: 中国标准出版社, 2019.
[18]刘素球, 粟尤菊, 赵旻奕. 手卫生目标管理效果分析[J]. 中华医院感染学杂志, 2010, 20(15): 2274-2276.
[19]Van Der Kooi T, Sax H, Pittet D, et al. Prevention of hospital infections by intervention and training (PROHIBIT): results of a pan-European cluster-randomized multicentre study to reduce central venous catheter-related bloodstream infections[J]. Intensive Care Med, 2018, 44(1): 48-60.
[20]Hentrich M, Schalk E, Schmidt-Hieber M, et al. Central venous catheter-related infections in hematology and oncology: 2012 updated guidelines on diagnosis, manage-ment and prevention by the Infectious Diseases Working Party of the German Society of Hematology and Medical Oncology[J]. Ann Oncol, 2014, 25(5): 936-947.
[21]Carrer S, Bocchi A, Bortolotti M, et al. Effect of different sterile barrier precautions and central venous catheter dressing on the skin colonization around the insertion site[J]. Minerva Anestesiol, 2005, 71(5): 197-206.
[22]潘海燕, 任蔚虹. 导管相关性血流感染预防和控制的研究进展[J]. 中华护理杂志, 2009, 44(10): 900-902.
[23]Parienti J J, Mongardon N, Mégarbane B, et al. Intrava-scular complications of central venous catheterization by insertion site[J]. N Engl J Med, 2015, 373(13): 1220-1229.
[24]Deshpande K S, Hatem C, Ulrich H L, et al. The incidence of infectious complications of central venous catheters at the subclavian, internal jugular, and femoral sites in an intensive care unit population[J]. Crit Care Med, 2005, 33(1): 13-20.
[25]Hind D, Calvert N, McWilliams R, et al. Ultrasonic locating devices for central venous cannulation: meta-analysis[J]. BMJ, 2003, 327(7411): 361.
[26]Chaiyakunapruk N, Veenstra D L, Lipsky B A, et al. Chlorhexidine compared with povidone-iodine solution for vascular catheter-site care: a meta-analysis[J]. Ann Intern Med, 2002, 136(11): 792-801.
[27]O'Grady N P, Alexander M, Dellinger E P, et al. Guidelines for the prevention of intravascular catheter-related infections[J]. Clin Infect Dis, 2002, 35(11): 1281-1307.
[28]Düzkaya D S, Sahiner N C, Uysal G, et al. Chlorhexidine-impregnated dressings and prevention of catheter-associated bloodstream infections in a pediatric intensive care unit[J]. Crit Care Nurse, 2016, 36(6): e1-e7.
[29]Ryder M A. Catheter-related infections: it's all about biofilm[J]. Top Adv Pract Nurs eJournal, 2005, 5(3): 1-15.
[30]吴守宇. ICU住院患者导管置入与院内感染发生关系的研究[J]. 中国医疗前沿, 2012, 7(24): 69-70.
[31]Chen I C, Hsu C, Chen Y C, et al. Predictors of blood-stream infection associated with permanently implantable venous port in solid cancer patients[J]. Ann Oncol, 2013, 24(2): 463-468.
[32]Mansouri M D, Opperman T J, Williams J D, et al. In vitro potency and in vitro efficacy of a novel bis-indole antimicrobial compound in reducing catheter colonization[J]. Antimicrob Agents Chemother, 2012, 56(4): 2201-2204.
[33]Tran P L, Lowry N, Campbell T, et al. An organoselenium compound inhibits Staphylococcus aureus biofilms on hemodialysis catheters in vitro[J]. Antimicrob Agents Chemother, 2012, 56(2): 972-978.
[34]Hopman J, Tostmann A, Wertheim H, et al. Reduced rate of intensive care unit acquired gram-negative bacilli after removal of sinks and introduction of ‘water-free’ patient care[J]. Antimicrob Resist Infect Control, 2017, 6: 59.
[35]Chaves F, Garnacho-Montero J, Del Pozo J L, et al. Executive summary: diagnosis and treatment of catheter-related bloodstream infection: clinical guidelines of the Spanish Society of Clinical Microbiology and Infectious Diseases (SEIMC) and the Spanish Society of Intensive Care Medicine and Coronary Units (SEMICYUC)[J]. Enferm Infecc Microbiol Clin, 2018, 36(2): 112-119.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#重症医学科# #导管相关血流感染# #RBSI防控#
26