Circ Res 季勇团队首次发现GSNOR的线粒体定位并揭示线粒体GSNOR在心力衰竭中的重要保护作用
2023-07-09 季勇课题组 论道心血管 发表于上海
该研究揭示了心肌重构等相关心血管疾病发病新机制,为相关疾病的预防、治疗提供了新的理论依据和潜在治疗靶标。
气体信号分子作为重要的生物活性小分子,广泛参与病理生理学过程。越来越多的研究表明,其可介导蛋白质翻译后修饰参与靶蛋白功能调控,研究者前期研究已证实气体信号分子介导的蛋白质巯基修饰参与多种心血管疾病进程【1-3】。其中,气体信号分子一氧化氮介导的蛋白质巯基亚硝基化修饰通过影响靶蛋白的结构、活性、定位和蛋白质/蛋白质相互作用等功能在多种疾病过程中发挥重要作用。研究者前期研究发现,MLP巯基亚硝基化修饰可通过激活TLR3/炎症小体信号通路,促进心肌细胞炎症反应,加速心肌肥厚,此研究结果2020年1月发表在Circulation杂志【3】。该研究发现了心肌肥厚中调控MLP巯基亚硝基化修饰的酶是谷胱甘肽还原酶(S-nitrosoglutathione reductase, GSNOR)。GSNOR是一种去巯基亚硝基化修饰蛋白,在心肌肥厚时,其表达降低促进靶蛋白巯基亚硝基化修饰水平增加,促进心肌肥厚。以往认为GSNOR主要是一种定位于胞浆的蛋白质,通过利用GSNOR心肌特异性敲除小鼠构建心肌重构模型时发现GSNOR敲除会显著加重线粒体功能和结构紊乱,但是其线粒体的调控作用及方式仍不清楚。
2023年6月28日,南京医科大学/哈尔滨医科大学季勇教授团队在Circulation Research杂志上发表题为“Mitochondrial GSNOR Alleviates Cardiac Dysfunction via ANT1 Denitrosylation”的研究论文,首次发现GSNOR在心肌细胞线粒体定位,并明确线粒体GSNOR通过调控线粒体蛋白ANT1的巯基亚硝基化修饰影响线粒体功能,参与心肌重构和心衰进程。该研究揭示了心肌重构等相关心血管疾病发病新机制,为相关疾病的预防、治疗提供了新的理论依据和潜在治疗靶标。

首先,研究者在心衰病人和非心衰病人的心肌组织中检测GSNOR的表达水平,发现GSNOR在心衰病人的心肌组织中表达显著降低。为了探究GSNOR表达下调在心肌重构中的作用,研究者构建了GSNOR心肌特异性敲除小鼠,发现敲除GNSOR进一步加重主动脉缩窄术(TAC)诱导的小鼠心肌重构和心衰。电镜观察小鼠心脏显示,敲除GSNOR加重线粒体结构紊乱。
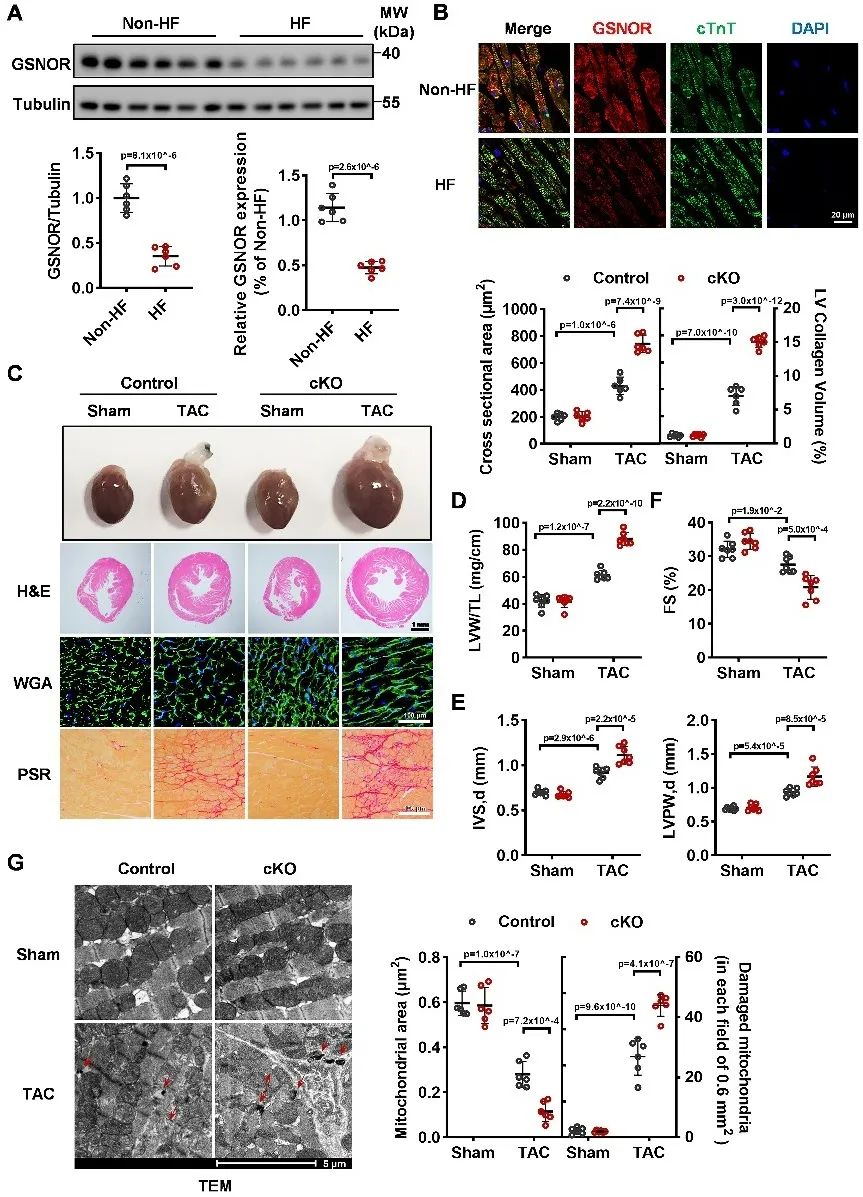
接着,为了探索GSNOR对线粒体的调控作用,研究者对心肌细胞GSNOR和线粒体共染,首次发现GSNOR存在线粒体定位,并利用免疫荧光、线粒体胞浆分离、线粒体快速富集和胶体金实验论证GSNOR线粒体定位。
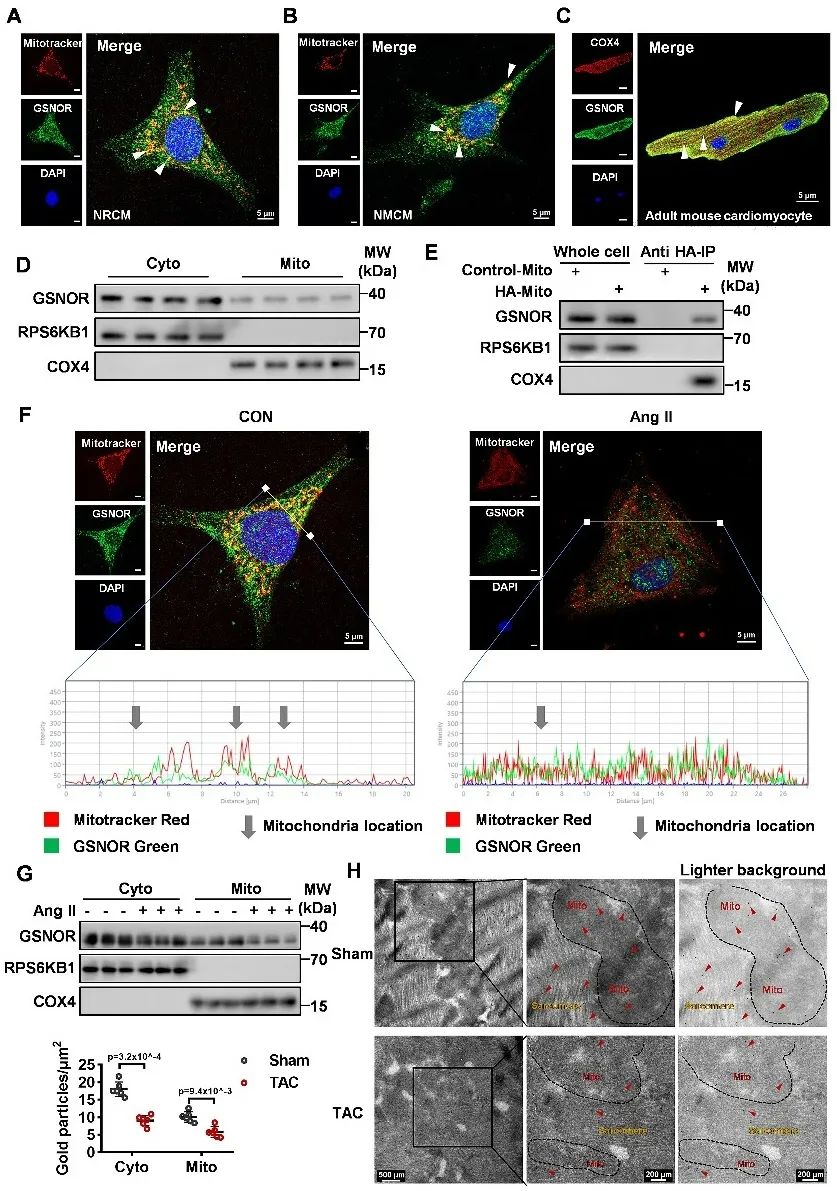
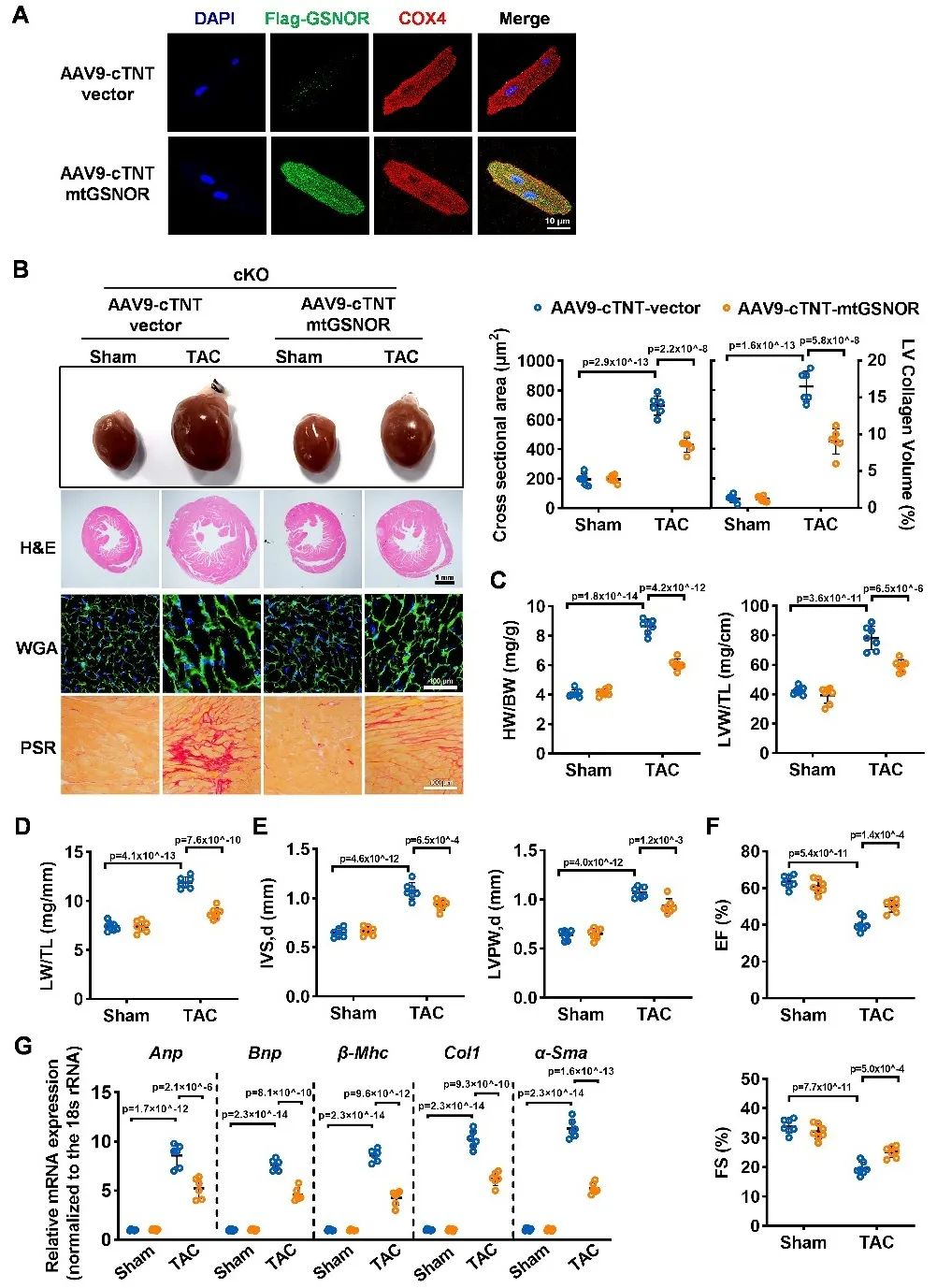
同时,在GSNOR心肌特异性敲除小鼠心肌细胞中过表达带有线粒体定位序列的GSNOR,可以减轻TAC诱导的心肌重构和心衰,保护线粒体功能。
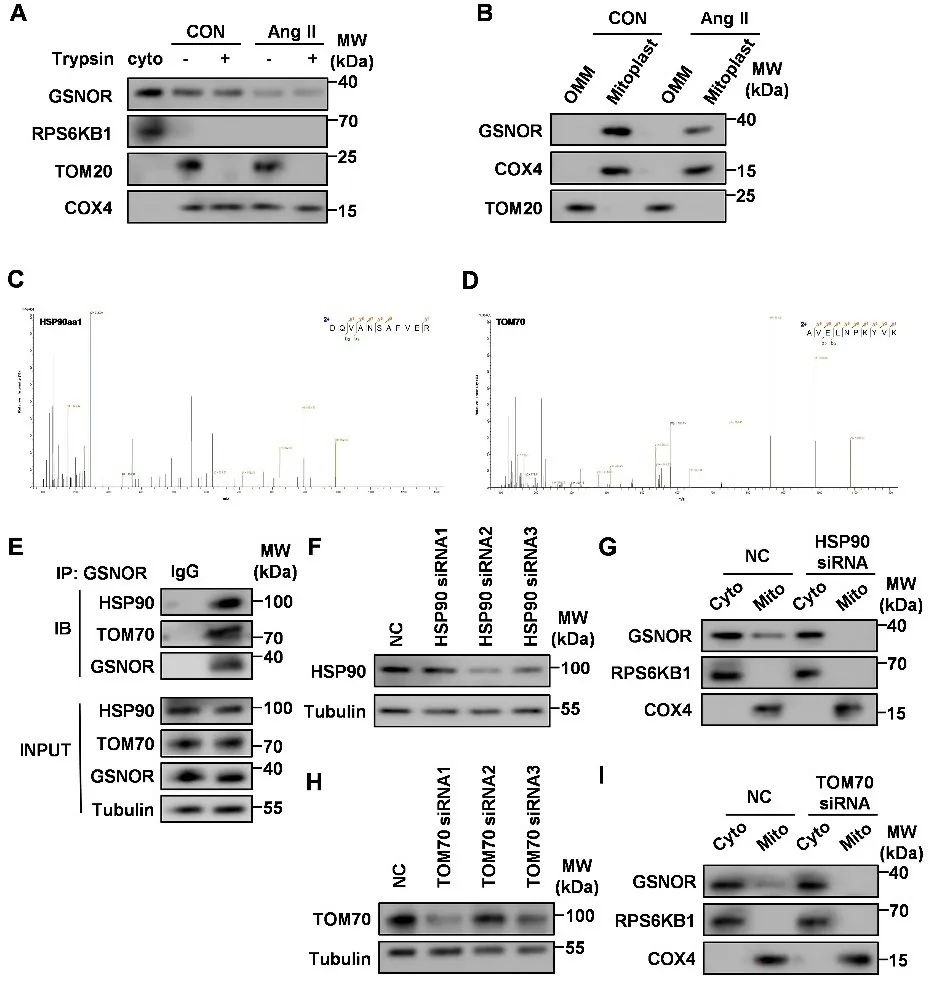
明确GSNOR的线粒体保护作用后,研究者进一步探究GSNOR如何进入线粒体。研究者通过质谱筛选和验证了GSNOR进入线粒体是通过与HSP90相互作用、穿过TOM70转运到线粒体内膜或基质中。
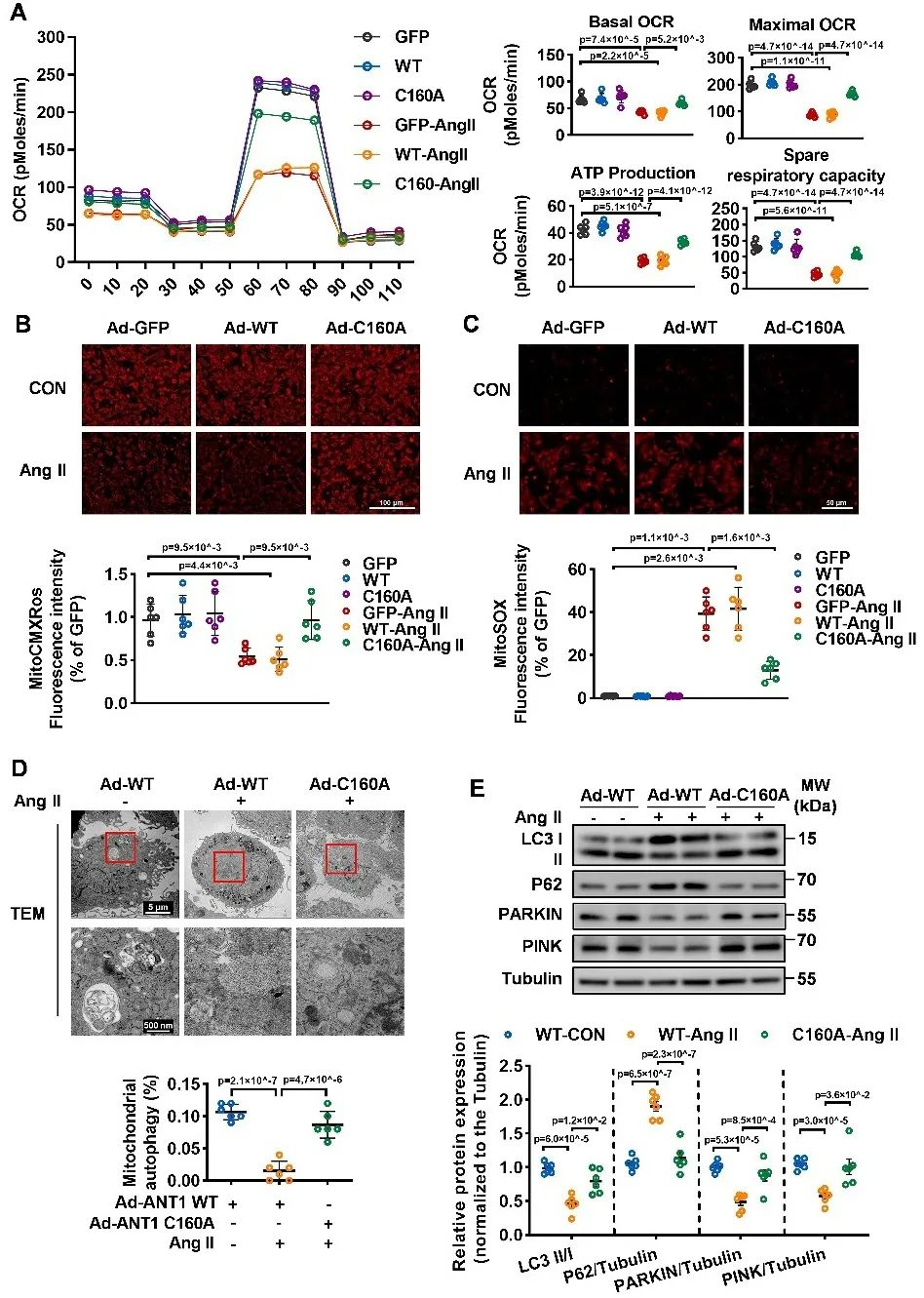
研究者进一步利用Biotin-Switch联合质谱、生物信息学及特异性半胱氨酸位点突变等技术,明确线粒体GSNOR介导腺嘌呤核苷酸转位酶1(ANT1)的去巯基亚硝基化修饰在心肌重构和心衰中发挥重要保护作用。其中,ANT1的修饰位点是半胱氨酸160位点。ANT1定位于线粒体内膜,其对于线粒体ATP/ADP转运、线粒体膜通透性转换孔的开放、线粒体膜电势的维持和线粒体自噬等生理功能具有重要的调控作用。研究者发现在病理刺激下,GSNOR线粒体表达下调,促进ANT1巯基亚硝基化修饰,抑制ANT1功能,破坏线粒体膜电势,抑制ATP生成,增加线粒体氧化应激并抑制线粒体自噬,最终导致心肌重构和心衰。
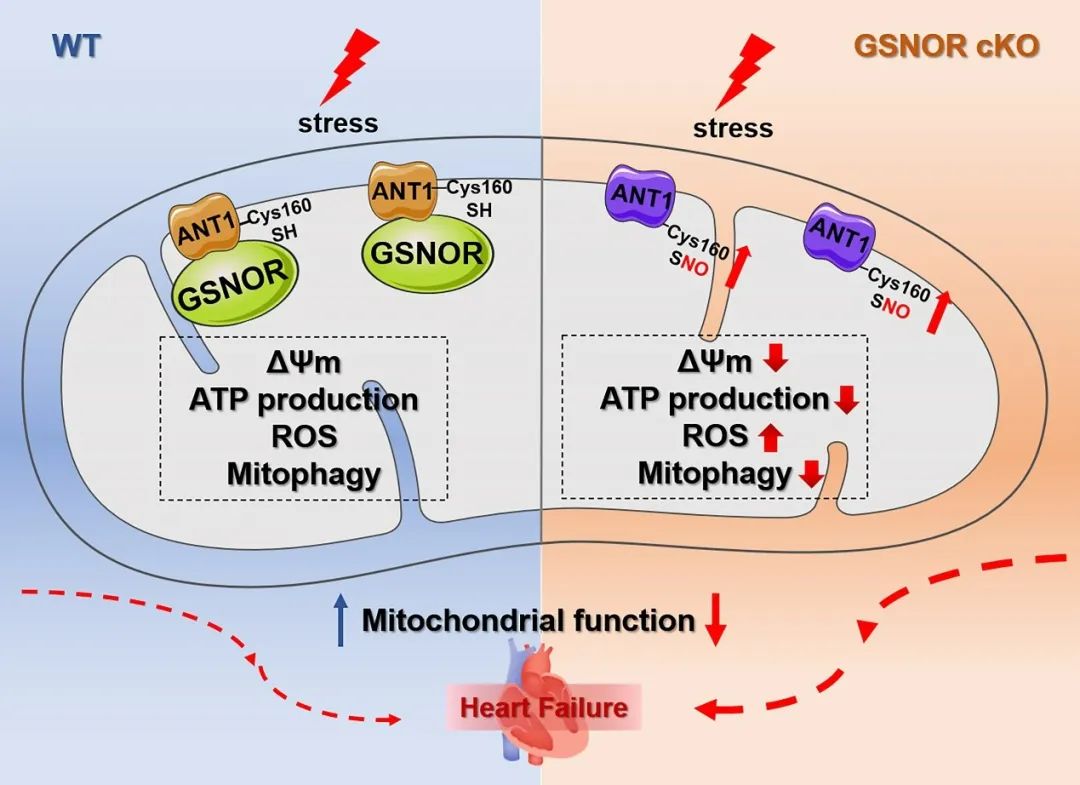
综上,本研究揭示了新的GSNOR亚细胞定位,并探索线粒体定位的GSNOR通过调控ANT1的巯基亚硝基化修饰对线粒体发挥重要的保护作用,为相关心血管疾病预防和治疗提供了新的理论依据和潜在治疗靶点。
本研究由南京医科大学/哈尔滨医科大学季勇教授团队与南京医科大学第一附属医院韩艺教授、厦门大学附属第一医院黄峥嵘教授、南京医科大学基础医学院谢利平教授共同合作完成。南京医科大学药学院心脑血管药物重点实验室唐欣副教授、赵爽副教授及刘洁琼博士为该论文共同第一作者。该工作得到了南京医科大学陈绍良教授、王连生教授、陈鑫教授、顾爱华教授、陈峰教授、陈宏山教授、高原青教授,南京大学医学院附属鼓楼医院王东进教授,哈尔滨医科大学于波教授、张志仁教授和上海交通大学医学院仁济医院卜军教授的大力支持。同时得到南京医科大学公共卫生学院陈峰教授、张汝阳副教授和外国语学院饶辉教授的支持。该项研究获得国家自然科学基金创新研究群体及重点项目、科技部重点研发计划等项目的资助。
参考文献:
1. Shanshan Luo, Chuiyu Kong, Shuang Zhao, Xin Tang, Yu Wang, Xuechun Zhou, Rui Li, Xingeng Liu, Xinlong Tang, Shixiu Sun, Wei Xie, Zhi-Ren Zhang, Qing Jing, Aihua Gu, Feng Chen, Dongjin Wang, Hong Wang, Yi Han, Liping Xie and Yong Ji.Endothelial HDAC1-ZEB2-NuRD Complex Drives Aortic Aneurysm and Disp Through Regulation of Protein S-Sulfhydration. Circulation. 2023 May 2;147(18):1382-1403. doi: 10.1161/CIRCULATIONAHA.122.062743.
2. Zhe Lin, Shuang Zhao, Xuesong Li, Zian Miao, Jiawei Cao, Yurong Chen, Zhiguang Shi, Jia Zhang, Dongjin Wang, Shaoliang Chen, Liansheng Wang, Aihua Gu, Feng Chen, Tao Yang, Kangyun Sun, Yi Han, Liping Xie, Hongshan Chen, Yong Ji. Cathepsin B S-nitrosylation promotes ADAR1-mediated editing of its own mRNA transcript via an ADD1/MATR3 regulatory axis. Cell Res. 2023 May 8. doi: 10.1038/s41422-023-00812-4.
3. Xin Tang, Lihong Pan, Shuang Zhao, Feiyue Dai, Menglin Chao, Hong Jiang, Xuesong Li, Zhe Lin, Zhengrong Huang, Guoliang Meng, Chun Wang, Chan Chen, Jin Liu, Xin Wang, Albert Ferro, Hong Wang, Hongshan Chen, Yuanqing Gao, Qiulun Lu, Liping Xie, Yi Han and Yong Ji. S-Nitrosylation of Muscle LIM Protein Facilitates Myocardial Hypertrophy Through Toll-Like Receptor 3-Mediated Receptor-Interacting Protein Kinase 3 and NLRP3 Inflammasome Activation. Circulation. 2020 Mar 24;141(12):984-1000. doi: 10.1161/CIRCULATIONAHA.119.042336.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言