FDA批准候选药物lanifibranor进入III期临床,以治疗非酒精性脂肪性肝炎(NASH)
2020-11-11 Allan MedSci原创
生物制药公司Inventiva致力于开发口服小分子疗法,用于治疗非酒精性脂肪性肝炎(NASH)。
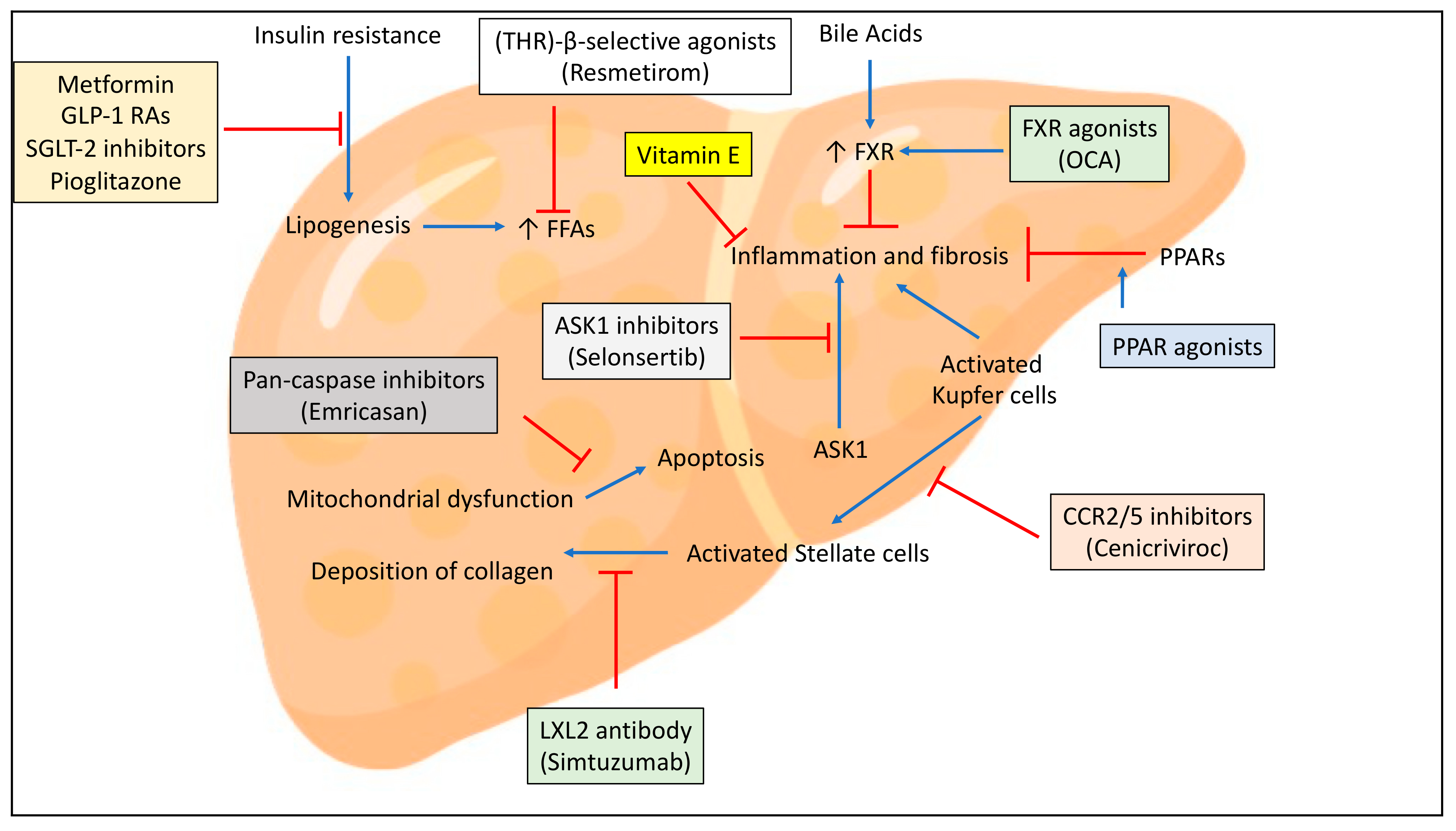
非酒精性脂肪肝病是一类临床-组织病理学疾病,它具有类似酒精性肝损伤的组织学特征,但根据定义其发生于基本没有饮酒史的患者。生物制药公司Inventiva致力于开发口服小分子疗法,用于治疗非酒精性脂肪性肝炎(NASH)。继2020年6月公布了NATIVE IIb期临床试验的阳性结果后,Inventiva今日公布了与美国食品药品监督管理局(FDA)的会议结果:FDA表示Inventiva进行一项关键性III期临床试验的临床策略可能足以支持新药申请(NDA)。

III期试验的准备工作正在按计划进行,Inventiva将在收到欧洲药品管理局(EMA)的监管反馈后,告知该试验的详细情况。预计试验将于2020年第四季度开始。
鉴于FDA的积极意见是基于lanifibranor在NATIVE IIb临床试验中取得的阳性顶线结果,lanifibranor也于今年10月被FDA指定为“突破性疗法”。
原始出处:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#候选药物#
71
#I期临床#
75
#III#
62
#脂肪性肝炎#
74
#非酒精性#
72
#酒精性#
54
#非酒精性脂肪性肝炎(NASH)#
53
#FDA批准#
65
#脂肪性#
55
#ASH#
81