【论肿道麻】癌症相关成纤维细胞与调控性细胞死亡之间的串扰:对细胞凋亡、自噬、铁死亡和细胞焦亡的洞见
2024-08-29 古麻今醉网 古麻今醉网 发表于上海
作者揭示了肿瘤微环境中的CAF与RCD之间复杂性与相互作用,并着重阐述了与细胞凋亡、自噬、铁死亡和细胞焦亡相关的RCD。
肿瘤微环境(TME)是由一组细胞和非细胞分子成分组成的复杂而动态的生态系统,在肿瘤的发生、发展和治疗反应中起着至关重要的作用。癌症相关成纤维细胞(CAF)被确定为TME中的主要基质成分,表现出促进肿瘤发展的独特特征和行为。CAF可以通过细胞间接触与肿瘤细胞或其他基质细胞相互作用,分泌多种调节介质,并重塑细胞外基质(ECM)的结构。在临床上,CAF还与肿瘤的临床病理特征有关,可作为诊断、治疗和预后预测的潜在生物标志物。活化的CAF可以调节邻近肿瘤细胞中的调控性细胞死亡(RCD),这对癌症增殖、治疗耐药性和免疫排斥具有重要意义。2024年4月《Cell Death Discovery》杂志(IF:7.0)上发表了一篇名为《Crosstalk between cancer-associated fifibroblasts and regulated cell death in tumors: insights into apoptosis, autophagy, ferroptosis, and pyroptosis》的综述。作者揭示了肿瘤微环境中的CAF与RCD之间复杂性与相互作用,并着重阐述了与细胞凋亡、自噬、铁死亡和细胞焦亡相关的RCD。
1. CAFS的特性
在正常组织中,成纤维细胞是间充质衍生的静止细胞,通常嵌入纤维状ECM中。在伤口愈合、组织炎症和器官纤维化过程中,它们可以以依赖于环境的方式进行短暂激活,这在维持组织稳态方面发挥着重要作用。然而,反复损伤或持续的炎症和压力可能会导致成纤维细胞持续激活。在癌症中,这种过度活化的成纤维细胞亚群可称为CAF。
CAFs的潜在细胞来源包括静止组织驻留的成纤维细胞、骨髓来源的成纤维细胞和间充质干细胞(MSC)、内皮细胞、上皮细胞以及通过转分化衍生的其他细胞(周细胞、平滑肌细胞和脂肪细胞)。因其来源的多样性,很难准确对CAFs的特定亚群进行分类并与正常成纤维细胞(NF)区分开来。目前最新的研究证据表明可通过不同生物标志物,如α-SMA、Vimentin、S100A4、FAP、PDGFRα/β、Caveolin-1和podoplanin(PDPN)等组合来评估。值得注意的是,这些所谓的生物标志物在不同肿瘤组织中也表现出差异性,并随着肿瘤进展而表现出动态变化,使得针对性干预CAFs更加困难。因此,精确的分类策略和有效识别CAFs中的生物标志物需要进一步深入研究(图1)。
目前的研究表明,与正常成纤维细胞(NF)相比,CAF表现出许多恶性特性。CAF分泌的促肿瘤发生因子可以通过旁分泌信号传导和外泌体介导的途径转移到肿瘤细胞中,从而促进癌细胞的干细胞化、增殖和迁移。CAF还通过分泌促血管生成因子(如VEGFA、CXCL12、FGF2和PDGFC)来刺激肿瘤血管生成。CAF介导的促肿瘤发生过程中涉及的复杂信号通路ECM/TME重塑及其对治疗耐药性和免疫抑制的贡献。尽管CAF发挥着强大的促肿瘤发生作用,但在胰腺癌中CAF的耗竭会导致肿瘤细胞进展和TME抑制,表明某些CAF亚型具有抑癌特性。因此,CAF的影响各不相同,在某些情况下会对致癌过程表现出相反的影响(图1),全面了解CAF亚型的促肿瘤和抑癌活性可能有助于开发新的诊断和治疗方法。
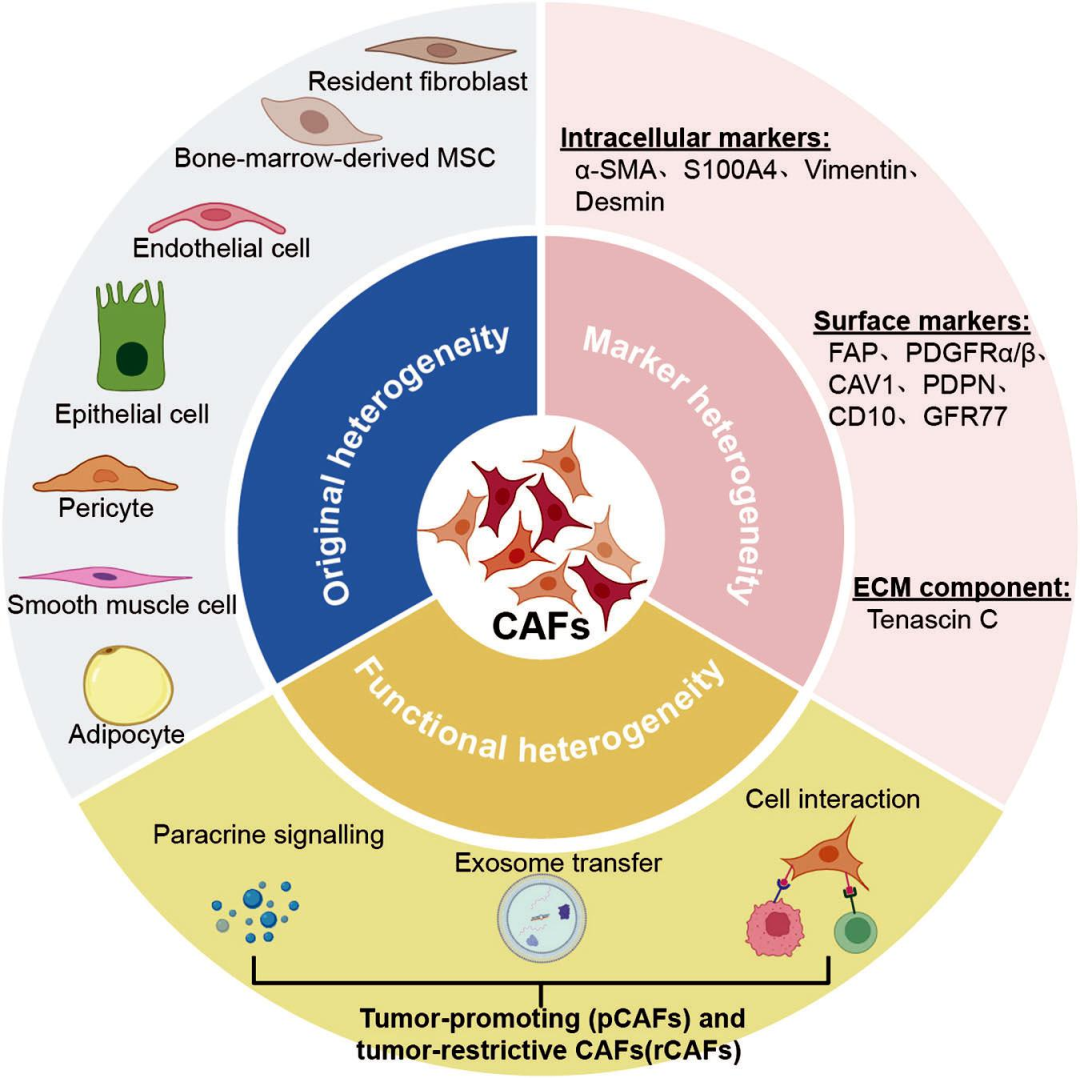
图1 CAF的来源、生物标志物和功能异质性
2. CAFS对RCD的影响
随着细胞死亡研究领域的发展,细胞死亡命名委员会(NCCD)于2018年从形态学、生化和功能角度提出了细胞死亡的最新定义和分类。与意外细胞死亡(ACD)相比,RCD的特点是受控信号通路,在维持体内平衡和疾病进展中起着至关重要的作用。根据其不同的生理和病理机制,RCD可进一步细分为凋亡和非凋亡亚类,例如自噬依赖性细胞死亡、铁死亡、细胞焦亡和坏死性凋亡。
2.1 CAFS对肿瘤细胞凋亡的影响
细胞凋亡是研究最深入的RCD,其通常具有独特的形态学特征,包括细胞收缩、染色质凝聚、核碎裂、膜起泡和凋亡小体形成。细胞凋亡主要通过两种典型途径发生:内在(线粒体)途径和外在(细胞死亡受体)途径。细胞凋亡失调是维持和调节癌症发展的经典标志之一。目前,大量研究已经阐明了CAFs通过调节细胞凋亡在癌症的发生和发展中的作用。
在结直肠癌(CRC)中,外泌体将miRNA(miR-224-5p、miR-181b-3p和miR-135b-5p)和circRNA(circN4BP2L2和circSLC7A6)从CAFs转运到癌细胞中,作为细胞凋亡的抑制剂并促进CRC的发病机制。此外,CAFs分泌的IL-6导致CRC中BCL-XL和MCL-1的上调,同时促进细胞凋亡抵抗;然而,促凋亡和抗凋亡BCL2蛋白家族(BCL-2、BCL-XL、BCL-w、MCL-1和BCL-2A1)之间的动态相互作用平衡了细胞凋亡的进程。在雌激素受体阳性乳腺癌中,也已证实CAFs以IL-6依赖的方式促进MCL-1表达和细胞凋亡抵抗。此外,Bian等人从口腔舌鳞状癌组织中提取了CAFs。他们的研究表明,CAFs通过旁分泌Mig上调BCL-2的表达并抑制热诱导的细胞凋亡。此外,已证实肺鳞状细胞癌(LUSC)衍生的CAF可在体内和体外增强细胞增殖并抑制细胞凋亡。这种影响与CAF中COL10A1表达的上调有关。
许多癌症治疗,如化疗和放射疗法,都是通过诱导癌细胞凋亡来发挥作用的。在肺癌中,CAFs通过分泌可溶性因子和外泌体来抑制细胞凋亡程序并增强化学抗性。同样,其他癌症的研究也表明,CAFs通过抑制细胞凋亡水平来促进肿瘤细胞的放射抗性。上述数据表明,CAFs可以提高肿瘤细胞凋亡的阈值,有助于肿瘤的发展和治疗耐药性的产生。
尽管CAF通过抑制肿瘤细胞凋亡而表现出致癌特性,Itoh等人在胃癌细胞和CAF的共培养实验中发现,癌细胞与CAF直接相互作用后会显著诱导凋亡,且这一过程由DR4-caspase-8信号通路控制。
总体而言,CAF在调节肿瘤凋亡方面表现出双重能力,通过分泌因子或直接作用于细胞参与抗凋亡和促凋亡作用。
2.2 CAFS对肿瘤自噬的影响
许多研究表明,自噬在细胞、组织和生物体的体内平衡中起着根本性的作用。根据细胞内物质运输到溶酶体的方式以及自噬是一个动态且受严格调控的过程,负责通过溶酶体介导的通路,自噬网络失调被认为与癌症的发展和进展有关。自噬过程的复杂性,自噬可分为巨自噬、微自噬和分子伴侣介导的自噬。最近的研究不仅探讨了自噬在肿瘤细胞中的内在功能,还探讨了自噬在TME(包括免疫细胞和基质细胞)中的参与。
Thongchot等人已发现IL-8是由CAFs释放的一种细胞因子,可驱动卵巢癌细胞转移,且在机制上与自噬下调有关。从CAFs中分离出的细胞因子IL-6促进了胆管癌细胞迁移,这种作用也与癌细胞自噬抑制有关。CAF衍生的骨膜蛋白(PN)与结直肠癌细胞上的主要ITGα5β1或ITGα6β4受体结合,从而启动AKT依赖性信号级联并进一步减弱自噬。这些发现表明,CAF衍生的细胞因子/趋化因子通过自噬抑制赋予肿瘤细胞恶性表型,并且CAF可能是治疗或阻断癌症转移的潜在治疗靶点。
自噬对肿瘤耐药性的影响本质上是双重的。同时,CAFs对肿瘤耐药性也有双重影响:不仅通过抑制自噬,还通过增强自噬过程。乳腺癌中,高迁移率族蛋白1(HMGB1)是一种细胞外信号分子,由CAF通过GPR30/PI3K/AKT信号通路分泌。同时,进一步证实CAF衍生的HMGB1通过MEK/ERK信号刺激ERα阳性乳腺癌细胞中的自噬,从而促进癌细胞对他莫昔芬的耐药性。同样,另一项研究表明,乳腺癌细胞与ERα共培养后HMGB1表达增加CAFs,其中升高的HMGB1水平通过增强自噬而增加了癌细胞对阿霉素的耐药性。此外,Liao等人首次报道CAFs有助于舌癌顺铂耐药性的产生,这也与自噬机制的激活有关。
2.3 CAFS对肿瘤铁死亡的影响
铁死亡不同于上述其他类型的RCD。自2012年被发现以来,它已成为癌症研究领域的一个广泛研究课题。从形态学上讲,经历铁死亡的细胞表现出独特的线粒体特征,包括线粒体收缩、膜密度增加以及线粒体嵴减少或缺失。从机制上讲,铁死亡的核心生化和代谢事件是细胞内致命脂质过氧化产物异常积累导致细胞膜氧化损伤。近年来,铁死亡引起了癌症研究界的极大关注,并在癌症治疗中展现出良好的前景。
研究表明,CAFs可通过抑制铁死亡来促进癌症增殖和导致治疗抵抗。胃癌中,研究人员发现,CAFs通过分泌靶向花生四烯酸脂氧合酶15(ALOX15)的外泌体miR-522来抑制铁死亡并促进肿瘤生长。此外,顺铂和紫杉醇可通过激活USP7/hnRNPA1通路促进miR-522从CAFs中分泌。此外,长链脂肪酸-辅酶A连接酶4(ACSL4)参与长链脂肪酸代谢的激活,可促进脂质过氧化产物的积累来增强癌细胞对铁死亡的敏感性。CAF外泌体的miR-3173-5p吸收ACSL4并抑制铁死亡,而铁死亡会导致胰腺癌对吉西他滨产生耐药性。不仅如此,CAF还通过分泌小分子蛋白在肿瘤细胞铁死亡中发挥调节作用。CAF通过分泌血小板反应蛋白-4(TSP-4)激活肿瘤细胞中的HSF1。在另一项研究中,CAF通过激活HSF1使胶质母细胞瘤细胞系对铁死亡产生抗性。从机制上讲,HSF1转录增强DLEU1表达,从而导致ATF3减少和SLC7A11增加。因此,从TME中消除CAF将导致铁死亡增加并提高对癌症治疗的敏感性。
Qu等人报道了一种新型 lncRNA Disheveled Binding Antagonist of beta Catenin3 anti-sense1(DACT3-AS1),并表明CAF衍生的外泌体DACT3-AS1可以缓解胃癌细胞的增殖、迁移和侵袭。此外,DACT3-AS1被证实可以下调xCT和GPX4在奥沙利铂处理的细胞中发挥作用,并通过在体外和体内激活铁死亡来增加奥沙利铂的敏感性。总之,CAFs通过介导铁死亡而具有作为癌症治疗靶点的巨大潜力,但对于CAFs中不同信号因子对铁死亡进行双重调节的复杂机制仍不明确。
2.4 CAFS对细胞焦亡的影响
细胞焦亡是一类新近发现的依赖Gasdermin蛋白(GSDM)的RCD,作为一种溶解性和促炎性程序性细胞死亡。目前关于CAFs直接调控肿瘤细胞焦亡的具体过程和机制的研究仍然有限。乳腺癌中,DAMP可以触发NLRP3炎症小体的激活,并通过NLRP3/caspase-1/GSDMD通路诱导CAF中的细胞焦亡,由此产生的IL-1β释放进一步促进肿瘤生长和转移。Hou等人发现了PD-L1的非免疫检查点功能,并证明PD-L1与p-Stat3协同作用,可以转录上调GSDMC的表达,导致癌细胞从凋亡向焦亡转变。已证实CAF表现出促炎因子水平升高,并能分泌信号分子(如IL-8和HMGB1),从而激活邻近癌细胞中的NF-κB通路,这与炎症小体信号传导密切相关,并有可能介导与细胞焦亡相关的基因表达。
作为TME中最主要的组成部分,CAFs可参与调节CD8+T细胞的浸润和行为。Ou等人首次揭示了宫颈鳞状细胞癌(CSCC)中致癌性癌相关肌成纤维细胞(myCAFs)的空间和功能特征,并发现该群体与CSCC中CD4+和CD8+T细胞浸润减少有关。胰腺导管腺癌中,活化的CAFs似乎通过分泌CXCL12来吸引和粘附CD8+T细胞,从而阻止它们进入癌细胞。此外,有研究表明CAFs能够抑制CD8+T细胞的活性,甚至通过PD-L1/2和FASL的作用诱导CD8+T细胞死亡。因此,作者认为CAFs可能能够降低肿瘤细胞中CD8+T细胞诱导的细胞焦亡的发生率。
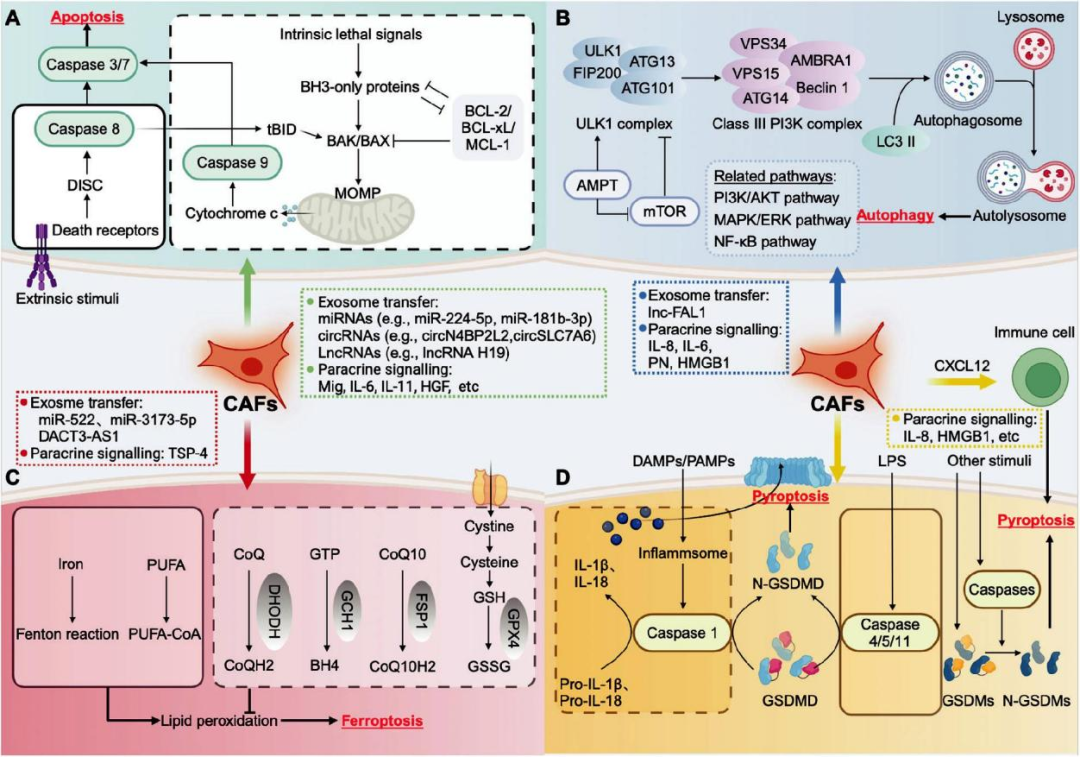
图2 不同类型RCD的核心分子机制以及调节RCD的潜在CAF衍生分子
3. RCD对CAFS的影响
死亡细胞会释放或暴露其表面的生物活性分子,从而错综复杂地塑造TME的动态。然而,之前的研究主要集中在免疫细胞上,而针对细胞死亡对CAFs的具体影响的研究仍然很少。
当代研究结果表明,凋亡细胞会导致凋亡细胞衍生的细胞外囊泡(ApoEV)的产生,这些囊泡可以传递到邻近细胞,可能有助于调节TME。Itoh等人进行了涉及CAF和胃癌细胞的体外共培养实验,随后从条件培养基(CM)中分离出ApoEV。研究结果表明,CAF通过触发细胞凋亡对癌细胞表现出生长限制作用,这种相互作用产生的ApoEV刺激了CAF的侵袭性并导致CAF主导的癌症侵袭。相反,Kim等人指出,源自凋亡肺癌细胞的CM有可能通过抑制TGF-β1信号通路以及下调MMP-2和MMP-12表达来减弱CAF活化和侵袭。与表达Dll1的邻近凋亡癌细胞相互作用后,CAF中会启动Notch1-WISP-1信号的激活,从而对肺癌细胞发挥抗侵袭作用。综上,凋亡细胞和CAF之间错综复杂的相互作用具有多方面的关系。
与凋亡性细胞死亡不同,细胞焦亡和铁死亡等溶解性细胞死亡会导致膜通透性和细胞裂解,随后释放细胞内成分和炎性细胞因子如DAMP。最近的证据表明,当暴露于DAMP(例如ATP、尿酸钠(MSU)、H2O2和坏死液)时,乳腺成纤维细胞会充当DAMP传感器,并通过NLRP3激活进行促炎信号通路激活,这种激活, 这在晚期肿瘤坏死液中尤为明显。这种炎症级联反应进一步上调αSMA并增强成纤维细胞的活化。细胞外HMGB1作为研究最广泛的DAMP,Chen等人提出乳腺癌细胞分泌的HMGB1可通过其受体(晚期糖基化终产物受体(RAGE))诱导成纤维细胞活化,从而导致有氧糖酵解上调。此外,Ren等人用重组HMGB1进行了体外培养实验,并显示CAFs中的自噬刺激增加。
炎症细胞因子(例如IL-1β和IL-18)在细胞焦亡过程中释放,也是组织炎症、肿瘤免疫和癌症进展的关键因素。Schauer等人的研究结果表明,卵巢癌中高水平的IL-1β会刺激相邻CAF上的IL-1R1,从而抑制P53并激活NF-κB信号CAFs中的NF-κB通路,进一步促进CAFs中多种免疫调节趋化因子的转录和释放。IL-1β表现出促进炎症CAFs(iCAF)表型的能力,这由CAFs中PDPN、PDGFRα和FAP蛋白表达增加所证明,但不影响myCAFs标记蛋白αSMA。因此,IL-1β有可能激活CAFs内的炎症信号通路并启动CAF重编程。
Jiang等报道,ANO1能够以PI3K-Akt信号依赖的方式抑制胃肠道肿瘤铁死亡,并刺激癌细胞产生和分泌TGF-β,进而在TME中募集CAFs并产生免疫治疗耐药性。而铁死亡抑制剂Fer-1可以逆转ANO1敲低导致的TGF-β表达和分泌抑制,这突显了癌细胞内铁死亡和TGF-β释放之间可能存在的相反关系。许多研究表明TGF-β信号通路参与CAFs的形成、活化、迁移和代谢。因此,铁死亡可能通过从癌细胞中释放TGF-β对CAFs发挥调控作用。
Mukhopadhyay等人将自噬抑制的PDAC细胞与CAFs共培养,并对自噬抑制的PDAC培养基上清液进行了分泌组分析。结果表明,自噬抑制的PDAC细胞可以通过分泌IL-6上调邻近CAFs中的FPN水平,导致CAFs中铁的流出增加,并导致自噬抑制的PDAC细胞中的LIP得到补偿。这项研究首次揭示了肿瘤细胞自噬活性与CAFs铁代谢的关系,但自噬抑制的肿瘤细胞如何促进IL-6的分泌以及CAFs中铁的来源仍有待进一步研究。
总的来说,RCD在调节CAF方面发挥着重要且有影响力的作用(图3),包括CAF的激活、行为、功能、特性和代谢的动态变化。了解RCD和CAF调节之间错综复杂的相互作用对于解开TME的复杂性至关重要,并可能为癌症治疗提供新的途径。
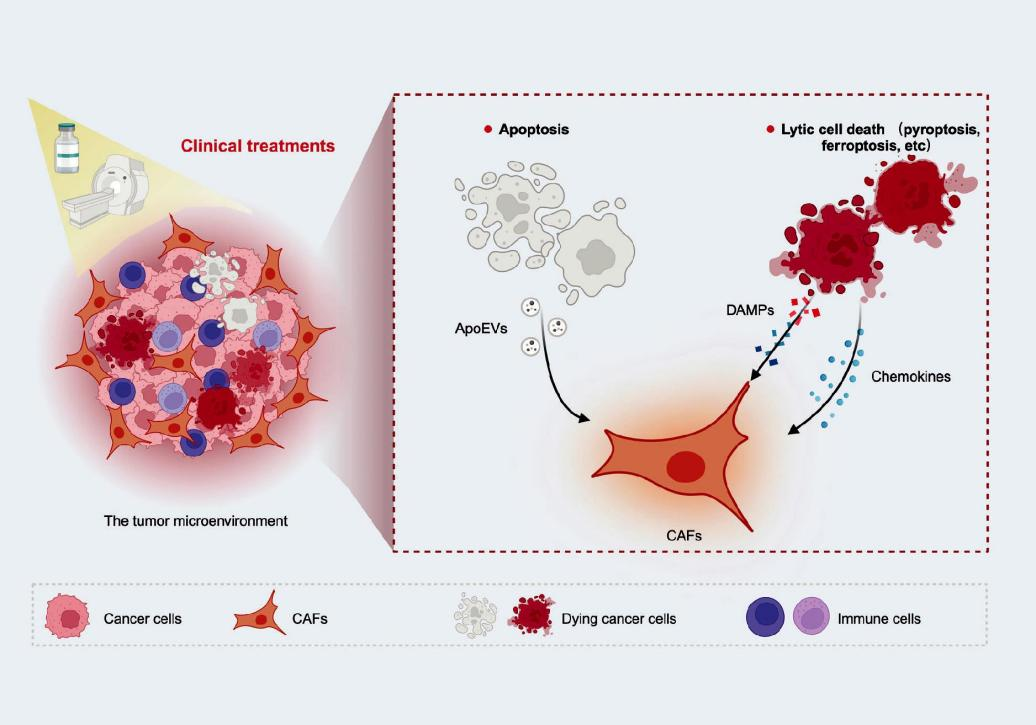
图3 RCD在介导CAF中的作用
4. 意义
毫无疑问,探索针对CAF的新型治疗干预措施大有可为,但也带来了显著的挑战。一个重要的原因是CAF固有的显著异质性,包括表面标志物异质性和功能异质性。目前,可通过全反式维甲酸(ATRA)和维生素D等干预措施将CAF转换为更安静的成纤维细胞状态从而有效抑制CAF功能。已发表的研究结果表明CQ/HCQ通过抑制自噬在癌症治疗中发挥了积极作用。同时,自噬也积极参与CAFs的激活和功能,而CAF调节的自噬在肿瘤发生和发展中起着关键作用。这也为开发通过调节自噬信号通路同时靶向CAFs和肿瘤细胞的新型治疗方法开辟了道路。
临床实践中,肿瘤细胞在接受药物治疗时会经历几种甚至多种形式的RCD,而死亡细胞对TME的具体影响仍相对不确定。因此,在未来的肿瘤治疗中,考虑CAFs的干扰作用至关重要,将传统的抗肿瘤药物与CAF靶向治疗相结合可能会改善治疗效果。
总结
目前,研究越来越多地关注TME对癌症的发生、发展、转移和耐药性的重要性。作为TME的重要组成部分,CAFs与邻近细胞进行直接和旁分泌串扰,在TME中表现出多方面和动态的影响。本文着重阐述了CAFs与四种RCD之间相互作用的知识。表明,CAFs可能作为肿瘤内RCD过程的关键调节器,而死亡细胞也可能对CAFs产生影响,从而形成反馈系统。
但有关其机制的作用还存在以下几个问题:①CAFs通过调节RCD对肿瘤细胞发挥促肿瘤和抗肿瘤作用。但寻找靶向CAFs进行有效肿瘤治疗的方法仍存在困难。②同一肿瘤微环境中CAF介导的RCD类型的多样性和复杂性以及这些不同RCD通路之间的潜在串扰需要进一步研究。同时,不同亚群的CAFs是否会引发类似形式的RCD。③在临床实践中抗癌药物表现出诱导多种RCD模式的能力,而了解不同的RCD模式如何影响肿瘤中的CAF行为仍需要进一步探索。④相当一部分研究是在体外实验中开展的,可能会限制准确捕捉CAF的多面性和动态作用的能力,并且无法模拟体内发生的复杂细胞相互作用。
总体而言,本综述简要介绍了CAF和四种RCD类型所涉及的核心分子机制。此外,作者还全面概述了肿瘤中由CAF介导的不同形式的RCD,以及这些RCD模式对CAF的影响,这可能为未来的癌症治疗提供新的治疗途径。
述评
Cong Chen等人在《Cell Death Discovery》上发表的综述文章深入探讨了癌症相关成纤维细胞(CAFs)与肿瘤中调控性细胞死亡(RCD)的复杂交互作用。文章指出,CAFs作为肿瘤微环境(TME)的主要细胞成分,在癌症的发展和治疗中扮演着多面手的角色。它们通过旁分泌信号、外泌体转移和细胞间相互作用,对肿瘤细胞的增殖、治疗抵抗性和免疫逃逸产生影响。文章重点讨论了几种主要的RCD形式——凋亡、自噬、铁死亡和焦亡,这些细胞死亡方式不仅在维持组织稳态中发挥作用,而且在癌症进程中也扮演着关键角色。CAFs能够通过多种机制调节肿瘤细胞的RCD,从而对肿瘤微环境产生深远的影响。例如,CAFs分泌的因子可以促进或抑制肿瘤细胞的凋亡,而自噬过程则可能在肿瘤细胞中起到双重作用,既可以促进细胞存活,也可能促进细胞死亡。
此外,文章还强调了RCD对CAFs自身的影响,即肿瘤细胞经历RCD时释放的信号可能反过来调节CAFs的活性和功能,形成一个复杂的反馈系统。这种双向交互作用为癌症治疗提供了新的视角,尤其是在开发针对CAFs的靶向治疗策略方面。尽管CAFs在癌症治疗中的潜力巨大,但文章也指出了当前研究面临的挑战,包括CAFs的异质性、它们在不同癌症类型中的作用差异,以及如何精确地靶向特定CAFs亚群。此外,文章呼吁更多的研究来深入理解CAFs与RCD之间的交互作用,以及如何将这些知识转化为有效的治疗手段。总的来说,这篇综述为理解CAFs在癌症发展中的作用提供了宝贵的信息,并为未来的研究方向和治疗策略提供了指导。随着对CAFs和RCD之间复杂关系的进一步研究,我们期待能够开发出更有效的癌症治疗方法,特别是那些能够调节肿瘤微环境和增强免疫反应的策略。
参考文献:
Chen C, Liu J, Lin X, et al. Crosstalk between cancer-associated fibroblasts and regulated cell death in tumors: insights into apoptosis, autophagy, ferroptosis, and pyroptosis. Cell Death Discov. 2024;10(1):189. Published 2024 Apr 22. doi:10.1038/s41420-024-01958-9
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#肿瘤微环境# #CAFS# #癌症相关成纤维细胞#
75