氢气联合药物对糖尿病及并发症(如糖尿病心脏病)效果评估
2022-11-24 梅斯医学 梅斯医学 发表于上海
研究显示,与单次给药相比,二甲双胍和氢气的共同给药进一步降低了糖尿病小鼠的细胞焦亡相关蛋白和纤维化相关蛋白的表达,即使在高血糖环境(HG)下也是如此。
【背景介绍】
糖尿病会引起多种并发症,在中老年人群中,糖尿病心脏病是糖尿病患者致死的主要原因之一,尤其是在2型糖尿病患者中。
广义的糖尿病心脏病包括冠状动脉粥样硬化性心脏病(冠心病),糖尿病心肌病和糖尿病心脏自主神经病变等。糖尿病心脏病与非糖尿病患者相比,常起病比较早,糖尿病患者伴冠心病常表现为无痛性心肌梗死,梗死面积比较大,穿壁梗死多,病情多比较严重,预后比较差,病死率较高;如冠状动脉造影和临床排除冠状动脉病变,糖尿病患者出现严重的心律失常、心脏肥大、肺淤血和充血性心力衰竭,尤其是难治性心力衰竭,临床可考虑糖尿病心肌病。
其中,糖尿病性心肌病(DCM)是比较有代表性的疾病。由于它只发生于糖尿病的患者,不能够用高血压性心脏病、冠状动脉粥样硬化性心脏病以及其他心脏病变来解释的心肌疾病这种情况。
它是由于在代谢紊乱、以及微血管病变的基础上会发生广泛的局灶性的心肌坏死,产生的病因和心肌细胞代谢紊乱,心肌细胞的钙转运缺陷有一定关系【1】。如果治疗不当,心脏纤维化和肥大会导致心力衰竭甚至死亡【2】。
【发病机制】
细胞焦亡(细胞炎性坏死)是一种在炎症存在下发生的程序性细胞死亡【3】,其特征是细胞持续增大直至细胞膜破裂,从而引发明显的炎症反应。为了应对不同类型的刺激(如高血糖环境),细胞会产出各种NRL受体,如NLRP3炎性小体。然后激活裂解caspase-1(cl-Caspase-1,一种蛋白水解酶)。 cl-Caspase-1裂解成孔细胞死亡执行因子gasdermin-D(GSDMD),GSDMD易位至膜形成孔,导致白细胞介素 (IL)-18 和 IL-1β 的释放【3、4】。
细胞焦亡涉及多种心血管疾病,例如心肌梗死【5、6】、缺血再灌注损伤【7】,和心肌病【8、9】等。所有这些研究表明,寻找一种针对DCM细胞焦亡的干预措施,是预防和治疗糖尿病性心肌病的有效途径。
DCM的另一种发病机制是纤维化,以心室重构为主要标志,导致心室壁僵硬和舒张功能障碍,最终诱发心力衰竭。高胰岛素血症和高血糖会刺激DCM中肾素血管紧张素-醛固酮通路的激活,从而导致转化生长因子-β1 (TGF-β1) 的激活【10】。
TGF-β1是一种促纤维化细胞因子,可使Smad磷酸化。因此,TGF-β1/Smad信号通路充当下游效应器,修饰靶基因表达并最终导致心脏纤维化和收缩/舒张功能障碍【11】. TGF-β1已成为抗纤维化治疗最重要的靶点之一【12】,对延缓病情进展,减少心力衰竭的发生具有重要意义。
因此,寻找能够选择性抑制细胞焦亡、纤维化的有效干预措施,对于预防DCM具有重要的临床意义。
【氢气用于DCM治疗的可行性分析】
氢气通过选择性地减少细胞氧自由基,特别是最有害的活性氧 (ROS),起到治疗性抗氧化剂的作用【13】。近年来,氢气已被证明具有抗炎、抗氧化和抗纤维化的特性【14、15】。越来越多的证据表明,氢气对缺血性心脏病有效【16】、小肠和肺的缺血再灌注损伤【17、18】,失血性休克【19】。
二甲双胍作为时下治疗糖尿病的一线药物【20】,已被证明具有降血糖作用和心脏保护作用【21】。但是,肝肾功能不全限制了它的高剂量使用【22】。氢气吸入具有多种作用机制,无副作用、安全且易于使用【23、24】,因此,氢联合二甲双胍可能是一种新的治疗策略。
【研究实验】
来自中国哈尔滨医科大学第四附属医院心内科、检验科的团队,进行了这方面的研究,其成果发表在《Free Radical Biology and Medicine》上面。
实验选用4周龄雄性C57BL/6小鼠,将小鼠随机分为五组:分别为对照组 (n = 10)、糖尿病组(DM,n = 10)、吸入氢气治疗组(DM + H2,n = 10)、二甲双胍治疗组 (DM + Met , n = 10) 和用二甲双胍和氢气治疗组(DM+Met+H2,n=10)。所有小鼠都在标准条件下被圈养和适应环境,并喂食正常食物直至研究结束。
然后,为糖尿病组小鼠建立糖尿病模型(血糖值≥16.7 mmol/L 证实糖尿病模型建立成功)【25,26】。接下来,各组按下列方式进行治疗。吸入氢气治疗组,每天吸入2%氢气3小时;二甲双胍治疗组,在饮用水中加入二甲双胍 (200 mg/kg/d,Sigma)【25、27】;二甲双胍和氢气治疗组,接受氢气和二甲双胍联合治疗。所有小鼠饲养8周,之后进行相关检测。
【实验结果】
实验结果一:氢气改善了糖尿病小鼠的心功能障碍和异常形态结构
研究团队通过超声心动图用于评估心脏功能的变化。糖尿病组小鼠有明显的心脏收缩和舒张功能障碍,这种改变在氢气指治疗组中大大减少。
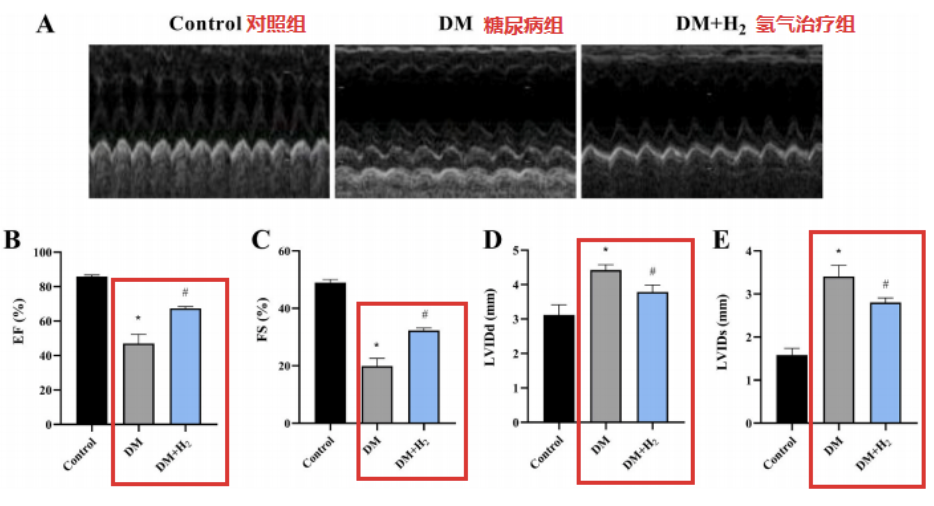
这些变化显示在左心室射血分数(EF%)、左心室短轴缩短率(FS%)、舒张末期左心室内径(LVIDd)和收缩末期左心室内径(LVIDs)的数据对比中。
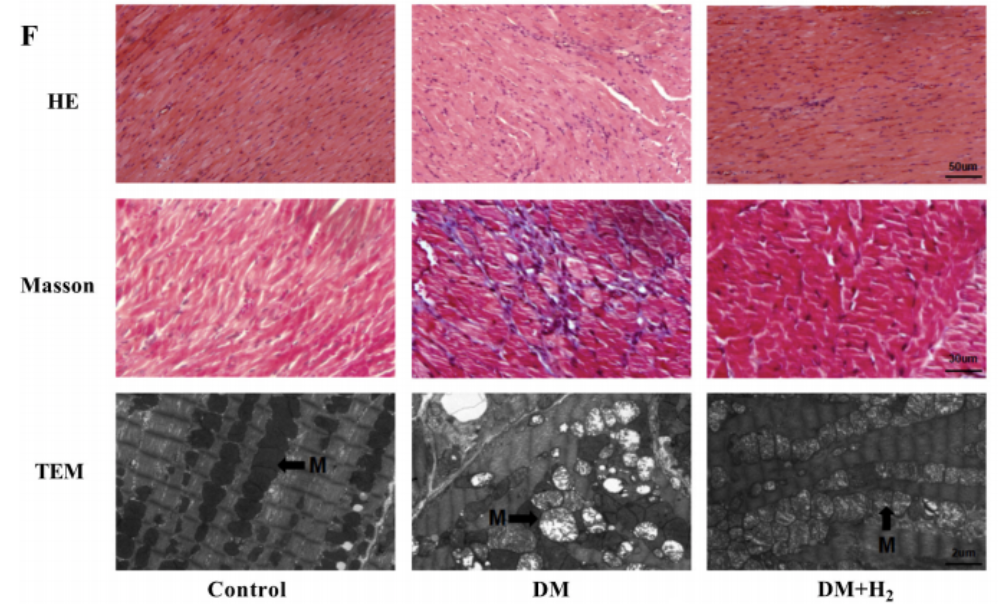
糖尿病组小鼠的心肌表现出严重的肌节紊乱和线粒体(M)肿胀,这在对照组中未见,氢气治疗组的肌节紊乱和线粒体肿胀明显减少。
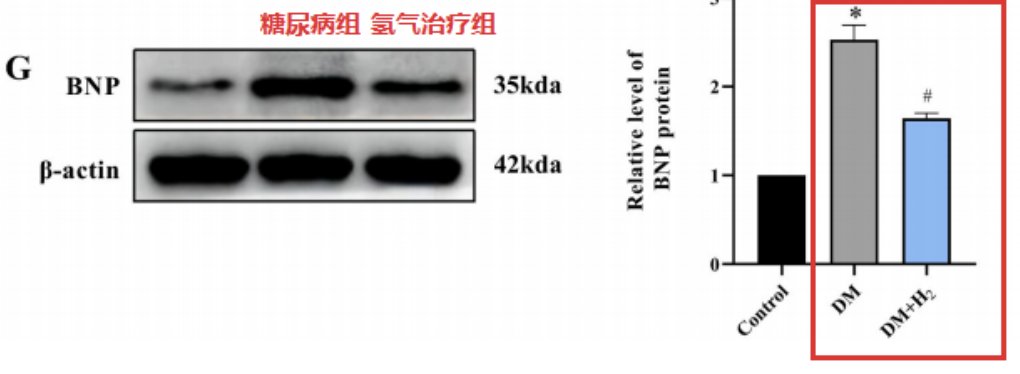
糖尿病组的脑利钠肽(BNP)浓度显著升高,这种变化在氢气治疗组中被逆转。综上所述,这些数据表明氢气可以减轻心脏功能障碍和异常。
结果二:氢气可降低糖尿病小鼠 NLRP3 介导的细胞焦亡蛋白的表达
为了确定氢对糖尿病小鼠细胞焦亡的疗效,研究团队观察了细胞焦亡相关的蛋白质水平。
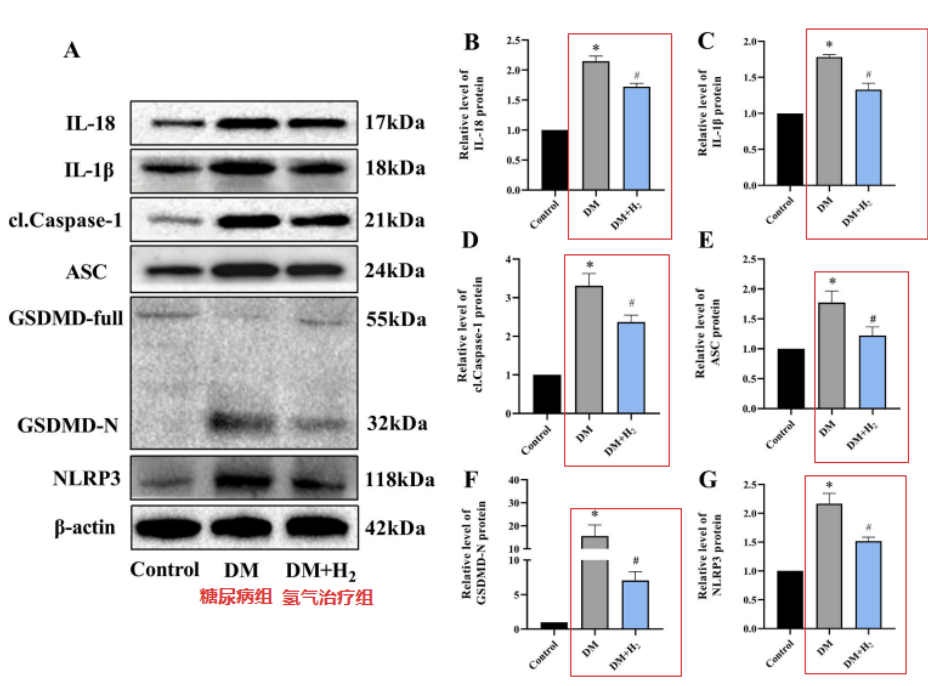
结果发现,NLRP3、cl-Caspase-1、ASC、IL-18、IL-1β和GSDMD-N水平在糖尿病组小鼠中升高;而氢气吸入治疗,有效地恢复了这些炎症细胞因子水平。
另外,与糖尿病组小鼠比较,氢气治疗组小鼠NLRP3、cl-Caspase-1和IL-1β水平较低。以上结果说明氢气可以减少糖尿病小鼠的心脏NLRP3相关细胞焦亡。
结果三:氢气可降低糖尿病小鼠 TGF-β1 介导的纤维化蛋白的表达
过度心肌纤维化是扩张型心肌病的另一个重要特征,给治疗带来困难。TGF-β1/Smad信号通路在心肌纤维化进程中起着至关重要的作用【10、11】。为了验证氢气对糖尿病小鼠心肌纤维化的疗效,研究团队观察了纤维化相关蛋白水平。
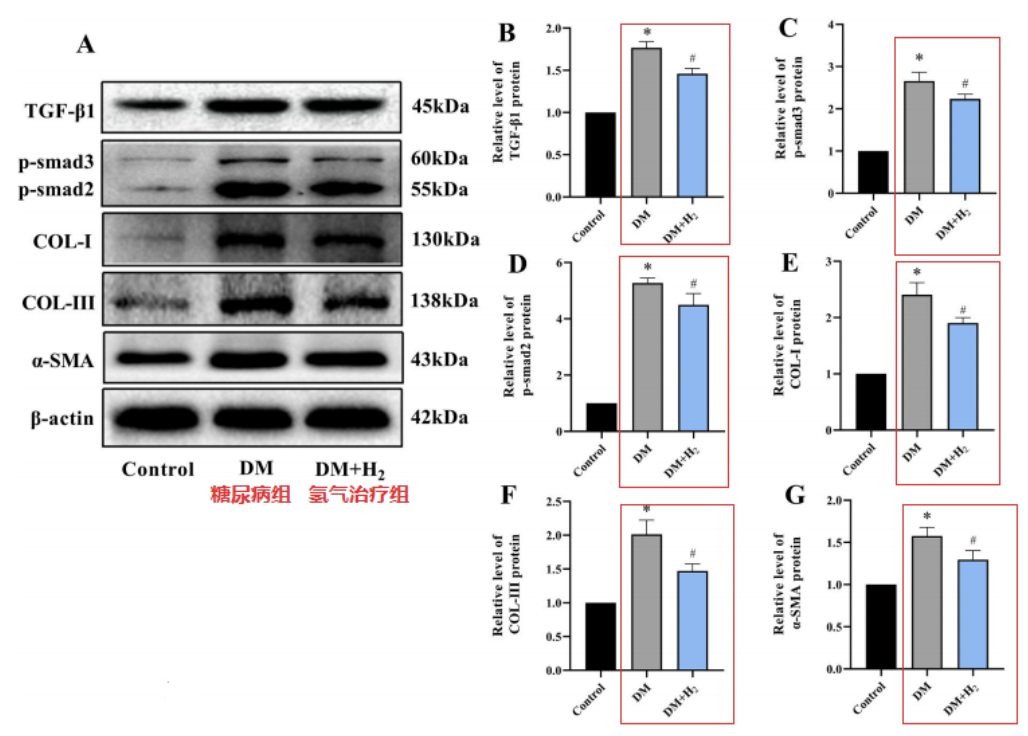
与对照组相比,糖尿病组小鼠的TGF-β1、p-smad3、p-smad2、COL-I、COL-III 和 α-SMA 水平显著升高,而这些蛋白水平在经过吸入氢气治疗后显著降低。
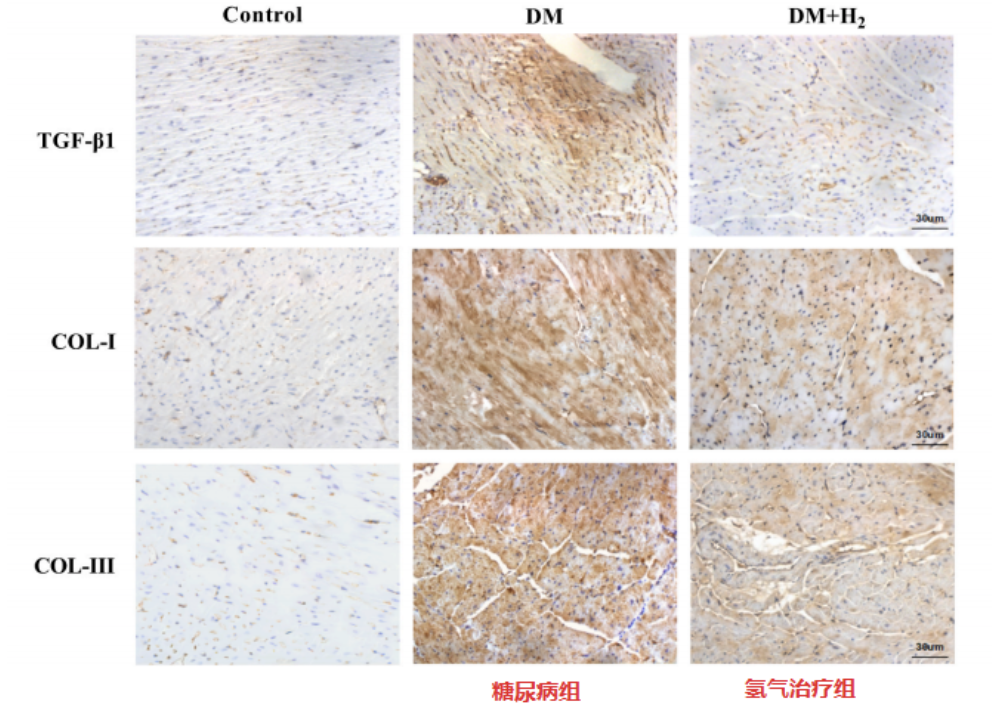
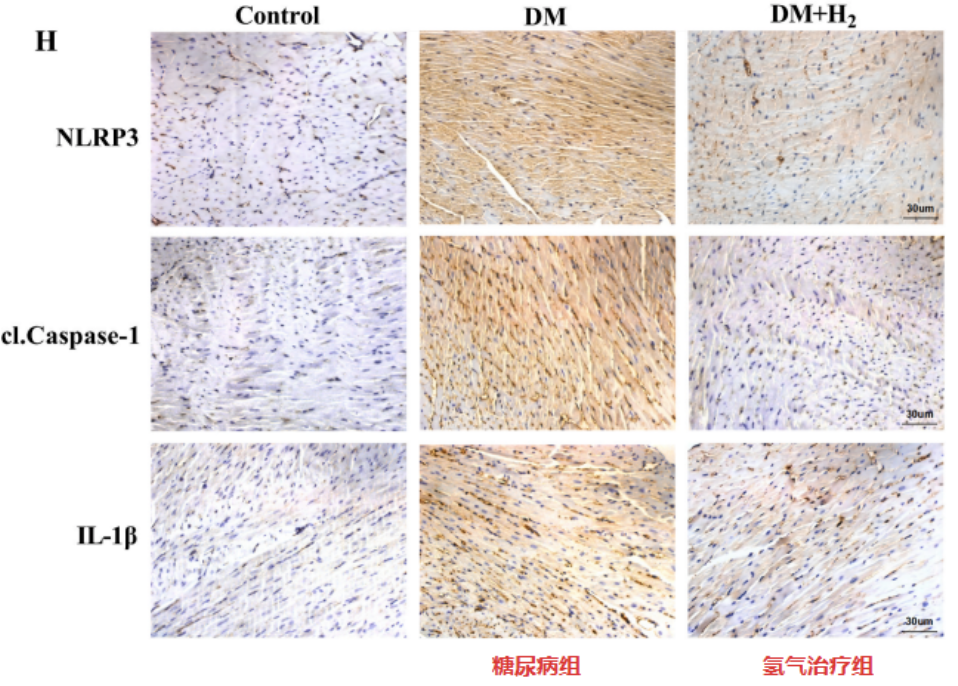
免疫组织化学染色测试,也证明了这些发现,表明氢气吸入降低了糖尿病组组中 TGF-β1、COL-I和COL-III的水平。以上结果表明氢气可以减轻糖尿病小鼠的心脏纤维化。
结果四:在高血糖 (HG) 条件下吸入氢气,通过减少AMPK/ mTOR/NLRP3信号通路抑制细胞焦亡
在确认氢在减轻糖尿病小鼠细胞焦亡中的作用后,下一步是阐明其潜在机制。既往研究证实,富氢盐水可通过AMPK/mTOR信号通路减少内毒素引起的急性肺损伤【28】,二甲双胍通过 AMPK/mTOR途径减轻【25】糖尿病。推测氢也可能通过介导糖尿病组中的AMPK/mTOR/NLRP3 通路来抑制细胞焦亡。
为了更好地理解氢、AMPK和 NLRP3 之间的相互作用,研究团队提取了原代心肌细胞,并在用氢干预高糖环境(标记为HG+H2)和不用氢干预的高糖环境 (标记为HG) 处理的 5.0 mmol/L(对照)和 30 mmol/L 葡萄糖中生长。Compound C(标记为CC)是一种选择性,ATP 竞争性的 AMPK 抑制剂,被证明可加重高葡萄糖诱导的细胞损伤,并充当阻断剂,采用氢干预高糖环境,添加Compound C (标记为HG+H2+CC) 对高糖处理的心肌细胞进行给药处理。
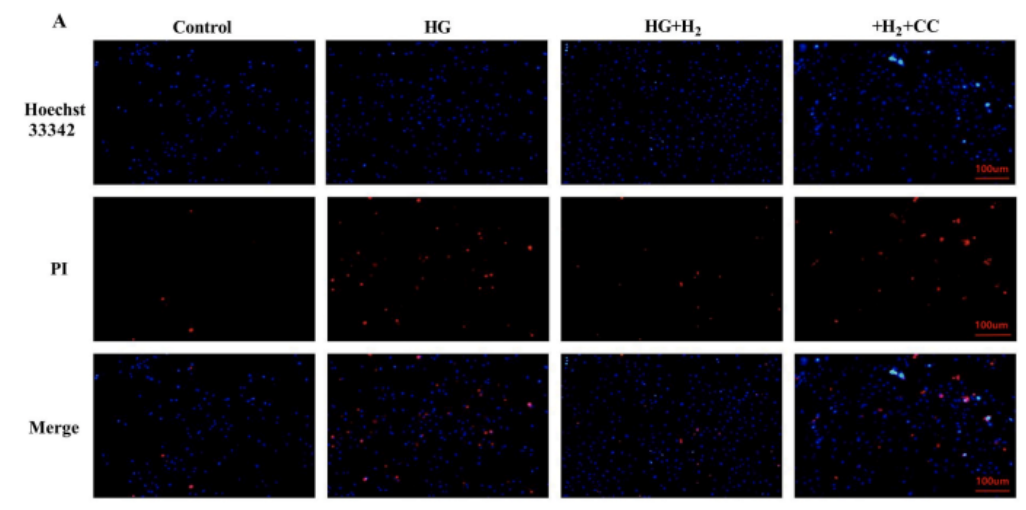
采用Hoechst33342/PI双荧光染色检测高糖诱导的细胞死亡,结果显示高糖诱导的原代心肌细胞死亡增加被氢气逆转,而这种保护作用被CC干预破坏。
通过CCK8测定和LDH释放测定,检测心肌细胞的活性和损伤程度,结果与Hoechst33342/PI 双荧光染色的结果一致,表明CC破坏了氢的保护作用。
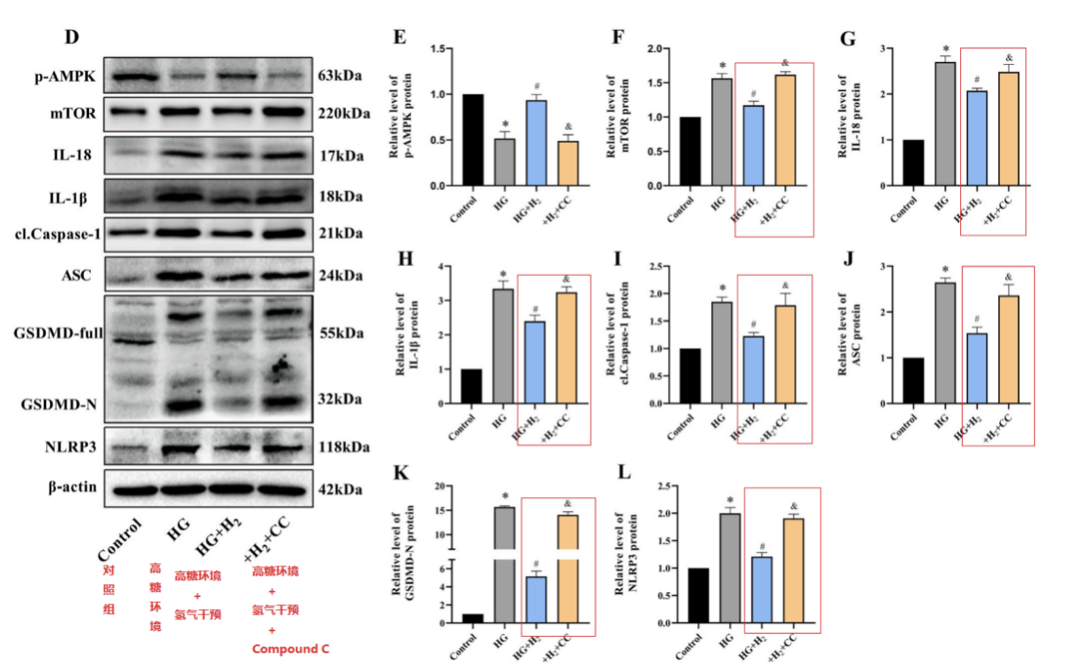
随后,经过Western blot检测,显示HG组的 p-AMPK 水平降低。经过氢气治疗后HG+H2组mTOR、IL-18、IL-1β、cl-Caspase-1、ASC、GSDMD-N和NLRP3的水平显著低于 HG 组;这种保护作用被 CC 破坏了(HG+H2+CC)。这些发现表明氢通过 AMPK/mTOR/NLRP3轴抑制细胞焦亡。
结果五:高糖环境下吸入氢气,通过抑制 TGF-β1/Smad 通路减轻纤维化
在确认氢气减轻糖尿病小鼠的心肌纤维化以及氢气降低 TGF-β1、p-smad3 和 p-smad2 的水平后,研究团体探索氢气与TGF-β1的关系。
取心脏成纤维细胞,并在用氢干预高糖环境 (HG + H2) 或不用氢气干预的高糖环境(HG), 处理的 5.5 mmol/L(对照)和 30 mmol/L 葡萄糖溶液中培养;将外源性 TGF-β1 于用氢气干预的高糖环境中(标记为HG + H2+TGF-β1)。
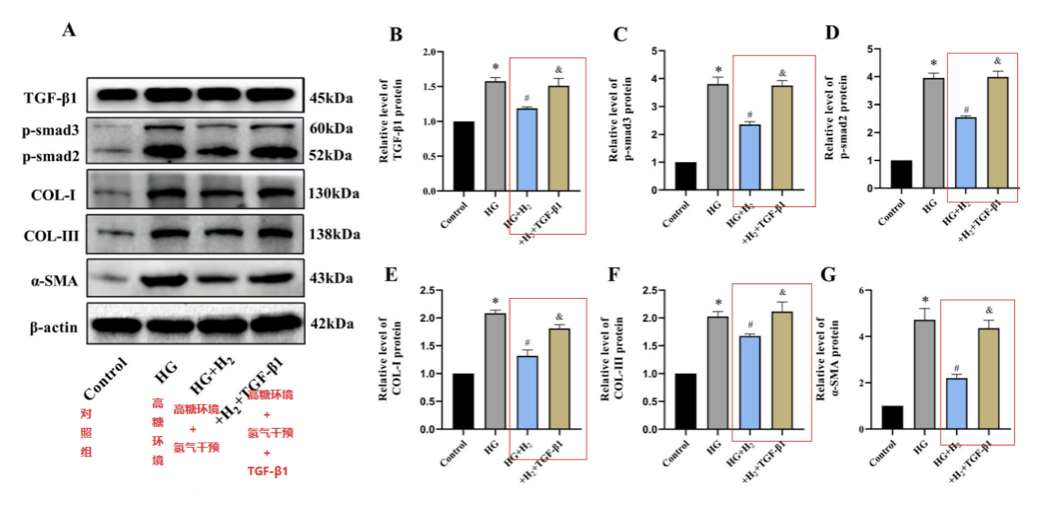
根据蛋白质印迹,TGF-β1、p-smad3、p-smad2、COL-I、COL-III和α-SMA水平在不用氢气干预的高糖环境中显著更高;经过氢干预高糖环境(HG + H2)处理后,水平显著降低;在添加了外源性TGF-β1,氢气的保护作用被破坏。
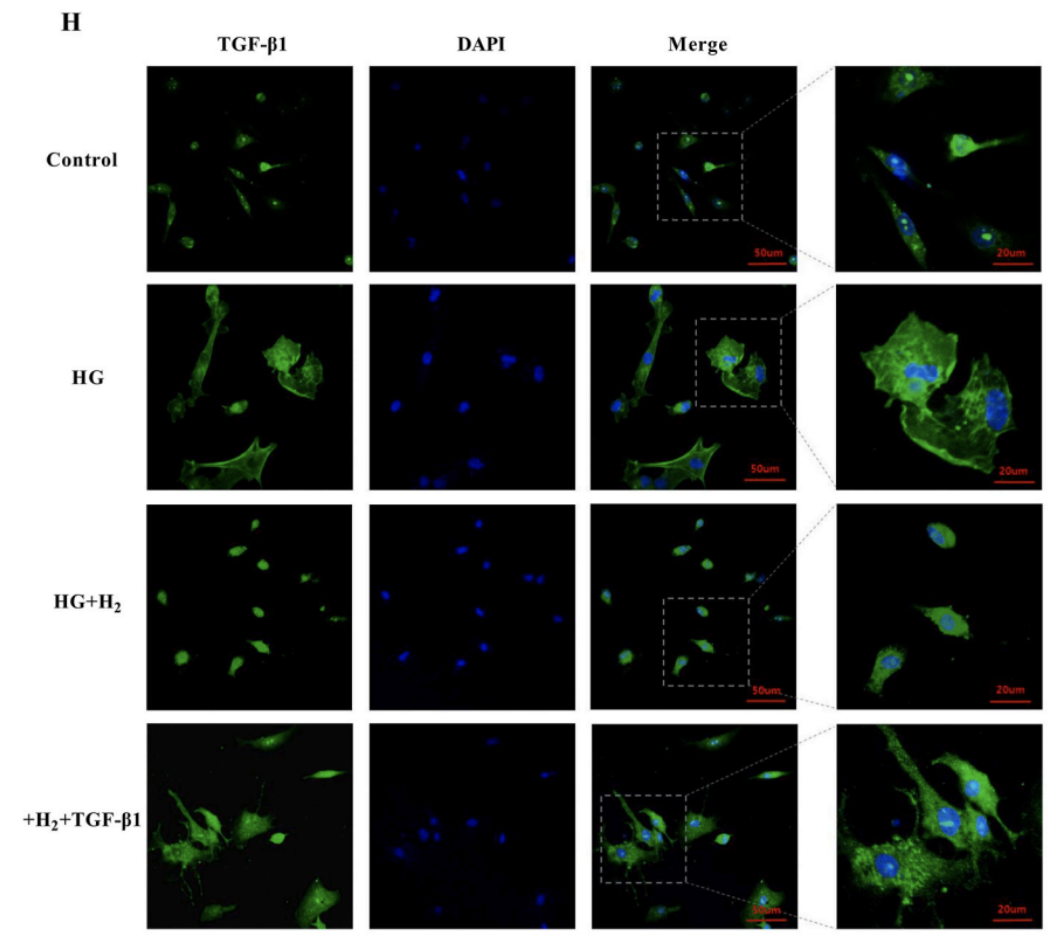
TGF-β1的免疫荧光检测证实了这一发现
心脏成纤维细胞(CFs)迁移是病理性纤维化的另一个原因。Transwell(用于检测细胞迁移)用于评估氢气对CFs迁移的影响。

结果表明,在不用氢气干预的高糖环境中(HG)增加了CFs在心底中的迁移,氢气干预(HG+H2)有效地阻止了迁移,但这种保护作用,被外源性TGFβ1破坏。
结果六:二甲双胍+氢气治疗抑制糖尿病引起的小鼠组织病理学改变
尽管二甲双胍是一线药物,但由于担心副作用风险增加,在肝肾功能不全患者中大剂量使用历来是禁忌的【22】。氢气是一种生理惰性气体,不会与任何活性化合物发生反应【29】,非常易于使用。接下来,研究团队分析了糖尿病小鼠对二甲双胍和氢气联合给药的反应。
实验人员将小鼠分为5组,对照组 (n = 20)、糖尿病组(DM,n = 20)、吸入氢气治疗组(DM + H2,n = 20)、二甲双胍治疗组 (DM + Met , n = 20) 和用二甲双胍和氢气治疗组(DM+Met+H2,n=20)。2个月后,各组存活数量依次为20、10、14、13、17。
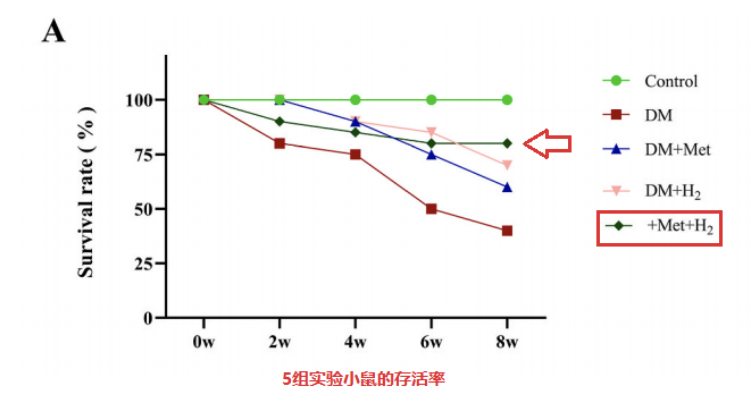
二甲双胍和氢气处理均提高了小鼠的存活率,而二甲双胍和氢气联合给药表现出更显著的保护作用,另外,单独使用二甲双胍 (DM + Met) 或与氢气联合使用 (DM + Met + H2)可显著降低空腹血糖水平。与DM组相比,DM+H2组空腹血糖水平略有降低。
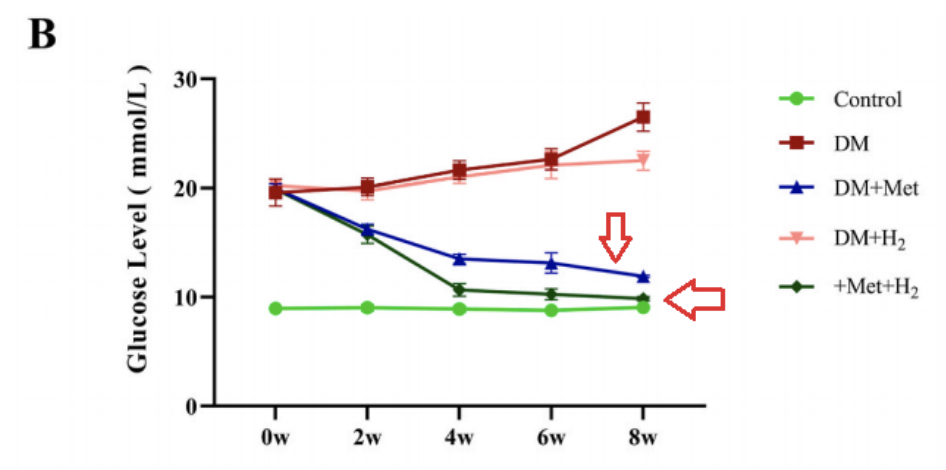
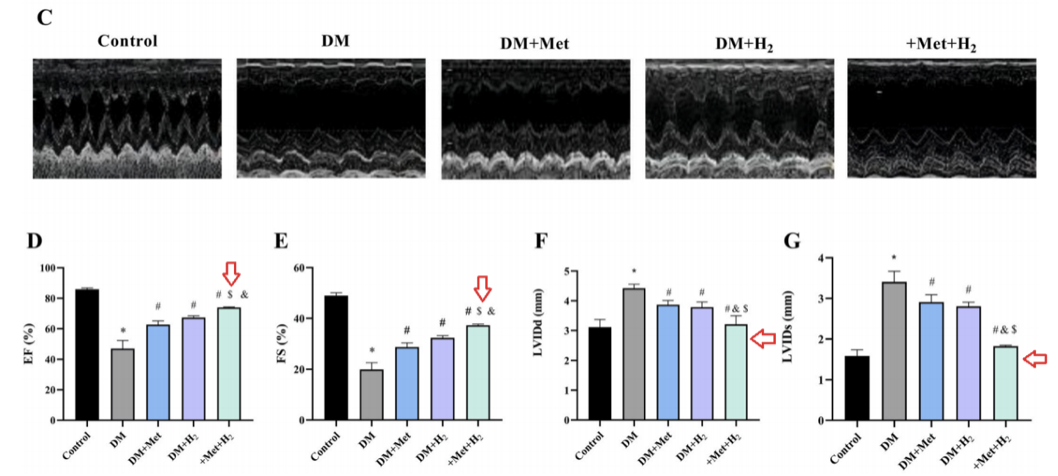
左心室射血分数(EF%)、左心室短轴缩短率(FS%)增加,舒张末期左心室内径(LVIDd)和收缩末期左心室内径(LVIDs)减少,表明氢气联合二甲双胍治疗,比单一治疗发挥更显著的效果。
HE染色(苏木精-伊红染色法)显示糖尿病组心肌结构异常、肥厚,单次服用二甲双胍或氢气可减轻这种心肌结构异常、肥大,而同时联合服用二甲双胍和氢气效果更显著。
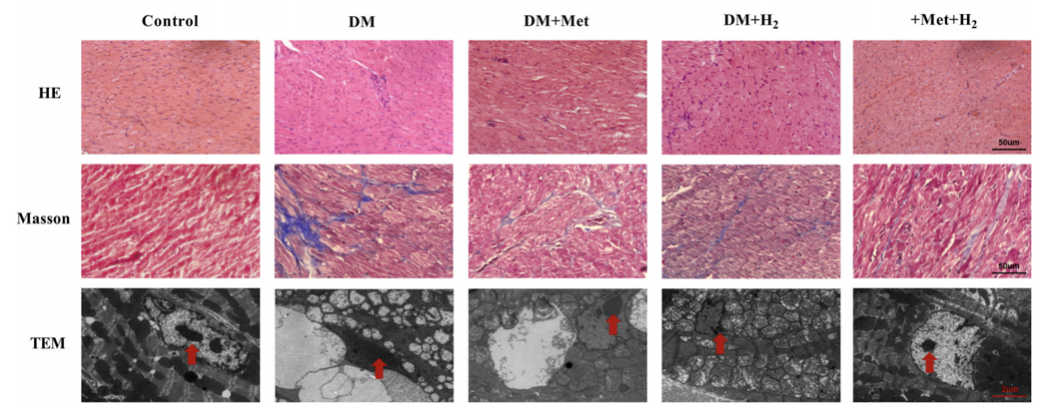
Masson染色(固绿法)显示DM+Met+H2组间质纤维化程度低于单一治疗组。此外,透射电子显微镜显示,糖尿病组肌节(肌原纤维节,是肌原纤维的基本单位)紊乱、线粒体肿胀、细胞核固缩;而在DM+Met、DM+H2组中,这种问题得到缓解;在DM+Met+H2组中,肌节紊乱、线粒体肿胀、核固缩等损伤几乎完全消除。
结果七:与单独干预相比,二甲双胍联合氢气干预,减少了糖尿病小鼠的细胞焦亡和纤维化
氢气抑制糖尿病小鼠模型中的细胞焦亡和纤维化,二甲双胍已被证明具有抗细胞焦亡和抗纤维化特性【25、30】。研究团队通过蛋白质印迹和免疫组织化学测定蛋白质,评估二甲双胍和氢气联合给药对糖尿病小鼠细胞焦亡相关蛋白和纤维化相关蛋白表达的影响。
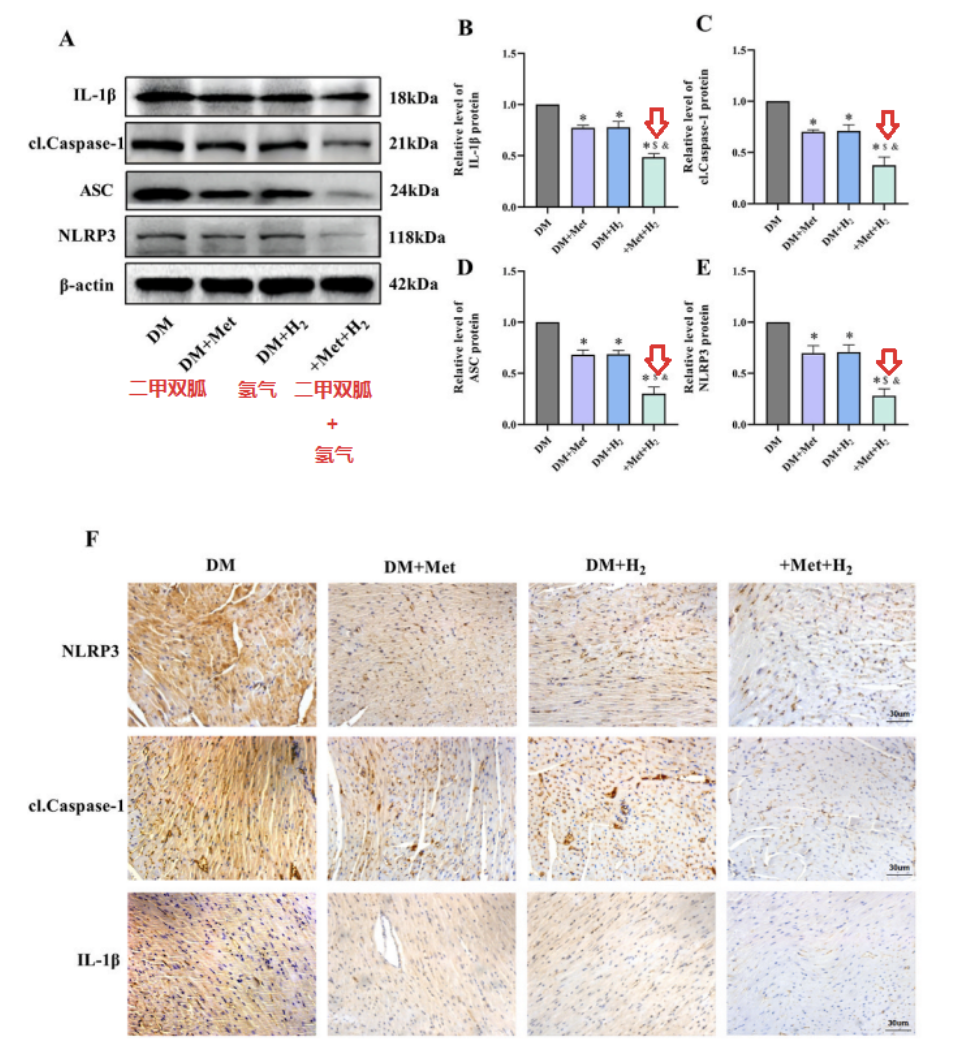
二甲双胍和氢均降低了NLRP3、cl-Caspase-1和IL-1β的表达,而联合治疗更显著降低了蛋白质表达水平。
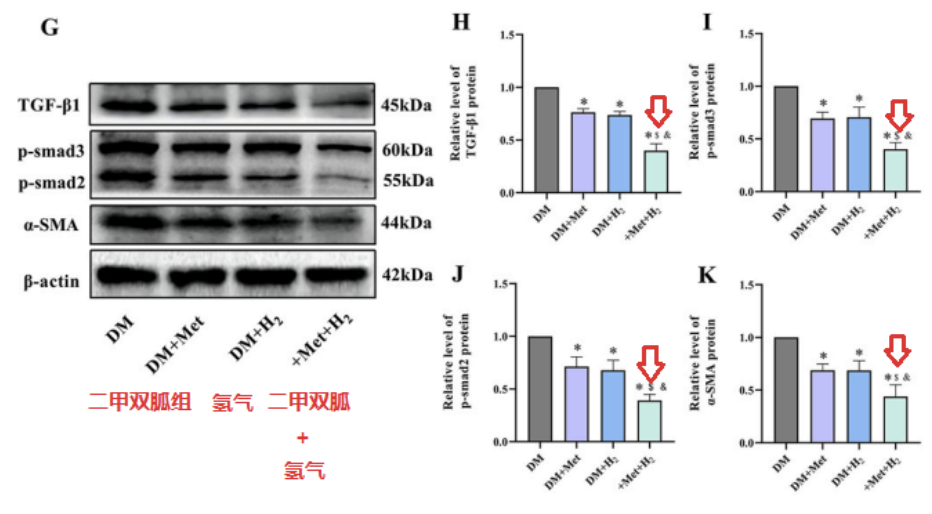
Western blot检测,也发现DM + Met+ H2组的TGF-β1、p-smad3、p-smad2和α-SMA 水平,低于DM+H2和DM+Met组。
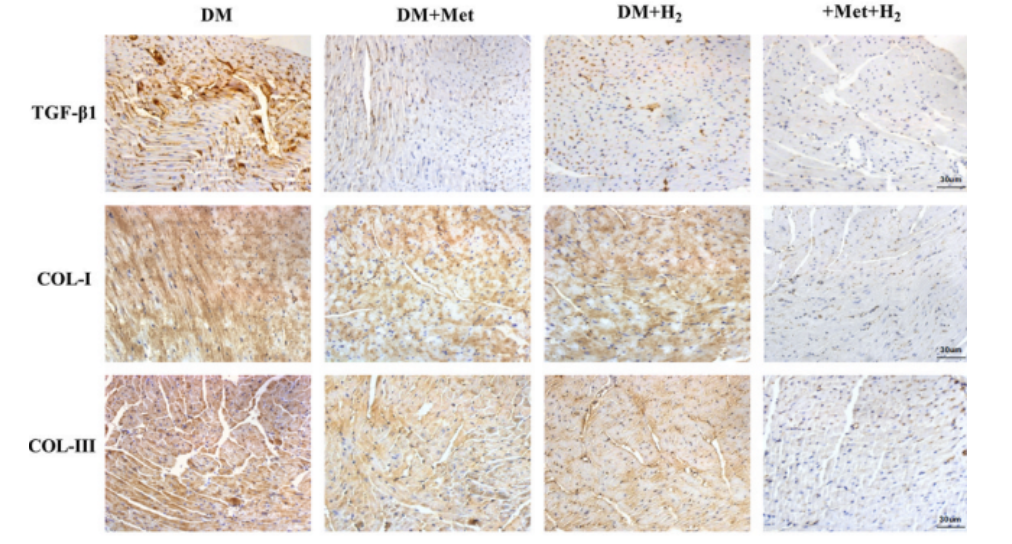
此外,免疫组织化学检测,也证实了类似的现象。这些结果表明,与单独给药相比,二甲双胍和氢气的共同给药,对 DCM 显示出更好的抗细胞焦亡和抗纤维化作用。
结果八:在高血糖(HG)环境下,二甲双胍联合氢气干预,进一步减轻了细胞损伤。
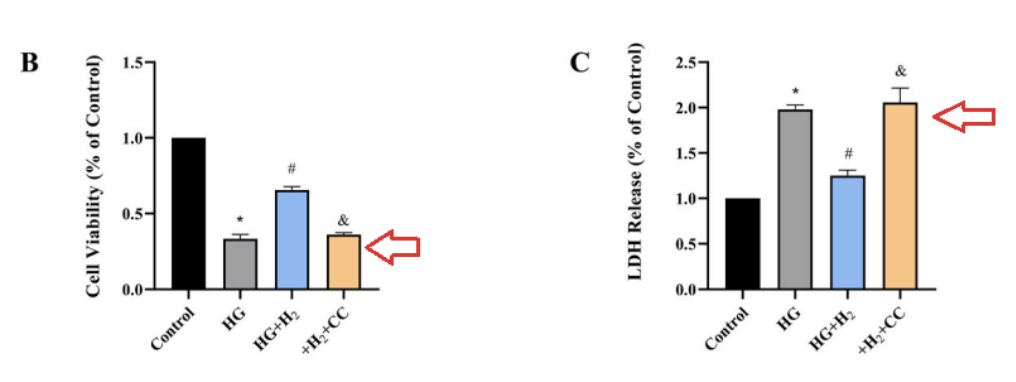
根据cck-8检测(细胞增殖毒性检测),高血糖会显著降低心肌细胞的活性。
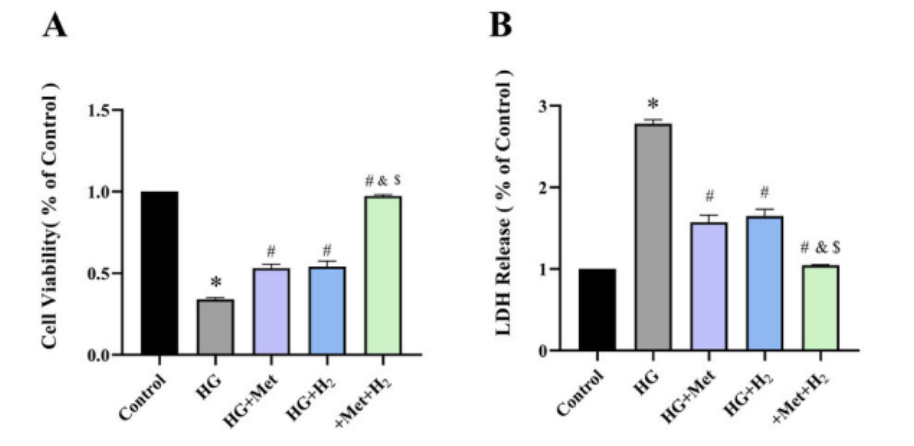
二甲双胍和氢气都增加了暴露于高血糖的心肌细胞的活性,而二甲双胍和氢气的共同给药,提供了更好的保护作用(图A);LDH释放试验结果也验证了上面的结论(图B)。
蛋白质印迹分析的结果表明,高血糖上调了细胞焦亡相关蛋白,包括 IL-1β、cl-Caspase-1、ASC 和 NLRP3。
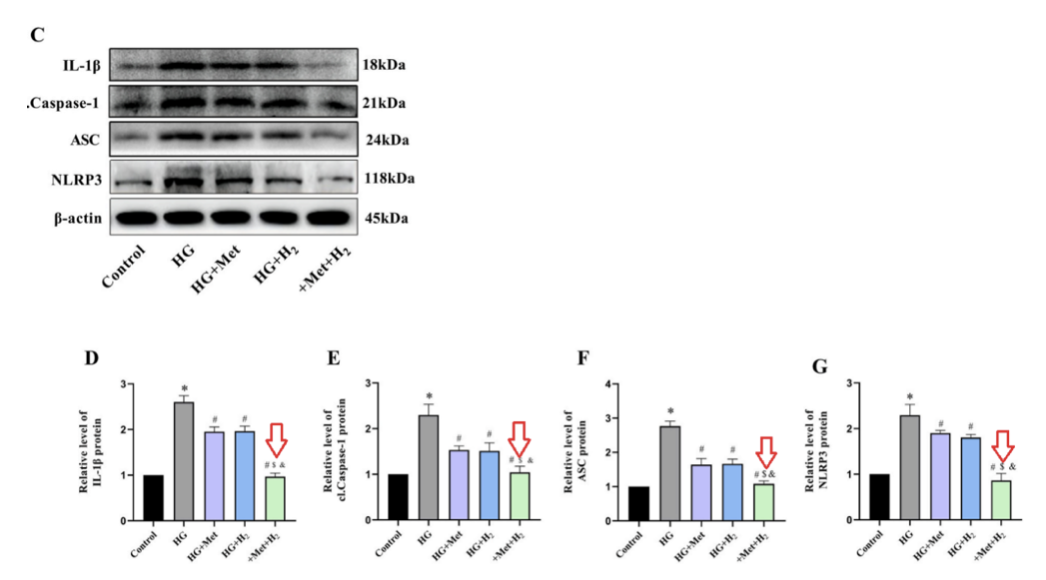
而二甲双胍和氢气的共同给药组的的蛋白表达水平,显著低于单一治疗组。这些数据表明,二甲双胍和氢气的共同给药可以减少高血糖条件下的细胞焦亡,从而最大限度地减少细胞损伤。
结果九:在高血糖环境下,二甲双胍联合氢气干预,进一步缓解了纤维化。
Western blot检测发现,高血糖环境增加了纤维化相关蛋白TGF-β1、p-smad3、p-smad2、COL-I、COL-III、α- SMA的蛋白表达水平。
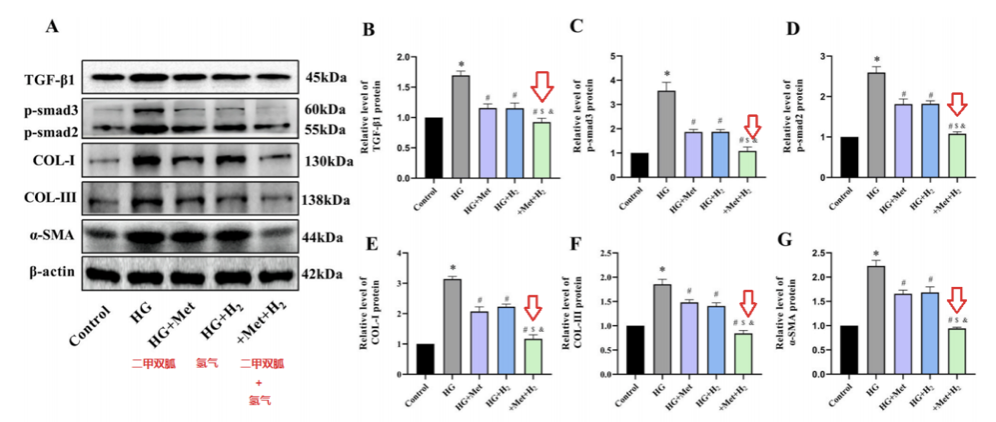
而联合治疗比单一治疗,更能减少纤维化相关蛋白的表达。
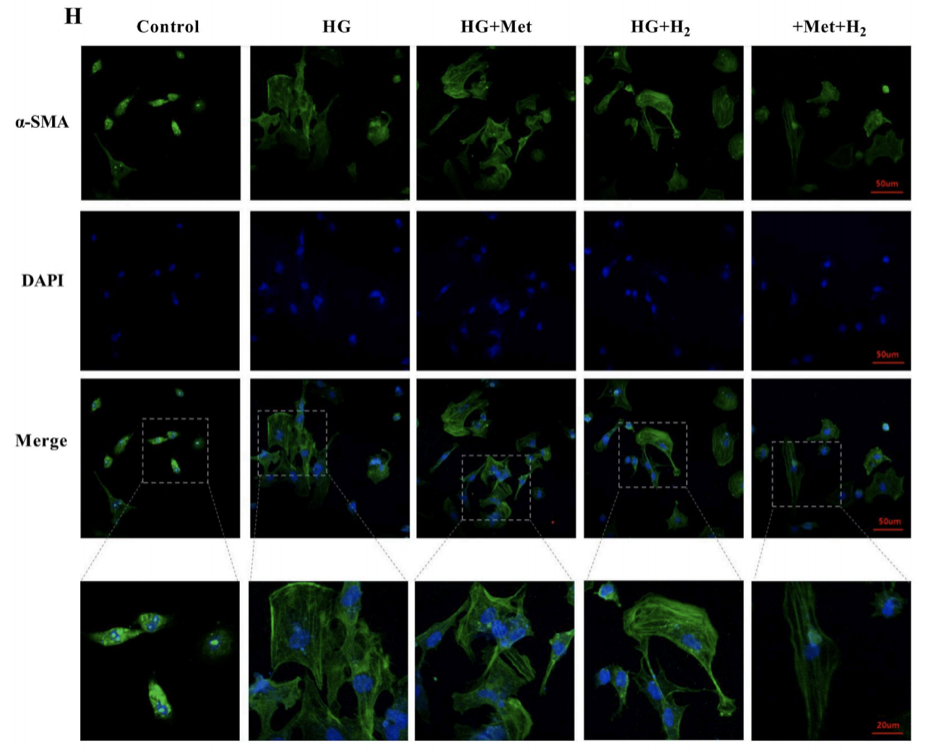
此外,α-SMA的免疫荧光染色检测,也验证了上面的结论。
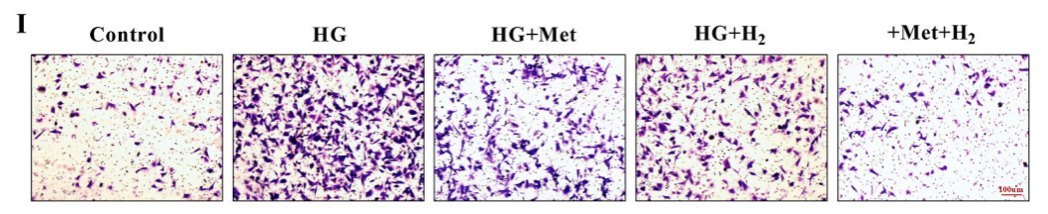
Transwell实验(细胞体外侵袭实验)与心脏成纤维细胞(CFs)迁移,表明高血糖增加了CFs迁移能力,而用二甲双胍或氢气处理,减轻了 CFs 迁移能力。值的关注的是这种迁移能力在二甲双胍和氢气联合给药时达到最低水,表明联合治疗的疗效更高。
【结果分析】
研究团队指出,这是首次证明吸入氢气可通过抑制细胞焦亡和纤维化,有效减轻糖尿病小鼠的心脏损伤。证据表明,氢气通过降低 AMPK/mTOR/NLRP3 信号通路减少细胞焦亡,并通过抑制TGF-β1/Smad 信号通路减轻纤维化。
进一步的研究证实,与单独给药相比,二甲双胍和氢气的共同给药对糖尿病心脏病(DCM)具有更好的保护作用,表明氢气可以与二甲双胍联合使用以减轻 DCM。这些发现为治疗糖尿病心脏损伤提供了一种候选策略。
由于衰老、肥胖和糖尿病,心力衰竭的发病率及其相关的发病率和死亡率正以惊人的速度增加。众所周知,在心力衰竭方面,糖尿病患者的临床结果比非糖尿病患者更差【2】。糖尿病的并发症,如扩张型心肌病、糖尿病肾病和糖尿病视网膜病变,对人类的危害最大。
氢气是继 NO、CO 和 H2S 之后发现的医用气体。它具有广泛的有益特性,包括抗氧化、抗炎、抗细胞凋亡、抗纤维化、抗过敏和能量代谢刺激特性【14、15】。
氢气改善了糖尿病小鼠的心功能障碍,通过左心室射血分数(EF%)、左心室短轴缩短率(FS%)增加,和脑利钠肽(BNP)浓度的减少来体现。根据HE和Masson染色检测,心肌结构异常、肥大表型和胶原蛋白沉积等症状,通过吸入氢气而减少。这些数据首次证实了氢在DCM中的心脏保护作用。
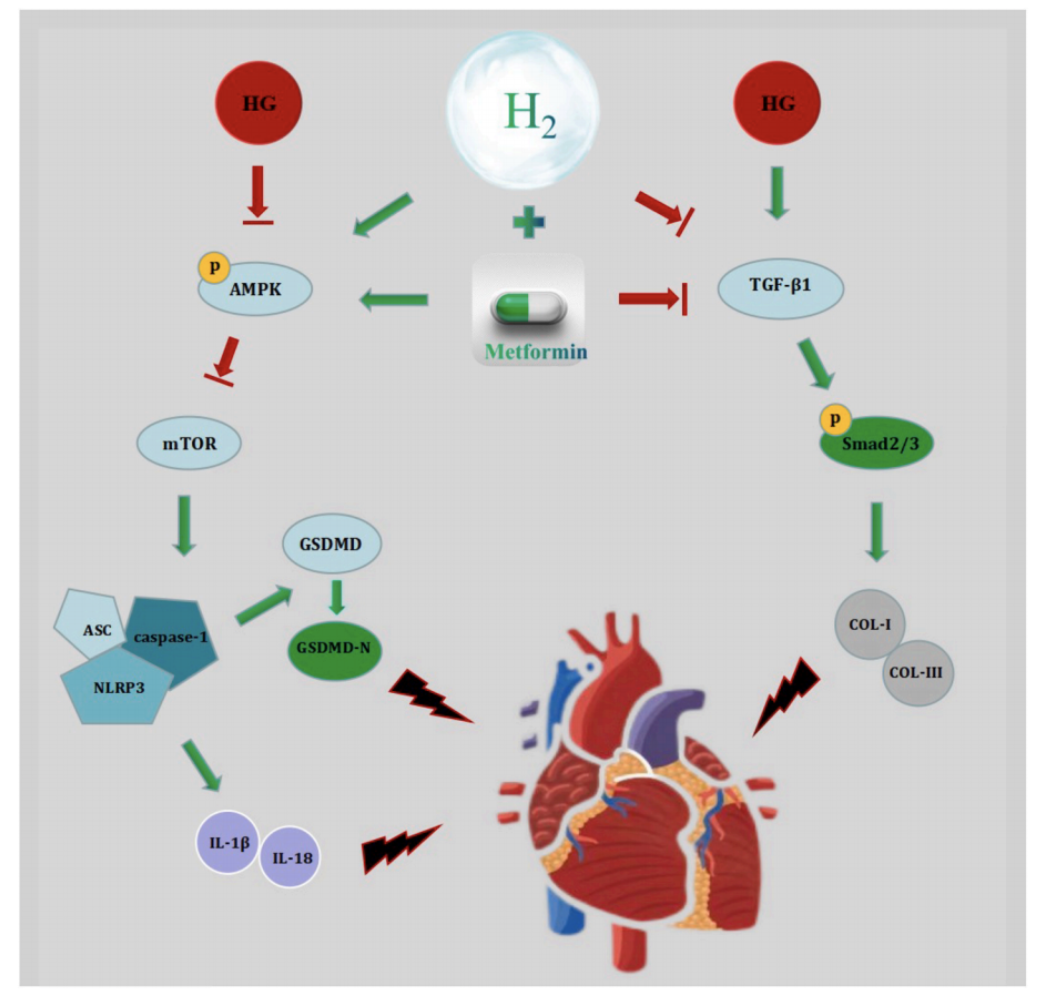
氢气联合二甲双胍,在 DCM 中发挥心脏保护作用
越来越多的证据表明细胞焦亡会导致 DCM 的心脏损伤,抑制细胞焦亡可以大大改善预后【8、31、32】。在本研究中,糖尿病小鼠体内细胞焦亡相关蛋白水平(包括 NLRP3、cl-Caspase-1、ASC、IL-1β、IL-18 和 GSDMD-N)显著升高,而在吸入氢气后这些指标显著降低,这与心脏异常形态和心功能障碍的显著改善有关。蛋白质印迹分析结果显示,氢气增加了p-AMPK 的表达,逆转了细胞焦亡相关蛋白的表达,包括 NLRP3、GSDMD-N、cl-Caspase- 1、ASC、IL-1β 和 IL-18,再次验证了上述实验结果。这些发现表明,氢气通过抑制AMPK/mTOR/NLRP3 信号通路来减少细胞焦亡。
心肌纤维化是糖尿病的另一个重要病理特征。纤维化归因于过量的心脏成纤维细胞(CFs)。TGF-β1是心脏纤维化过程的主要执行者,它由CFs产生。研究发现 TGF-β1/Smad 信号通路在糖尿病小鼠和高血糖环境(HG)处理的 CFs中都被激活,TGF-β1、p-smad3、p-smad2、COL-I、COL-III 的产生增加证明了这一点。氢抑制了糖尿病小鼠和高血糖环境(HG)处理的CFs中纤维化相关蛋白的表达,说明氢气通过抑制 TGF-β1/Smad 信号通路来预防纤维化。
综上所述,这些结果表明氢在 DCM 中具有抗焦亡和抗纤维化的特性,这可能为氢如何改善心脏功能障碍和异常形态结构提供解释。
以往的证据表明,氧化应激与细胞焦亡和纤维化密切相关【33、34】。高血糖引起的过量ROS会破坏线粒体和核DNA,促进DCM的发展【35】。使用抗氧化剂降低糖尿病患者ROS水平,已被证明可以最大限度地减少心肌纤维化并改善心肌收缩功能 【36】。氢气作为一种新型医用气体,首先被发现可以减少ROS的形成【13】。考虑到其不同的特性,氢也可能通过减轻氧化还原反应参与保护DCM。
【研究结论】
虽然二甲双胍在降低糖化血红蛋白方面更有效,但副作用,包括胃肠道问题、药物性皮炎和乳酸性酸中毒,在临床使用相当长一段时间后变得明显。二甲双胍的负面影响,特别是对患有肝病或肾病的人,限制了它的高剂量使用【22】。为了减少副作用,现在广泛采用基于二甲双胍的联合疗法。
在上面的研究中,与单次给药相比,二甲双胍和氢气的共同给药进一步降低了糖尿病小鼠的细胞焦亡相关蛋白和纤维化相关蛋白的表达,即使在高血糖环境(HG)下也是如此。氢气与二甲双胍具有相似的作用,这已通过免疫组织化学、免疫荧光和 transwell 测定法得到证实。氢气和二甲双胍都可以减少细胞焦亡和纤维化,它们可以在很大程度上平行的途径上发挥作用。
氢气可以与二甲双胍联合使用,在扩张型心肌病中表现出更强的心脏保护作用。因此,研究团队建议联合使用二甲双胍和氢气,治疗糖尿病心脏病(DCM)。
【参考文献】
【1】W.H. Dillmann, Diabetic cardiomyopathy, Circ. Res. 124 (8) (2019) 1160–1162.
【2】G. Jia, M.A. Hill, J.R. Sowers, Diabetic cardiomyopathy: an update of mechanisms contributing to this clinical entity, Circ. Res. 122 (4) (2018) 624–638.
【3】Q. Hu, T. Zhang, L. Yi, X. Zhou, M. Mi, Dihydromyricetin inhibits NLRP3 inflammasome-dependent pyroptosis by activating the Nrf2 signaling pathway in vascular endothelial cells, Biofactors 44 (2) (2018) 123–136.
【4】S.M. Man, R. Karki, T.D. Kanneganti, Molecular mechanisms and functions of pyroptosis, inflammatory caspases and inflammasomes in infectious diseases, Immunol. Rev. 277 (1) (2017) 61–75.
【5】T.C. Yang, P.Y. Chang, S.C. Lu, L5-LDL from ST-elevation myocardial infarction patients induces IL-1β production via LOX-1 and NLRP3 inflammasome activation in macrophages, Am. J. Physiol. Heart Circ. Physiol. 312 (2) (2017) H265–h274.
【6】H. Gonzalez-Pacheco, G. Vargas-Alarcon, J. Angeles-Martinez, C. MartinezSanchez, O. Perez-Mendez, G. Herrera-Maya, M.A. Martinez-Rios, M.A. Pe˜naDuque, C. Posadas-Romero, J.M. Fragoso, The NLRP3 and CASP1 gene polymorphisms are associated with developing of acute coronary syndrome: a casecontrol study, Immunol. Res. 65 (4) (2017) 862–868.
【7】Z. Qiu, S. Lei, B. Zhao, Y. Wu, W. Su, M. Liu, Q. Meng, B. Zhou, Y. Leng, Z.Y. Xia, NLRP3 inflammasome activation-mediated pyroptosis aggravates myocardial ischemia/reperfusion injury in diabetic rats, Oxid. Med. Cell. Longev. (2017), 9743280, 2017.
【8】B. Luo, B. Li, W. Wang, X. Liu, Y. Xia, C. Zhang, M. Zhang, Y. Zhang, F. An, NLRP3 gene silencing ameliorates diabetic cardiomyopathy in a type 2 diabetes rat model, PLoS One 9 (8) (2014), e104771.
【9】B. Luo, F. Huang, Y. Liu, Y. Liang, Z. Wei, H. Ke, Z. Zeng, W. Huang, Y. He, NLRP3 inflammasome as a molecular marker in diabetic cardiomyopathy, Front. Physiol. 8 (2017) 519.
【10】Y.K. Bando, T. Murohara, Diabetes-related heart failure, Circ. J. 78 (3) (2014) 576–583.
【11】D.C. Rockey, P.D. Bell, J.A. Hill, Fibrosis–a common pathway to organ injury and failure, N. Engl. J. Med. 372 (12) (2015) 1138–1149.
【12】N.C. Henderson, F. Rieder, T.A. Wynn, Fibrosis: from mechanisms to medicines, Nature 587 (7835) (2020) 555–566.
【13】I. Ohsawa, M. Ishikawa, K. Takahashi, M. Watanabe, K. Nishimaki, K. Yamagata, K. Katsura, Y. Katayama, S. Asoh, S. Ohta, Hydrogen acts as a therapeuticantioxidant by selectively reducing cytotoxic oxygen radicals, Nat. Med. 13 (6) (2007) 688–694.
【14】S. Ohta, Recent progress toward hydrogen medicine: potential of molecular hydrogen for preventive and therapeutic applications, Curr. Pharmaceut. Des. 17 (22) (2011) 2241–2252.
【15】S. Ohta, Molecular hydrogen is a novel antioxidant to efficiently reduce oxidative stress with potential for the improvement of mitochondrial diseases, Biochim. Biophys. Acta 1820 (5) (2012) 586–594.
【16】K. Hayashida, M. Sano, I. Ohsawa, K. Shinmura, K. Tamaki, K. Kimura, J. Endo, T. Katayama, A. Kawamura, S. Kohsaka, S. Makino, S. Ohta, S. Ogawa, K. Fukuda, Inhalation of hydrogen gas reduces infarct size in the rat model of myocardial ischemia-reperfusion injury, Biochem. Biophys. Res. Commun. 373 (1) (2008) 30–35.
【17】B.M. Buchholz, D.J. Kaczorowski, R. Sugimoto, R. Yang, Y. Wang, T.R. Billiar, K. R. McCurry, A.J. Bauer, A. Nakao, Hydrogen inhalation ameliorates oxidative stress in transplantation induced intestinal graft injury, Am. J. Transplant. 8 (10) (2008) 2015–2024.
【18】T. Kawamura, C.S. Huang, N. Tochigi, S. Lee, N. Shigemura, T.R. Billiar, M. Okumura, A. Nakao, Y. Toyoda, Inhaled hydrogen gas therapy for prevention of lung transplant-induced ischemia/reperfusion injury in rats, Transplantation 90 (12) (2010) 1344–1351.
【19】K. Kohama, H. Yamashita, M. Aoyama-Ishikawa, T. Takahashi, T.R. Billiar, T. Nishimura, J. Kotani, A. Nakao, Hydrogen inhalation protects against acute lung injury induced by hemorrhagic shock and resuscitation, Surgery 158 (2) (2015) 399–407.
【20】M. Foretz, B. Guigas, L. Bertrand, M. Pollak, B. Viollet, Metformin: from mechanisms of action to therapies, Cell Metabol. 20 (6) (2014) 953–966.
【21】S. Palee, L. Higgins, T. Leech, S.C. Chattipakorn, N. Chattipakorn, Acute metformin treatment provides cardioprotection via improved mitochondrial function in cardiac ischemia/reperfusion injury, Biomed. Pharmacother. 130 (2020) 110604.
【22】R. DeFronzo, G.A. Fleming, K. Chen, T.A. Bicsak, Metformin-associated lactic acidosis: current perspectives on causes and risk, Metabolism 65 (2) (2016) 20–29.
【23】S. Ohta, Molecular hydrogen as a preventive and therapeutic medical gas: initiation, development and potential of hydrogen medicine, Pharmacol. Therapeutic. 144 (1) (2014) 1–11.
【24】P. Fontanari, M. Badier, C. Guillot, C. Tomei, H. Burnet, B. Gardette, Y. Jammes, Changes in maximal performance of inspiratory and skeletal muscles during and after the 7.1-MPa Hydra 10 record human dive, Eur. J. Appl. Physiol. 81 (4) (2000) 325–328.
【25】F. Yang, Y. Qin, Y. Wang, S. Meng, H. Xian, H. Che, J. Lv, Y. Li, Y. Yu, Y. Bai, L. Wang, Metformin inhibits the NLRP3 inflammasome via AMPK/mTORdependent effects in diabetic cardiomyopathy, Int. J. Biol. Sci. 15 (5) (2019) 1010–1019.
【26】L. Li, W. Luo, Y. Qian, W. Zhu, J. Qian, J. Li, Y. Jin, X. Xu, G. Liang, Luteolin protects against diabetic cardiomyopathy by inhibiting NF-κB-mediated inflammation and activating the Nrf2-mediated antioxidant responses, Phytomedicine 59 (2019) 152774.
【27】Z. Xie, K. Lau, B. Eby, P. Lozano, C. He, B. Pennington, H. Li, S. Rathi, Y. Dong, R. Tian, D. Kem, M.H. Zou, Improvement of cardiac functions by chronic metformin treatment is associated with enhanced cardiac autophagy in diabetic OVE26 mice, Diabetes 60 (6) (2011) 1770–1778.
【28】Y. Wang, J. Zhang, J. Bo, X. Wang, J. Zhu, Hydrogen-rich saline ameliorated LPSinduced acute lung injury via autophagy inhibition through the ROS/AMPK/mTOR pathway in mice, Exp. Biol. Med. 244 (9) (2019) 721–727.
【29】S. Ohta, Molecular hydrogen as a preventive and therapeutic medical gas: initiation, development and potential of hydrogen medicine, Pharmacol. Therapeutic. 144 (1) (2014) 1–11.
【30】J. Bai, N. Zhang, Y. Hua, B. Wang, L. Ling, A. Ferro, B. Xu, Metformin inhibits angiotensin II-induced differentiation of cardiac fibroblasts into myofibroblasts, PLoS One 8 (9) (2013), e72120.
【31】Y. Zhang, X. Liu, X. Bai, Y. Lin, Z. Li, J. Fu, M. Li, T. Zhao, H. Yang, R. Xu, J. Li, J. Ju, B. Cai, C. Xu, B. Yang, Melatonin prevents endothelial cell pyroptosis via regulation of long noncoding RNA MEG3/miR-223/NLRP3 axis, J. Pineal Res. 64 (2) (2018).
【32】Yang, F.; Qin, Y.; Wang, Y.; Li, A.; Lv, J.; Sun, X.; Che, H.; Han, T.; Meng, S.; Bai, Y.; Wang, L., LncRNA KCNQ1OT1 mediates pyroptosis in diabetic cardiomyopathy. Cell. Physiol. Biochem. : international journal of experimental cellular physiology, biochemistry, and pharmacology 2018, 50 (4), 1230-1244.
【33】M.Y. Li, X.L. Zhu, B.X. Zhao, L. Shi, W. Wang, W. Hu, S.L. Qin, B.H. Chen, P. H. Zhou, B. Qiu, Y. Gao, B.L. Liu, Adrenomedullin alleviates the pyroptosis of Leydig cells by promoting autophagy via the ROS-AMPK-mTOR axis, Cell Death Dis 10 (7) (2019) 489.
【34】W. Zhu, R.D. Wu, Y.G. Lv, Y.M. Liu, H. Huang, J.Q. Xu, BRD4 blockage alleviates pathological cardiac hypertrophy through the suppression of fibrosis and inflammation via reducing ROS generation, Biomed. Pharmacother. 121 (2020) 109368.
【35】H. Bugger, C. Bode, The vulnerable myocardium. Diabetic cardiomyopathy, H¨amostaseologie 35 (1) (2015) 17–24.
【36】T. Fukai, M. Ushio-Fukai, Superoxide dismutases: role in redox signaling, vascular function, and diseases, Antioxidants Redox Signal. 15 (6) (2011) 1583–1606.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言