液体管理策略及其与机械通气的相互作用:从实验研究到临床实践
2023-09-10 重症医学 重症医学 发表于上海
本叙述性综述的目的是对不同液体管理和通气策略之间的相互作用提供更好地了解,以及这些相互作用如何影响肺部和远端器官。本综述对机械通气的停用阶段未进行探讨。
摘要
机械通气的患者可以通过静脉注射液体进行限制性液体管理或非限制性液体管理。明确和客观的区分限制性和非限制性液体管理策略,目前文献中缺乏记录。非限制性液体管理被定义为液体量为限制性液体管理的1.2到2倍。限制性液体管理可能导致灌注不足和远端器官损伤,而非限制性液体管理可能引起血管内皮剪切力及糖萼损伤、心血管并发症、肺水肿和远端器官功能障碍。液体和机械通气策略之间的关联,以及它们如何在呼吸机相关肺损伤(VILI)中相互作用,可能会加剧损伤。例如,非限制性液体管理和压力支持通气相结合,而不是压力控制通气,在急性肺损伤的实验模型中可能导致进一步的肺损伤。此外,在非限制液体管理下,应用较高呼气末正压(PEEP)或PEEP突然下降对肺部内皮细胞的损伤程度更高。然而,这些翻译方面的定义很少。本叙述性综述的目的是对不同液体管理和通气策略之间的相互作用提供更好地了解,以及这些相互作用如何影响肺部和远端器官。本综述对机械通气的停用阶段未进行探讨。
重要信息
由于心肺之间生理相互作用,通气管理可能会受到限制性和非限制性液体策略的影响,可能导致危重患者的远端器官损伤。临床前研究评估了不同液体管理,在不同PEEP水平以及PEEP突然降低后,不同状态下辅助通气时呼吸机相关肺损伤的防治策略。
关键词:急性呼吸窘迫综合征、非限制型、限制型、液体管理、机械通气、血液动力学
背景
机械通气(MV)常导致气体交换受损、血流动力学不稳定和内皮细胞损伤。对于接收机械通气的患者,通常需要静脉(IV)液体治疗来恢复血流动力学和远端器官的灌注。根据Paracelsus(1493-1541)和之前的作者:“Dosis sola facit venenum”,所有的东西都是有毒的,正是这一点使一些东西有毒。优化组织灌注和氧气输送,同时防止容量过负荷,是危重患者面临的挑战。限制性液体管理可能与外周灌注不足和远端器官损伤有关。然而,更自由的方法可能会增加死亡率,因为它可能导致内皮细胞损伤、肺和外周组织水肿、腹内压升高以及胃肠道和肾功能障碍。尽管如此,无数的MV模式和设置,如呼气末正压(PEEP)和潮气量(Vt),可以对心血管生理以及容量状态和液体平衡产生不同的影响。辅助或控制MV引起的胸膜(Ppl)和经肺(Ptp)压力的变化已被证明会影响前负荷和后负荷以及毛细管经血管滤过压力。有实验表明,液体与通气策略的不匹配不仅会加重呼吸机诱导的肺损伤(VILI),还会降低心排血量和组织灌注。在特定的情况下,如急性呼吸窘迫综合征(ARDS), 60%以上的患者依赖正性肌力药物以达到适当的动脉压,并经常需要静脉输液作为血流动力学支持的一部分。尽管保护性MV和限制性液体策略已被建议用于危重患者,但这种组合可能会影响远端器官。然而,评估液体疗法与不同模式MV之间相互作用的证据很少。大多数调查限制性和自由液体疗法对器官损伤和死亡率影响的临床研究没有提供关于MV策略的详细信息,反之亦然。本文综述的目的是为了更好地理解液体和MV策略之间的相互作用,以及这种相互作用对肺和远端器官的影响。这篇综述没有探讨MV的脱机期和去复苏期。
生理原理:心肺相互作用和远端器官损伤
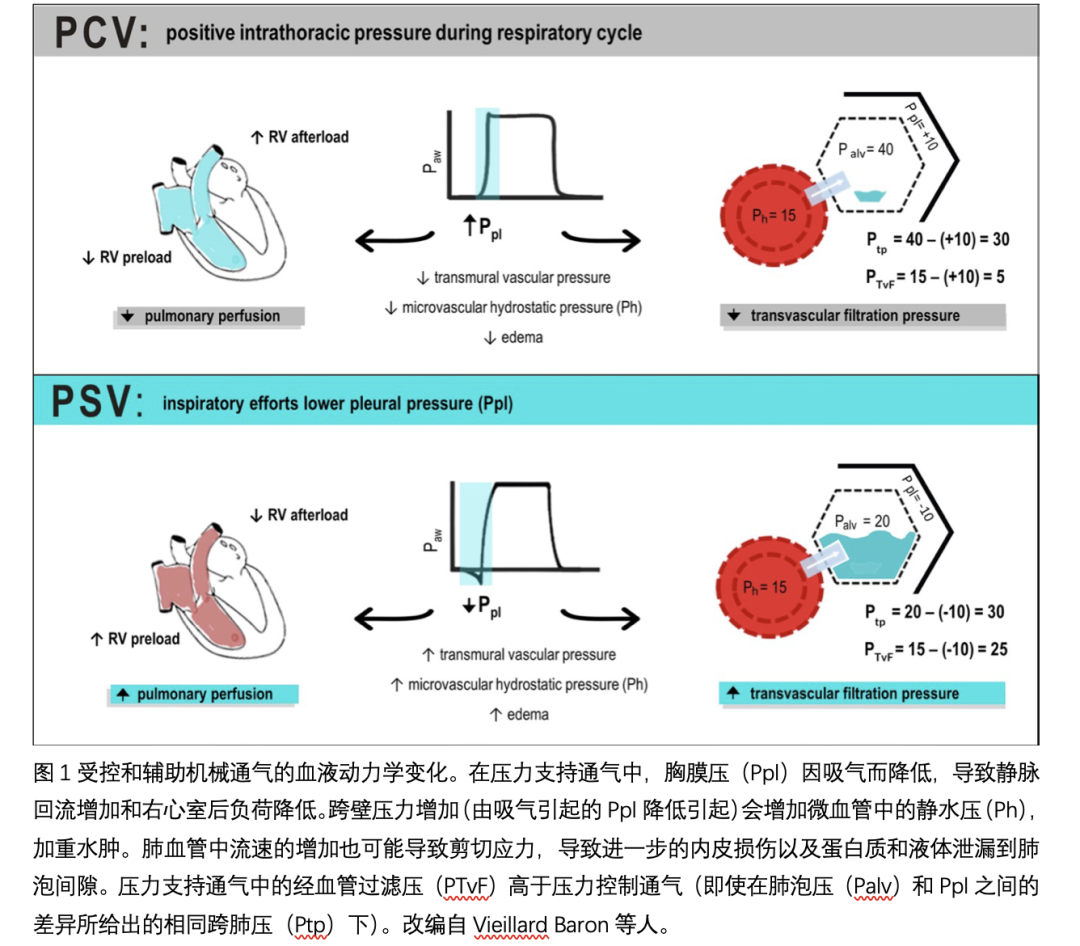
由于其位置,心脏不可避免地受到肺的机械力作用,即Ppl和Ptp。这些力至少对调节心输出量的两个因素有影响:静脉回流和心脏在收缩期处理前负荷的能力。在自主呼吸过程中,Ppl在呼气期为负,吸气期更为负,有利于正常或高血容量时全身静脉回流。正压通气时,胸内压升高,右房压升高,减少了全身静脉回流。反过来,左心室的后负荷会因为较低的跨壁压而减少,而较高的肺泡压力会将血液挤压到左心室,从而短暂地增加前负荷。左心室后负荷减少是由于MV期间胸膜压的增加,而左心室经壁压趋于降低,因为它是心室和胸膜压之间的差异。因此,在MV期间,当Ppl为正时,跨壁压力减小。然而,随着时间的推移,由于压力容积或血管张力的增加,跨壁压力可能会恢复,这反过来会增加平均全身充盈压力,有利于静脉回流。在保护性MV下,约70%±27%的气道压力(Paw)传递到心旁胸膜,37%±17%传递到心包,43%±11%传递到腔静脉;当胸壁顺应性降低时,这些数字可能更高[32]。器官灌注压由流入和流出压力之差决定,因此正压通气时较高的胸内压可能会损害器官灌注,最终导致器官损伤。由于右心室的收缩储备比左心室少,因此呼吸周期中瓣内压力和后负荷波动对右心室的影响大于对左心室的影响。然而,随着时间的推移,由于压力容积或血管张力的增加,跨壁压力可能会恢复,这反过来会增加平均全身充盈压力,有利于静脉回流。在保护性MV下,约70%±27%的气道压力(Paw)传递到心旁胸膜,37%±17%传递到心包,43%±11%传递到腔静脉;当胸壁顺应性降低时,这些数字可能更高。器官灌注压由流入和流出压力之差决定,因此正压通气时较高的胸内压可能会损害器官灌注,最终导致器官损伤。由于右心室的收缩储备比左心室少,因此呼吸周期中瓣内压力和后负荷波动对右心室的影响大于对左心室的影响。这个概念在ARDS中尤为重要,在ARDS中,缺氧血管收缩可增加右心室后负荷,这可能导致右心衰竭。
肺经血管滤过压力定义为血管静水压力(Ph)与Ppl之差。在自主呼吸和辅助通气(如压力支持通气[PSV])中,吸入Ppl越负可能会增加经血管滤过压。在Ppl极负的情况下,由于对阻塞气道的强烈吸气努力,可能会发生肺经血管滤过压的突然增加和肺水肿。自发呼吸(或辅助通气)引起的负Ppl与高血容量(可能由自由液体引起)之间的关联增加了静水压力值,从而增加了水肿的风险,在血管通透性增加的情况下,情况可能更糟。这些机制如图1所示。
MV模式,无论是自发的还是受控的,都可以改变胸内压力,并可能导致血流动力学的改变。鉴于危重患者心肺相互作用对血流动力学的重要影响,血流动力学测试和指标的使用已被广泛认可,以更好地预测容量反应性。
自由水管理和限制性液体管理:寻找一个明确定义
由于没有明确的定义,这只是临床研究中采用的不同术语。在不同的情况下对比了开放性液体管理与限制性液体管理,在没有明确输液速率的前提下,“保守性液体管理”和“限制性液体管理”可以互换使用。例如,对比“限制性液体管理”方法(6 ml/kg/h)与“保守的液体管理”方法(12 ml/kg/h),在这一点上总体没有统一标准。较高的输液速率通常被称为“开放性液体管理”,较早的临床研究使用诸如“标准”、“大容量”甚至“积极”等名称。到目前为止,实验和临床研究使用了“开放性液体管理”一词,输液速率范围非常宽泛,是限制性液体管理输液速率1.2-12倍。
限制性液体管理和开放性液体管理对肺和远端器官损伤的影响
最近的外科和重症监护指南,如ERAS和UK的ARDS管理指南,支持限制性液体治疗。有证据表明,大量输液、高血容量和糖萼损伤之间存在显著关联(表现为血浆多聚糖-1、透明质酸和硫酸肝素增加)。此外,中心静脉和毛细血管静水压升高,可降低器官灌注,促进肺间质水肿。在急性肺损伤的小鼠模型中,相比于限制性容量管理,开放性容量管理更能引起毛细血管静水压增加导致肺间质水肿。此外,较高输液速率甚至会增加术后发生ARDS的风险。如此,过量液体导致的主要后果可能是肺水肿、氧输送减少和远端器官损伤。
液体不足也可能引起器官损伤。例如,过度限制性的方法可导致肾灌注不足,进而导致肾功能损害。拯救脓毒症联盟指出:没有足够的证据表明对于低灌注、低血容量的患者在第一个24小时进行限制性液体复苏是有益的。BaSICS研究显示,相比于慢速的输注晶体液速率,快速输液的ICU患者90天死亡率没有差异。在大型腹部手术中,与开放性容量管理相比,限制性容量管理可导致更高的急性肾损伤、需要肾脏替代治疗和手术部位感染率(分别为8.6%对5.0%、16.5%对13.6%、0.3%对0.9%;所有p < 0.05)。
正如在通过容量反应性实验和心导管监测指导容量治疗中所证明的那样,即使在具体的特殊综合征中,如ARDS,似乎不同容量状态(高或低容量)可能对限制性容量或开放性容量治疗方式有不同的反应。在这项研究中,亚组I(主要是创伤、吸入性或肺炎)在限制性输液治疗下90天死亡率较低(26%对18%),而亚组II患者(脓毒症作为主要危险因素和较低的中心静脉压) 在开放性液体管理下,死亡率较低(40对50%)。液体治疗应根据患者的特殊需要进行个体化。ERAS指南强烈建议在肺手术中避免过度限制或自由的治疗。ERAS还支持目标导向的液体治疗,动态监测肾移植患者的容量状态。本文没有提到液体和MV策略之间的关系。
在过去几十年里,通过液体平衡改善结果的尝试从脱水和负液体平衡到正常血容量,甚至中度高血容量作为主要治疗目标。2018年欧洲重症监护医学学会关于神经重症监护中液体治疗的共识声明,建议针对脑损伤患者进行正常血容量的液体管理。它还建议将液体平衡、动脉血压以及心输出量和血乳酸等变量作为滴定液体的主要和安全终点。
辅助与控制机械通气对肺和远端器官损伤的影响
一些研究表明,在实验和临床研究中,辅助自主呼吸模式(如PSV)可能与VILI和ICU住院时间的减少以及无呼吸机天数的增加有关。虽然辅助通气可以防止可控MV的有害影响,但在辅助通气过程中强烈的吸气努力也可以显著改变胸内压力。这可导致肺灌注和经血管滤过压增加,并促进肺泡水肿。吸气力度增加可能导致患者自发性肺损伤(P-SILI)和负压水肿。在肺内皮损伤的情况下,这种情况可能更严重。最近的一项研究假设肺内不同步(即,pendelluft,在本研究中定义为吸气时从非依赖肺区向依赖肺区移动的Vt的百分比)可能是VILI和P-SILI的主要机制。作者表明,BiPAP期间的局部钟摆可能反映了自发呼吸期间Ppl的局部波动,并与ARDS患者特异性炎症生物标志物的增加有关。另一方面,在严重急性肺损伤的动物模型中,肌肉麻痹和控制通气比自发呼吸更安全。
保护性控制通气(复吸后低Vt和中高PEEP)可降低急性肾损伤发生率,减少肺部并发症和死亡率。然而,根据气道压力,它会影响血流动力学。只要血流动力学改变和抗利尿激素分泌增加,较高的PEEP和吸气压力峰值可能与远端器官损伤有关。此外,由于血流动力学的变化,高PEEP可能对PaO2/FiO2比率产生掩蔽效应,即心输出量减少和静脉混合物比例减少。
1947年,研究人员首次发现,在气道正压下,肾血流量、肾小球滤过率和尿量减少。从那时起,只有少数研究评估了液体和通气策略之间的相互作用。在这里,我们讨论的证据比较辅助或控制通气在限制性和自由液体管理下肺和器官损伤。
对于自主呼吸的患者,PSV是一种常用的辅助通气模式。在辅助通气过程中,强烈的吸气可能导致血流动力学障碍,更高的肺压,肺灌注增加,并可能导致P-SILI。在PSV或辅助模式下明智地调整delta压和较高的PEEP水平有助于预防P-SILI,并可能在辅助通气期间保护患者,这种作用主要是通过自由液体管理。在脓毒症和ARDS中观察到,高毛细血管通透性患者的经血管压力增加(由吸气力增加和自由液体引起)可能导致血管剪切应力、持续的内皮损伤和肺泡水肿。自由液体和PSV联合使用增加了肺泡弥漫性损伤和MMP-9基因表达,降低了与上皮完整性相关的特异性生物标志物(occludin, zone occluden -1和claudin-4)。虽然肾脏形态没有观察到差异,但与限制性液体方法相比,自由液体方法在PSV期间NGAL(中性粒细胞明胶酶相关脂钙蛋白)的表达较低。
控制通气对心输出量和组织灌注的影响部分依赖于Vt。在这种情况下,相同潮气量的压力控制通气(PCV)和容积控制通气(VCV)在MV期间的心输出量相当。然而,当使用较低的Vt时,PCV可能导致较高的心输出量。在VCV中观察到的心输出量减少部分解释了正压通气对肾功能的负面影响。然而,其他机制可能在肾损伤的发展中发挥作用,包括肾内血流的再分配、交感神经系统的过度激活和炎症介质的作用。在尝试改善心输出量时,可建议采用自由液体策略。首先,为了改善心输出量,患者必须有液体反应(如果心输出量反应可以忽略不计,应停止液体);第二,拉伸肺泡上皮细胞可以破坏了紧密的连接;在这种情况下,高静水压力会加重肺水肿。在VCV中,Vt与Ppl呈线性正相关。研究人员已经表明,胸内血管的血管滤过压力是静水血管压力和Ppl之间的差异,在VCV吸气时,上腔静脉的跨壁压力下降,而右心房的跨壁压力没有下降。在自由液体下这种胸内血管跨壁压的降低可以起到保护作用,因为它可以减少经血管滤过和水肿的形成。虽然没有临床研究调查这种相互作用,但富含氯化物的液体可以促进肾血管收缩,在正压通气的情况下可能会更糟。
已经表明,在急性肺损伤模型中,PSV与限制性液体策略的组合导致较少的肺上皮损伤。一个可能的解释是紧密连接的破坏,这是由闭锁蛋白策略的减少而不是限制性液体方法确定的。模式表达之间的相互作用,在仅与MV的自由液体结合的PSV期间的动物中观察到,并且液体策略可能具有机械关系。此外,在上皮和内皮结构细胞中,在拉伸运动过程中会丧失水肿,如果紧密连接,则水肿会进一步增加,这是由PSV中的拉伸应力构成的。
PEEP水平的选择也应该考虑到容量状态。临床研究表明,尽管采用液体策略,但高PEEP水平会降低肾功能,因为它会增加峰值吸气压力。在ARDS小鼠模型中,高呼气末正压通气和自由液体的结合加重了肺损伤。此外,在ARDS的实验模型中,PEEP的突然降低显示增加了club cell16蛋白,这是肺泡上皮细胞损伤标记的标志。当与宽松的液体管理相结合时,它恶化了弥漫性肺泡损伤,并增加了炎症和内皮细胞损伤生物标志物的水平。表1总结了临床前研究的主要发现,这些研究调查了机械通气和液体管理之间的相互作用。
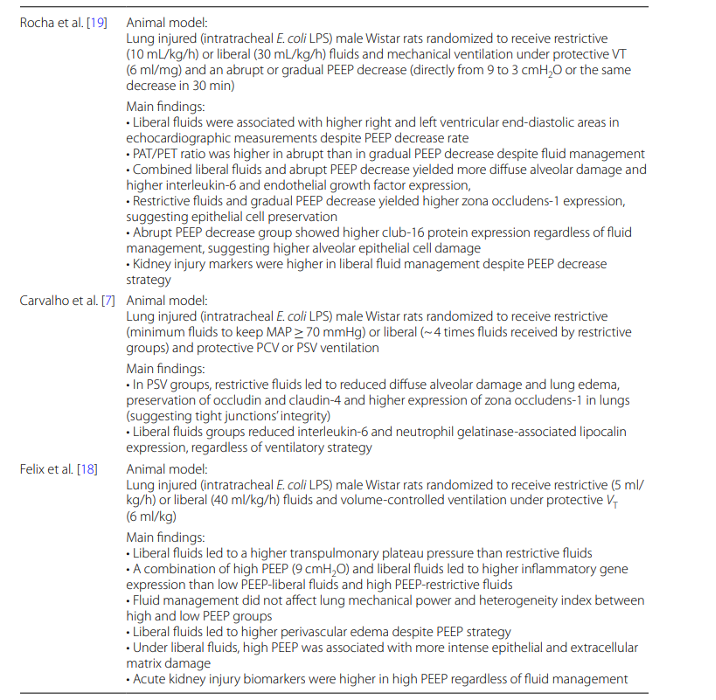
表1 机械通气和液体管理相互作用的临床前研究的主要发现
临床意义
临床证据很少,主要限于少数实验研究,因此对MV和液体管理之间的相互作用对器官损伤的影响仍然知之甚少。因此,以此为基础提出临床建议是鲁莽的。然而,应该指出这些实验研究的一些可能的临床意义。首先,每当强烈推荐限制性或自由通气时,在选择通气策略时应谨慎。特别是在复苏的早期阶段,当需要大量的液体时,大量和快速的静脉注射液体会导致肺和内皮损伤。实验数据表明,尽管有保护性通气,但辅助通气和强有力的吸气可能导致更高的跨血管滤过压、血管水肿和上皮细胞损伤,尤其是合并损伤和呼吸功能障碍时。在这种情况下,小心调整液体疗法或选择控制通气可能是有益的。相反,无论何时应密切监测患者年龄,特别是当使用高PEEP时,或当接受限制性液体和控制MV的联合策略时,远端器官肺顺应性可导致吸气压力高峰。通气设置可能会加重肺损伤,高peep和限制性通气量之间的关系也应仔细考虑,因为高peep和自由通气量之间的关系可能会加重远端器官损伤。
结论
对生理性心肺相互作用的理解是优化液体策略和机械通气设置的基础。不存在限制性或自由性策略的公认定义。限制性和宽松的液体策略可能分别导致灌注不足和远端器官水肿。控制通气策略,尤其是在使用高PEEP水平时,辅助通气可能会损害血流动力学,因此限制性远端器官损伤会导致与自由通气策略相关的肺损伤。由于对血管腔室的影响,建议逐渐转变通气模式以促进肺保护。在危重患者中,机械通气类型和设置的优化应考虑谨慎滴定液体策略。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











