Science子刊:靶向递送肿瘤坏死因子联合化疗,有效延长脑肿瘤患者生存期
2023-06-02 生物世界 生物世界 发表于上海
该研究表明,抗体L19与肿瘤坏死因子(TNF)融合的L19TNF,能够靶向肿瘤新生血管,其与化疗药物洛莫司汀(CCNU)联合用药,能够在原位胶质母细胞瘤小鼠模型中发挥最佳治疗效果。
胶质母细胞瘤(GBM)是最常见和致命的脑肿瘤。由于这类肿瘤恶性程度极高、发展迅速,所以绝大部分患者预后极差:胶质母细胞瘤患者经过手术放化疗等治疗手段后,其生存中位数仅为15个月左右,五年生存率不到5%。
目前新诊断的胶质母细胞瘤的标准治疗包括最大限度的安全手术切除,然后用替莫唑胺进行放化疗。在病情进展时,洛莫司汀(CCNU)被认为是最合适的治疗方法。实际上,CCNU治疗复发性胶质母细胞瘤的总体客观有效率在4.3%-13.9%之间,而完全缓解率不足1.3%。而对于MGMT的启动子未甲基化的胶质母细胞瘤患者,CCNU的有效率几乎为0。而其他治疗策略,例如抗VEGF单抗或抗PD-1单抗治疗,也未能有利于胶质母细胞瘤患者的生存。
近日,瑞士苏黎世大学和意大利Philogen S.p.A公司在 Science 子刊 Science Translational Medicine 上发表了题为:Targeted delivery of tumor necrosis factor in combination with CCNU induces a T cell–dependent regression of glioblastoma 的研究论文。
该研究表明,抗体L19与肿瘤坏死因子(TNF)融合的L19TNF,能够靶向肿瘤新生血管,其与化疗药物洛莫司汀(CCNU)联合用药,能够在原位胶质母细胞瘤小鼠模型中发挥最佳治疗效果。
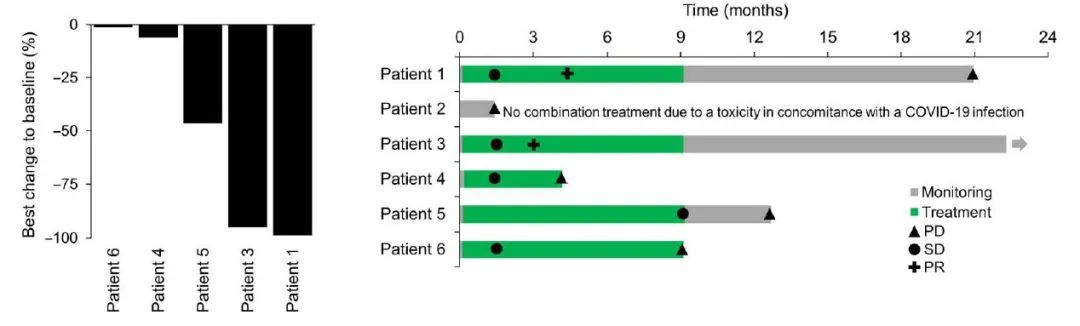
研究团队还在标准治疗后复发的胶质细胞瘤患者中进行了临床试验,结果显示,L19TNF和CCNU联合用药,最初接受治疗的6名患者中有3名出现了客观缓解,4名在6个月时未发生进展。

该研究最近报道了某些抗体-细胞因子融合蛋白,其靶向包括胶质母细胞瘤在内的实体瘤的新生血管和细胞外基质中纤维连接蛋白的肿瘤特异性剪接变体,在临床前原位胶质瘤小鼠模型中具有抗肿瘤活性。特别是,抗体L19与肿瘤坏死因子(TNF)融合的L19TNF,可选择性定位于肿瘤新生血管,能够延长胶质瘤小鼠的存活时间,并让一小部分小鼠长期存活。
在标准放化疗后复发的胶质母细胞瘤患者中,L19TNF具有治疗相关的肿瘤核心坏死的药效学作用,但边缘的肿瘤细胞仍能存活并最终复发,因此,需要更有效的治疗组合。
研究团队探索了L19TNF是否可以与PD-1抑制剂、贝伐珠单抗(VEGF单抗)或CCNU发挥协同作用,用于治疗复发性胶质母细胞瘤。结果显示,L19TNF联合CCNU成为最效果积极的治疗组合,使用免疫功能正常的原位胶质母细胞瘤小鼠模型,L19TNF联合CCNU能够治愈大多数荷瘤小鼠。
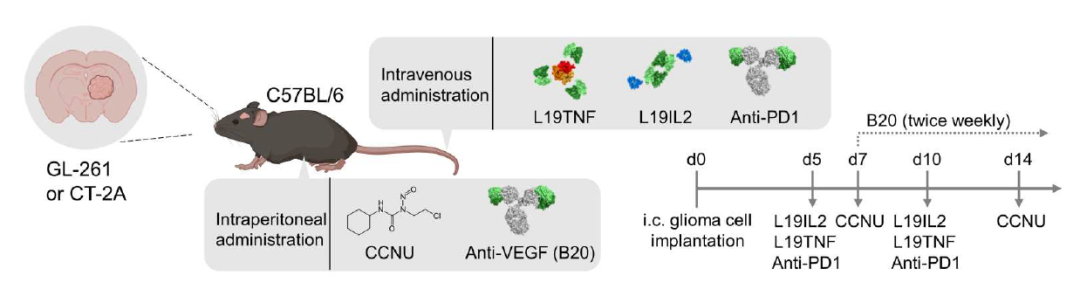
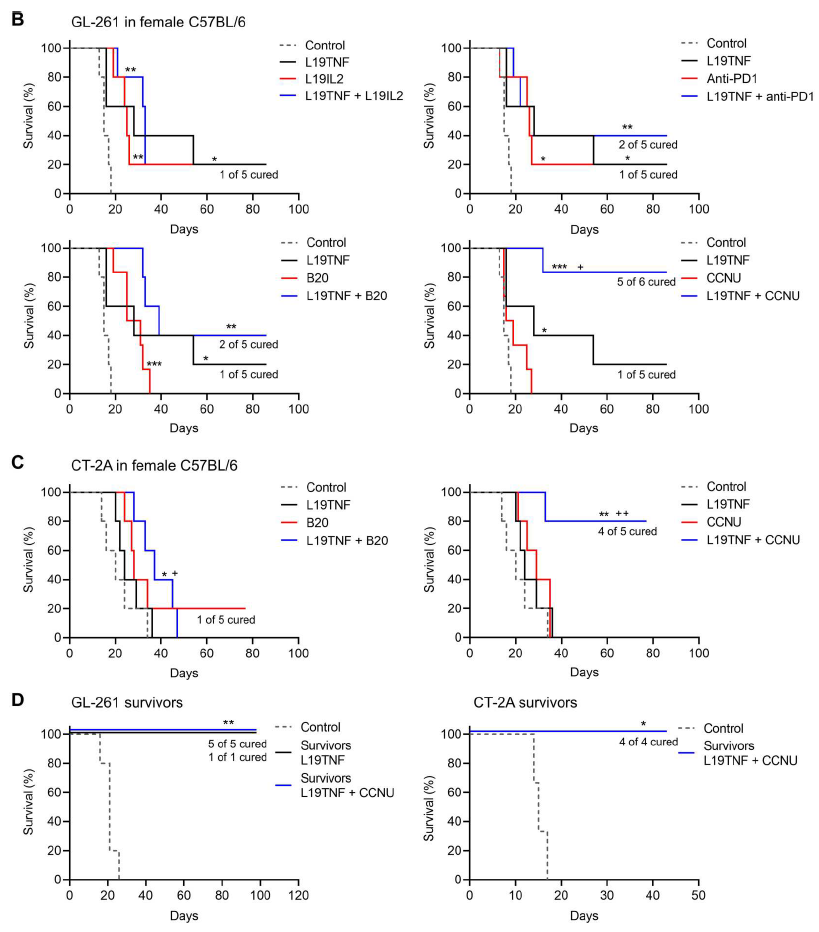
小鼠模型的原位和体外免疫表型和分子分析显示,L19TNF和CCNU联合治疗诱导肿瘤DNA损伤和治疗相关的肿瘤坏死。此外,联合治疗还能上调肿瘤内皮细胞粘附分子,促进免疫细胞向肿瘤浸润,诱导免疫刺激通路,降低免疫抑制通路,还增加了MHC I类分子上的抗原呈递。
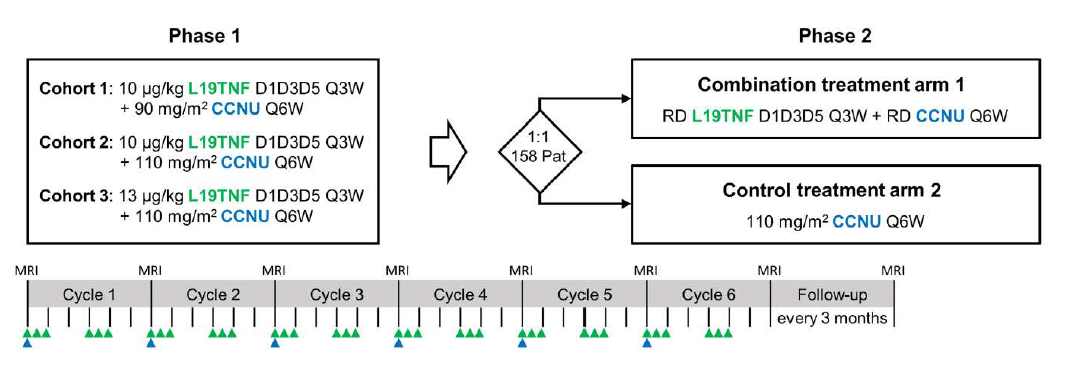
在这些令人鼓舞的临床前研究基础上,研究团队将L19TNF和CCNU联合治疗应用于胶质母细胞瘤患者。
研究团队在标准护理放化疗后首次复发进展的胶质母细胞瘤患者(6名患者)中启动了1/2期临床试验(临床试验编号NCT04573192)。这项仍在进行中的临床试验的初步结果显示,患者对L19TNF和CCNU联合治疗的耐受性良好,已有3名患者出现客观缓解,所有患者的中位无进展生存期为43.3周,显著长于CCNU单药治疗的无进展生存期(4-12周),6名患者中有4名在6个月时未发生进展。
论文链接:
https://www.science.org/doi/10.1126/scitranslmed.adf2281
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











好文章,谢谢分享。
67