赵东元院士团队ACS Nano:介孔左旋多巴纳米制剂,缓解帕金森综合征
2024-10-25 BioMed科技 BioMed科技 发表于上海
复旦大学团队确定 π- 阳离子相互作用可控制左旋多巴自组装,合成介孔纳米制剂,能抑制 α- 突触核蛋白聚集、保护神经元,缓解帕金森症,有望指导纳米药物发展。
由于结合了高效的药物递送效率和介孔结构支持的纳米生物相互作用,将药物直接组装成介孔纳米制剂受到了极大的青睐。然而,由于对聚合物纳米粒子的形成机制,特别是聚合、自组装和成核过程之间的关系缺乏了解,这种方法的发展受到了阻碍。
通过研究左旋多巴和多巴胺的聚合过程,复旦大学赵东元院士和赵天聪研究员等人确定了π-阳离子相互作用是多巴分子自组装和成核控制的关键。因此,通过操纵π-阳离子相互作用,作者可将商业药物左旋多巴直接组装成介孔纳米制剂。合成的纳米球直径约为200 nm,同时具有约8 nm的均匀介孔结构。由于这些纳米制剂富含介孔,可增强手性苯丙氨酸与α-突触核蛋白(Syn)的相互作用,抑制聚集,保护神经元,缓解帕金森氏症。在对抗α-突触核蛋白时,纳米制剂实现了约100%的蛋白质聚集抑制,并将神经元存活率维持在300%。该研究认为,这项工作有望推进介观尺度自组装知识,指导未来的纳米药物发展。相关工作以“Replenishing Cation-π Interactions for the Fabrication of Mesoporous Levodopa Nanoformulations for Parkinson Remission”为题发表在ACS Nano。

【文章要点】
本文成功将商业药物左旋多巴直接组装形成介孔左旋多巴纳米制剂。合成的介孔左旋多巴纳米制剂是直径约为200 nm的均匀球体,含有约8 nm的中孔。作者探索了左旋多巴和多巴胺聚合形成纳米粒子的显著差异,发现π-阳离子相互作用在控制它们的自组装和成核方面起着至关重要的作用,而不是聚合过程。因此,作者通过NaCl、pH等多种因素对左旋多巴/多巴胺成核行为进行调节,最终实现介孔纳米组装体(图1)。
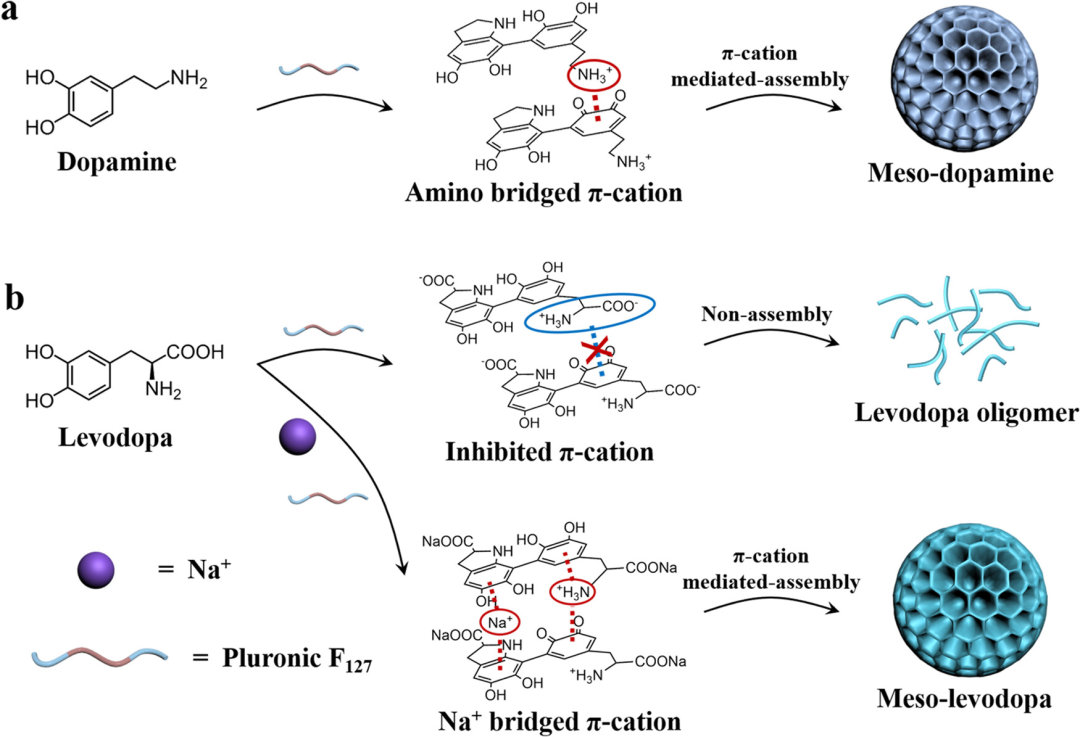
图1 π-阳离子介导制备介孔多巴纳米结构
介孔左旋多巴纳米制剂的丰富介孔增加了左旋多巴手性苯丙氨酸部分与α-突触核蛋白的接触,抑制了α-突触核蛋白聚集,保护了神经元细胞。纳米制剂中的邻苯二酚基团有效地清除活性氧(ROS)和金属离子,缓解PD的病理环境。因此,介孔左旋多巴纳米制剂从多个角度实现了PD症状的全面缓解,包括对α-突触核蛋白聚集的100%抑制,以及将神经元细胞存活率维持在300%(图2)。
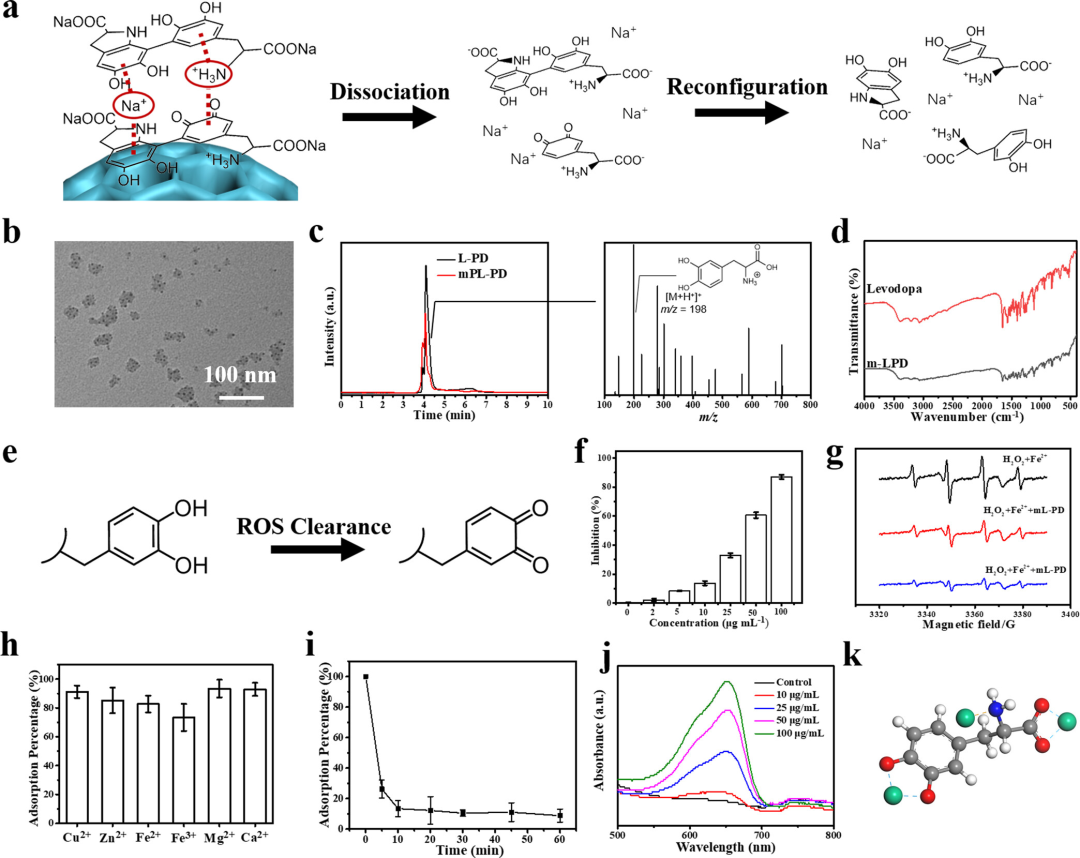
图2 介孔左旋多巴纳米制剂的治疗功能
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.4c09326
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#帕金森氏症# #左旋多巴# #π-阳离子#
22