中国医科大学附属盛京医院发表Mol. Cancer最新综述:免疫疗法披挂上阵对抗三阴性乳腺癌
2023-09-13 BioMed科技 BioMed科技 发表于上海
在该文中,作者重点介绍了克服TNBC独特的肿瘤微环境引起的耐药性,并整合和分析了免疫检查点抑制(ICIs)在治疗TNBC的进展。展望了免疫治疗在 TNBC 治疗中的未来发展方向。
三阴性乳腺癌(TNBC)是指雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体(HER2)免疫组化染色均为阴性的一种特殊性乳腺癌。因其分化低、侵袭性高、易转移、预后差及复发率高等特点,尚未发现何种战术能有效抵挡其祸害机体前进的步伐。新兴的免疫疗法作为一种刺激人体免疫系统杀死肿瘤细胞的治疗策略,它的运用给TNBC 的治疗带来了突破性进展。那么,免疫疗法是如何在TNBC的治疗中攻己之盾的呢?
近日,中国医科大学附属盛京医院顾玺及其团队在Molecular Cancer上发表了一篇综述文章,题为《Advances in immunotherapy for triple-negative breast cancer》。在该文中,作者重点介绍了克服TNBC独特的肿瘤微环境引起的耐药性,并整合和分析了免疫检查点抑制(ICIs)在治疗TNBC的进展。展望了免疫治疗在 TNBC 治疗中的未来发展方向。

肿瘤微环境(TME)与TNBC的耐药性
肿瘤微环境 (TME) 包括肿瘤细胞、癌症相关成纤维细胞 (CAF)、免疫细胞(包括B和T淋巴细胞)、自然杀伤 (NK) 细胞、肿瘤相关巨噬细胞 (TAM)、脉管系统、细胞外基质(ECM)和信号分子。TME 的成分相互作用,促进 了TNBC 耐药性的发展。此外,TNBC肿瘤细胞的增殖、代谢重编程和细胞凋亡抵抗会塑造缺氧、酸中毒和氧化应激的TME。缺氧以及氧化应激和酸中毒可诱导赖氨酰氧化酶(LOX)的激活,并重塑ECM,导致化疗耐药的形成。研究发现,脯氨酸-4-羟化酶α多肽Ⅰ/缺氧诱导因子(P4H-α1/HIF-1)轴的激活可增强 TNBC 细胞的干细胞特性,导致氧化磷酸化和活性氧减少。CAF诱导的脂质相关巨噬细胞诱导TNBC的免疫抑制。脂肪细胞诱导油酸的产生,诱导TNBC细胞抵抗铁死亡。M2巨噬细胞分泌血管内皮生长因子(VEGF)并激活前列腺癌相关转录本6(PCAT6),促进TNBC细胞的生长和转移。总之,TME与TNBC耐药性存在“共生效应”。
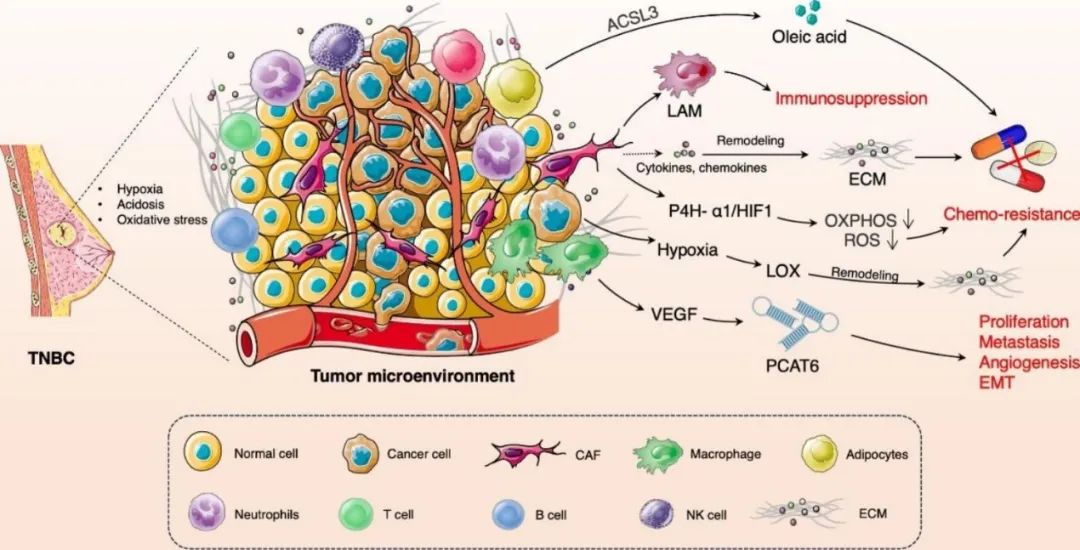
图1. TME与TNBC耐药性的联系。
重塑TME
异常的TME是化疗和免疫治疗的主要障碍。利用植物化学物质、肠道微生物群代谢物和免疫细胞及细胞因子,削弱基质屏障和改善免疫抑制微环境重塑TME,有助于优化 TNBC 抗肿瘤治疗。
利用植物化学物质改善TME。人参皂苷 Rg3 是人参的一种成分,具有抗肿瘤活性。Rg3可以渗透到肿瘤中,抑制CAF、TGF-β和胶原蛋白,在TNBC中提供化疗增敏作用。Rg3与紫杉醇(PTX)联用可抑制核因子κB(NF-κB)通路,增强TNBC治疗中化疗药物的细胞毒性。基于Rg3的脂质体具有优异的包封率和载药能力,可实现肿瘤靶向和TME重塑。漆树酸(6-十五烷基水杨酸,6SA)存在于漆树的树皮中,对 TNBC 也表现出较强的抗肿瘤作用。它可以通过激活ERK/NF-κB通路,增强一氧化氮 (NO) 和细胞因子的释放,引发巨噬细胞的活化,促进免疫细胞的激活。也能通过诱导半胱氨酸蛋白酶8(caspase-8)介导的细胞凋亡。还能诱导干扰素-γ (IFN-γ) 和肿瘤坏死因子-α (TNF-α)的分泌,增强 TNBC中的肿瘤免疫微环境。
利用肠道微生物群代谢物重塑TME。在TNBC的免疫调节亚型中,含有大量的梭状芽胞杆菌和相关代谢物三甲胺氧化物 (TMAO)。TMAO可通过激活内质网激酶(PERK)诱导GSDME蛋白介导的细胞焦亡,并分泌炎症因子(IL-18和IL-1β)到TME中,增强CD8+ T细胞的浸润和细胞毒性。
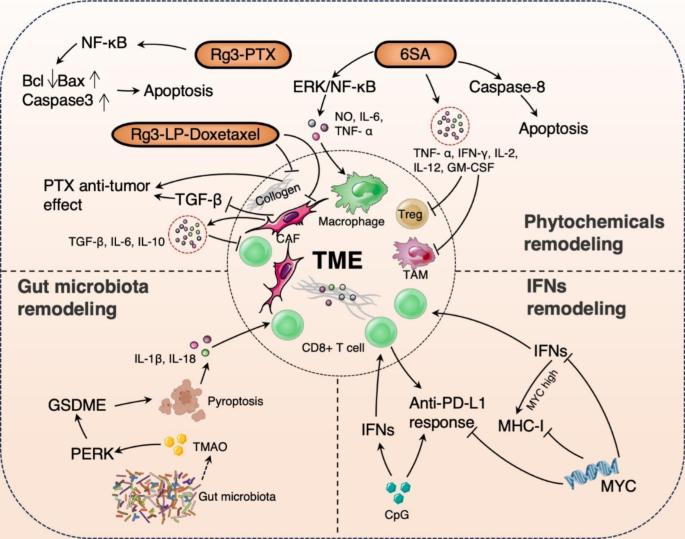
图2. 重塑TNBC免疫治疗中TME。
调节干扰素表达改善TME。I型干扰素:IFN-α和IFN-β,对不同的免疫细胞均有广泛的影响。如增强NK细胞的细胞毒性及其分泌IFN-γ的能力,促进抗原呈递细胞的分化、成熟和迁移。另一方面,IFN-γ属于II型干扰素,具有抗病毒、抗肿瘤和免疫调节特性,能够激活其他免疫细胞并促进免疫反应。在某些TNBC病例中,原癌基因MYC过度表达,它通过抑制IFN信号通路、降低组织相容性复合体 (MHC-I)表达、削弱CD8+ T 细胞浸润和下调抗 PD-L1反应促进免疫抑制。未甲基化的胞嘧啶-磷酸-鸟嘌呤(G) (CpG) 寡脱氧核苷酸是合成Toll 样受体9 (TLR9)激动剂,可刺激树突状细胞(DC)产生I型干扰素,激活 T 细胞和B细胞,招募NK细胞,诱导体液和细胞免疫,并上调IFN释放,最终促进CD8 + T细胞的浸润。与抗PD-1抑制剂联合使用时,CpG也展现出具有较强的疗效。
靶向 TNBC免疫治疗中的耐药性
ICI获得性耐药机制主要包括:p53的缺失或突变引起的PD-1/PD-L1 治疗的耐药性;TNBC细胞高表达趋化因子受体2(CXCR2),从而维持癌症干细胞(CSC)的干性导致的化疗耐药性;TNBC细胞高表达CD44和PD-L1引起CSC干性免疫逃逸造成的耐药性。对以上耐药机制进行干预,将有效克服TNBC的免疫治疗耐药性。
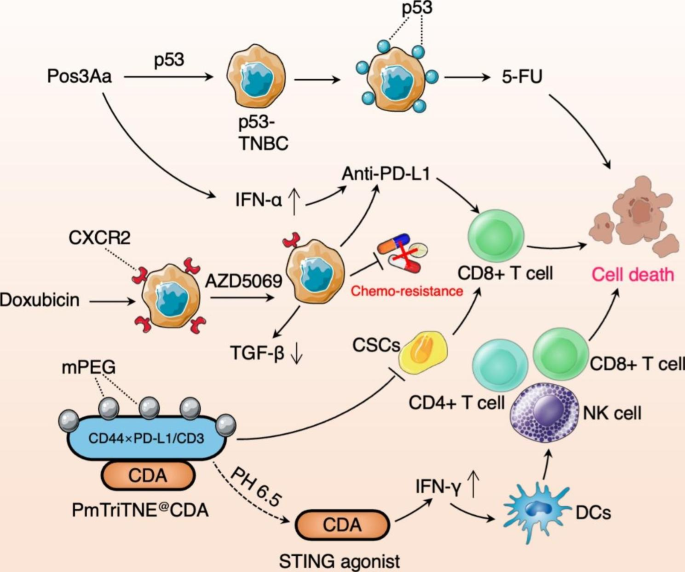
图3.克服 TNBC 免疫治疗耐药性机制
ICI单一疗法
ICIs是利用免疫应答的“刹车”机制,通过抑制肿瘤细胞或免疫细胞上的免疫检查点,激活免疫系统对肿瘤细胞的攻击作用。PD-1(CD279)/PD-L1(CD274 或 B7 同源物)和CTL-4 (CD152)抑制剂已成功获得监管部门批准,用于多种癌症类型的治疗。TNBC免疫炎症类型微环境表现出免疫检查点分子高表达的特征。利用抗PD-1/PD-L1治疗,抗CTLA-4治疗以及两ICI相结合的方式将有望提高TNBC的治疗效果。
ICI与其他治疗方式相结合
ICI与化疗相结合。蒽环类药物、紫杉烷类药物、顺铂、阿霉素和白蛋白结合型紫杉醇以及艾日布林与ICI联合使用,可以增强早期和易转移性TNBC的临床治疗效果。
ICI 与放疗联合。低剂量放疗前使用CTLA-4抑制剂可增强TNBC的抗肿瘤疗效。但在进行放射治疗时,肿瘤特异性和非肿瘤特异性抗原都可能被释放到 TME中;这可能会激活自身反应性T细胞,并可能攻击和损伤正常组织。因此,需进一步探索放疗和免疫治疗的最佳联合策略。
ICI 与基因治疗相结合。通过融合腺病毒和TGFβ受体II IgG Fc片段 (sTGFβ RIIFc)产生的蛋白质Ad.sT,来干扰TGF β-1结合并抑制TGF-β依赖性转录,提高ICIs的免疫治疗效果。腺病毒介导的单纯疱疹病毒(HSV)胸苷激酶注射到mTNBC肿瘤中,提高了mTNBC治疗效果。
ICI与靶向治疗联合。ICI 联合聚(腺苷二磷酸核糖)聚合酶(PARP)抑制剂(PARPIs),通过cGAS-cGAMP-STING轴上调IFN反应,上调PD-L1表达,并增加 TNBC 细胞系中的肿瘤免疫原性。ICI联合抗血管生成药物,刺激CD8+T细胞和巨噬细胞分泌分泌骨桥蛋白(OPN),并促进TGF-β的产生,从而上调PD-1的表达。ICI 联合PI3K/AKT通路抑制剂及化疗能提高TNBC治疗效果。与糖基化蛋白抑制剂相结合,通过减少B7同源3(B7H3)糖基化并恢复癌细胞对细胞毒性T细胞介导的死亡脆性来增强T细胞的活化。ICI与纳米技术结合,确保了负载药物的靶向递送和稳定性,并增强了TNBC的药物摄取和生物相容性。
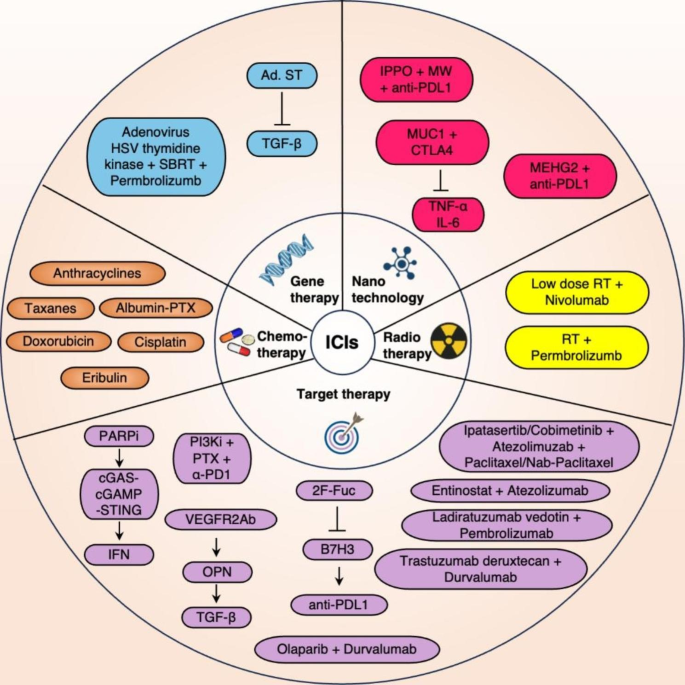
图4. ICIs 联合其他治疗方法对抗TNBC。
癌症疫苗
肿瘤疫苗利用癌细胞、抗原或其他相关生物成分赋予宿主并产生有效的抗肿瘤免疫反应。当前Adagloxad Simolenin疫苗,α-乳清蛋白工程疫苗,DR5 DNA疫苗,DC融合疫苗,及个性化肽疫苗PPV均在治疗TNBC方面取得了一定功效。
细胞免疫疗法
利用嵌合抗原受体T细胞 (CAR-T) 疗法。如唾液酸神经节苷脂(GD2)-CAR-T细胞、MUC28z CAR-T细胞和含有CAR-T细胞的纤维蛋白凝胶对TNBC细胞生长均显示出显著的抑制作用。
利用NK细胞疗法。来源于癌症患者的NK细胞对TNBC细胞和异种移植肿瘤模型均表现出强细胞毒性。在此基础上,将RT、PD-L1检查点抑制剂Avelumab、硒代胱氨酸、TGF-β抑制剂、钌复合物、核酸适体及基因工程等方法与NK细胞疗法结合,均增强了NK细胞介导的细胞毒性作用。
细胞因子诱导的杀伤细胞(CIK)疗法。CIK细胞是是将人外周血单个核细胞在体外用多种细胞因子(如抗CD3单克隆抗体、IL-2和IFN-γ等)共同培养一段时间后获得的一群异质细胞,表现出 T 细胞和 NK 细胞的功能和表型特征。CIK细胞和西妥昔单抗或CIK细胞与粘着斑激酶(FAK)抑制剂的联合给药证明能显著阻碍TNBC的生长增殖和转移。
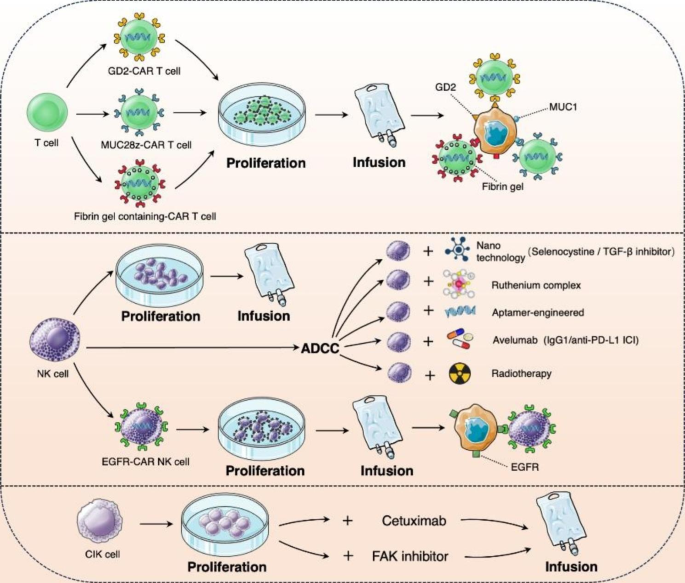
图5. CAR-T细胞、NK细胞和CIK细胞单独或联合治疗TNBC
TNBC 治疗的双特异性抗体方法
双特异性抗体(BsAb)是指人工工程化的抗体,能够同时特异性结合两种抗原或抗原表位。具有滋养层细胞表面抗原2(TROP2)和CD3的双特异性抗体F7AK3能促进T细胞的募集。靶向间皮素和CD16的双特异性抗体MesobsFab能招募NK细胞,并导致在间皮素阳性肿瘤中诱导抗体依赖细胞介导的细胞毒性作用(ADCC效应)。针对TGF-β和人PD-L1的BiTP,增加了胶原沉积、TIL浸润、CD8+ T细胞渗透。
【总结】
面对“诡计多端”的TNBC,人们联合化疗、靶向治疗、替代免疫治疗方法、细胞治疗和放疗等治疗策略,“临危不惧”,取得了免疫治疗反应率的小胜利。要想获得最终的胜利,仍有许多问题待解决。首先,缺乏有效的免疫标志物,缺乏对高、中、低风险人群分类的精确标准。其次,免疫疗法仍处于发展的早期阶段,不能明确所有TNBC 患者相关的免疫检查点。此外,已经研究探讨了TNBC的分子特征及其与 TME 和免疫细胞的动态关系,但实体存在异质性;且在临床试验中,其他疾病可能带来免疫治疗相关的不良反应。TNBC 新辅助免疫治疗的临床研究中调查研究终点总生存期(OS),无病生存期(DFS)存在弊端。TNBC免疫治疗道阻且长,行则将至!
原文链接:
https://doi.org/10.1186/s12943-023-01850-7
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言