担心胰腺癌术后“卷土重来”,肿瘤知情ctDNA-MRD针对I-III期患者均能预测复发风险
2024-08-18 苏州绘真医学 苏州绘真医学 发表于上海
研究对胰腺导管腺癌患者围手术期 ctDNA 检测分析,发现其与患者生存结果相关,可用于识别分子残留疾病、预测复发,KRAS 突变状态也影响预后。
胰腺导管腺癌(PDAC)患者中,个体化肿瘤知情循环肿瘤DNA(ctDNA)检测是可行的,并可用于识别分子残留疾病(MRD)。在这项对来自美国多家机构的商业病例的回顾性分析中,对PDAC患者的个体化、肿瘤知情、全外显子组测序和胚系控制的ctDNA水平进行了量化和分析。从2019年11月到2023年3月,在诊断、围手术期(MRD 窗口;术后2-12周内,治疗前)和监测期间(如果没有辅助化疗(ACT),则在术后>12周,或从ACT后4 周开始)采集了299名经过临床验证的患者的血浆样本(n=1329)。
在最初诊断为I-III期PDAC并接受切除术的患者中,手术后的中位随访时间为13个月(范围:0.1-214)。在MRD和监测窗口期间,ctDNA阳性检出率分别为29%(29/100)和29.6%(45/152)。在 MRD 窗口内(ctDNA阳性患者的中位DFS(无病生存期)为6.37个月,ctDNA阴性患者的中位DFS为33.31 个月;HR:5.45,P < .0001)以及监测期间(ctDNA阳性患者的中位DFS为11.40个月,ctDNA阴性患者的为NR;HR:12.38,P < .0001), ctDNA检测阳性与较短的DFS显著相关。此外, KRAS野生型状态的DFS明显较好,其次是KRAS G12R(HR:0.99,P = .97)、KRAS G12D(HR:1.42,P = .194),KRAS G12V状态的 DFS 较差(HR:2.19,P = .002)。在多变量分析中,在监测时ctDNA检测被发现是复发的最重要预后因素(HR:24.28,P < .001)。
在PDAC中,围手术期肿瘤知情ctDNA检测在所有阶段(I-III期)都是可行的,并且与患者的生存结果相关。
研究背景
胰腺癌占所有癌症诊断的3%,占所有癌症相关死亡的近7%。预计到2030年,胰腺癌将成为癌症相关死亡的第二大原因。约80%的患者被诊断为局部晚期不可切除或转移性疾病,因此只有15%-20%的胰腺导管腺癌(PDAC)患者在诊断时适合手术切除。即使是接受潜在治愈性切除的患者,也有大约75%的患者在治愈性手术和辅助化疗后全身复发。据报道,任何阶段的PDAC总体5年生存率为12%,而转移性疾病患者的总体5年生存率仅为3%。
对于可切除的PDAC患者,美国国家综合癌症网络(NCCN)指南建议在切除后进行6个月的辅助化疗(ACT)以根除微转移性疾病。但是,NCCN专家小组和许多专家胰腺癌中心现在建议对早期微转移扩散风险高但仍考虑手术切除的患者进行总共6个月的围手术期或完全新辅助化疗(NAC)。这些高风险患者有肿瘤相关症状、癌抗原19-9(CA19-9)升高、原发性肿瘤较大、区域淋巴结肿大以及与血管受累有关的影像学发现。美国临床肿瘤学会(ASCO)指南建议对无法接受前期手术的可切除PDAC患者进行NAC。
尽管临床试验表明,无论病理N分期和边缘状态如何,ACT均优于单纯切除术,可改善总体生存率 (OS),但至关重要的是使用可帮助分层高危患者的工具来改进治疗模式,这些患者最有可能出现疾病复发/进展,并且可能最受益于新辅助和辅助全身治疗以及临床试验。目前,临床症状、血清生物标志物CA 19-9(唾液酸化Lewis A血型抗原)以及CT或MRI形式的增强成像用于疾病监测。然而,CA 19-9是一种非特异性生物标志物,因为它可能在恶性和良性疾病(例如胆道炎症或阻塞)中升高。此外,Lewis抗原阴性个体可能不分泌CA 19-9。最后,标准影像模式依赖于对可测量病变的明显检测,在确定腹膜疾病方面极其困难,并且无法检测亚临床分子残留疾病(MRD)。
循环肿瘤DNA(ctDNA)已成为一种微创生物标志物,可在分子水平上检测出疾病复发,比影像学发现或传统血液生物标志物提前数月。许多针对多种癌症类型的研究都证明了ctDNA在检测MRD和指导治疗决策方面的实用性。在本研究中,研究者使用个体化肿瘤知情多重(m)PCR下一代测序(NGS)ctDNA检测 (Signatera) 研究了纵向ctDNA定量的临床实用性,用于MRD检测、围手术期治疗效果监测以及在监测期间预测复发。研究者提供的证据表明,ctDNA状态可以预测复发,可用于改善围手术期治疗患者的风险分层。
研究结果
患者队列:
共收集了298名经临床验证且考虑进行手术患者的1329份血浆样本。大多数接受检测的患者肿瘤为可切除/边缘可切除(由治疗医生定义)(N = 258;86%)。PDAC患者被定义为I期(N = 85;28%)、II期(N = 99;33%)、III期(N = 73;24%)和IV期(41;14%)。83%(N = 248)的患者接受了手术,其中47%(N = 140)接受了新辅助治疗。该队列的中位年龄为67.1岁(范围:28.2-88.4岁)。在分析术后<6个月首次检测ctDNA时间点的时间时,68.9%(100/145)的患者首先在MRD窗口进行检测(2-4周:21.38%[31/145],4-8周:40%[58/145],8-12周:14.48%[21/145])和21.38%(31/145)的患者首先在监测窗口进行检测。
对于纳入生存分析的患者(N = 231),术后随访时间中位数为13个月(0.1-107个月)。MRD 和监测窗口期内的ctDNA阳性检出率分别为29%(29/100)和29.6%(45/152)(图1A)。在检查监测窗口期内ctDNA检出率与疾病分期的相关性时,研究者观察到术后ctDNA阳性率(N = 231)随分期增加而增加:I期为39%(30/77),II期为46.2%(42/91),III期为61.9%(39/63)(图1A)。此外,III期患者的影像学复发率(44.7%;17/38)高于I期患者(32.1%;18/56)或II期患者(36.2%;21/58)。
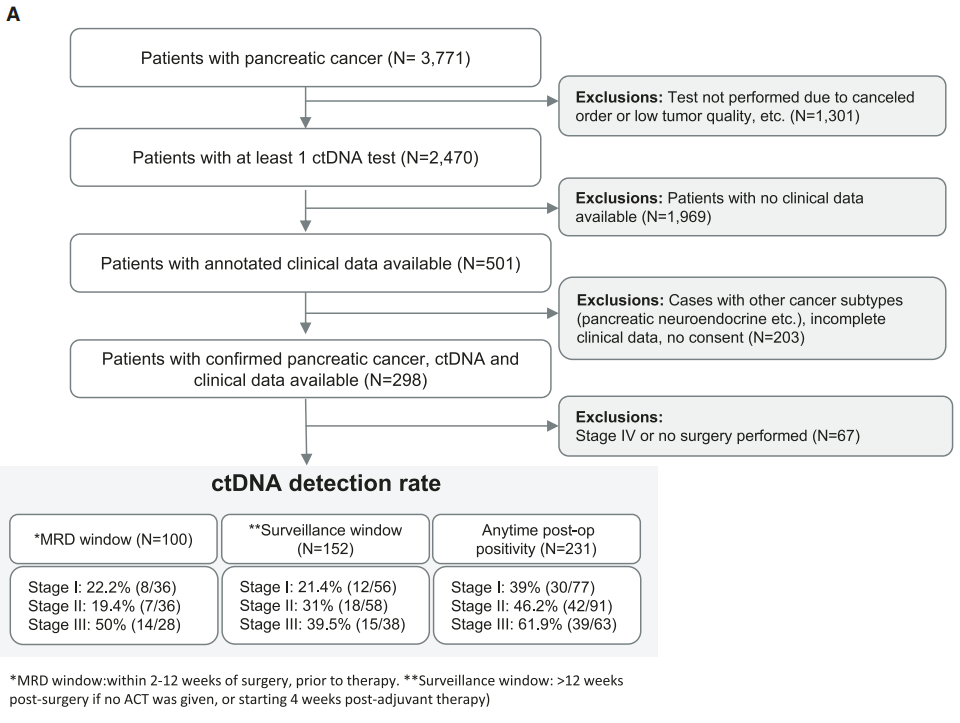
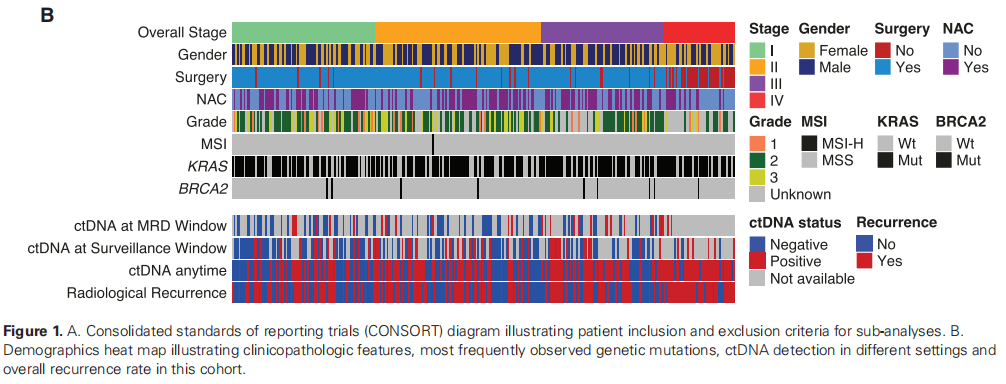
图1
MRD窗口期内ctDNA检测与患者预后的关系:
对于生存分析,仅纳入MRD窗口内可用ctDNA和DFS数据的I-III期(N = 100)临床验证患者。ctDNA阳性与明显较短的中位DFS相关(ctDNA阳性患者的mDFS为6.37个月,而ctDNA阴性患者的mDFS为33.31个月;HR:5.45,95%CI,2.94-10.1,P < .0001)(图2A),并且在所有阶段都观察到了这种趋势(I期:HR 18.64;P < .0001,II期:HR 7.92;P = .0003,III期:HR 8.61;P = .007)。在MRD窗口期(手术后2-12 周)分析的患者中,57%(57/100)接受了NAC,43%(43/100)接受了前期手术,ctDNA阳性检测率分别为21.05% (12/57)和39.53%(17/43)。与接受NAC的ctDNA阴性患者相比,接受预先手术的ctDNA阴性患者的结果相似(HR 1.06,95%CI,0.45-2.52,P = 0.89),而NAC或预先手术后仍然为ctDNA阳性患者的复发率(RR)更高(接受NAC的ctDNA 阳性患者的RR:91.6%,11/12;接受手术的ctDNA阳性患者的RR:70.5%,12/17 vs 接受NAC的ctDNA阴性患者的RR:33.3%%,15/45;接受手术的ctDNA阴性患者的RR:30.8%,8/26)并且DFS明显较差;HR 6.78,95%CI,2.95-15.58,P < .0001和HR 4.85,95%CI,2.21-10.63;P < .0001(图2B)。
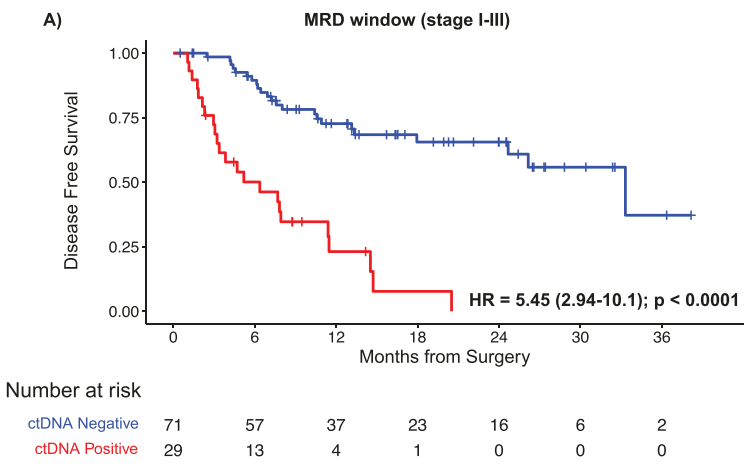
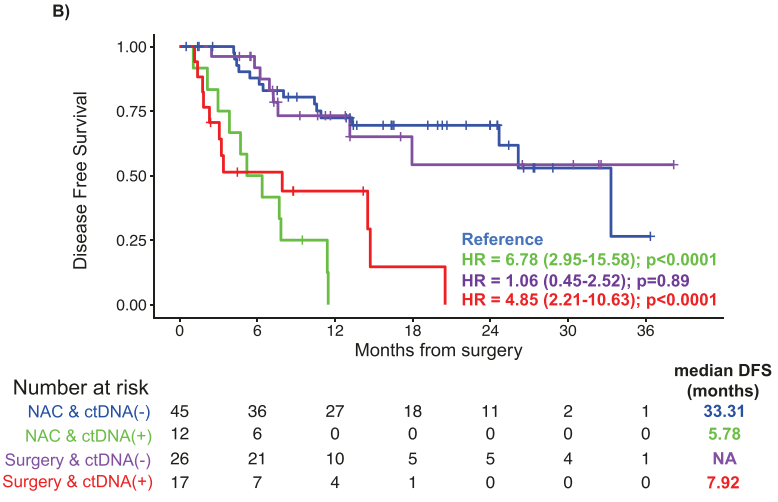

图2
接受新辅助治疗的患者与接受直接手术的患者相比,ACT的益处(按ctDNA状态分层):
在一项探索性分析中,研究者进一步研究了ACT对于接受NAC治疗的患者与直接手术患者的益处,并按术后MRD ctDNA状态分层。一般而言,对于接受直接手术的可切除PDAC患者,6个月的ACT是标准治疗方法。在本队列中,研究者观察到直接手术队列中未接受ACT的患者数量有限,这与其他辅助研究一致,且多于围手术期研究。对于接受NAC治疗的患者,术后ACT的价值尚不明确,因为目前尚无数据显示是否省略ACT会改变生存率。在本研究中,按ctDNA状态分层时,无论是否接受ACT,接NAC治疗且在MRD窗口中ctDNA呈阳性的患者均显示出更差的预后(图3)。这表明,接受NAC和手术后ctDNA呈阳性的患者可能患有化疗耐药性疾病,应考虑采用不同的ACT方案(“转换疗法”)或参加临床试验。本研究结果受到本研究非随机性质的限制,病情更严重的患者更有可能接受NAC。出乎意料的是,如果患者在完成新辅助化疗或手术后ctDNA呈阴性,那么接受ACT的患者与未接受ACT的患者相比,DFS呈下降趋势。
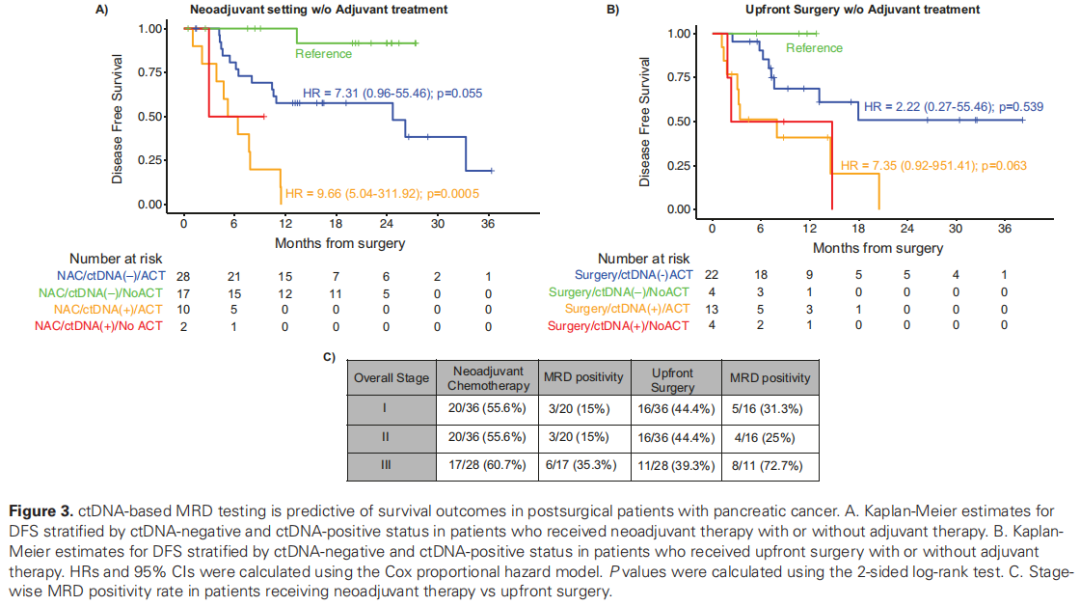
图3
监测期间ctDNA检测与患者预后的关系:
同样,在监测期内(N = 152),ctDNA阳性与中位DFS减少密切相关(mDFS:ctDNA阳性为11.4个月,ctDNA 阴性为NR;HR:12.38,95%CI,6.79-22.55,P < .0001)(图4A)。这一趋势在所有阶段都保持一致且显著(I期:HR 11,P < .0001;II期:HR 9.76,P < .0001;III期:HR 21.54,P < .0001)。为了检查ctDNA阳性对复发风险的相关贡献,研究者对该队列中的可用预后因素(性别、NAC、ACT、KRAS突变、分期和CA19-9)进行了多变量分析。研究者发现在监测窗口期间只有检测ctDNA才是DFS的独立且显著的预测因素(HR:24.28,95%CI,4.15-141.9,P < .001),而不是CA19-9水平、KRAS突变状态、性别、分期或围手术期治疗。即使考虑到标准护理生物标志物CA 19-9的浓度差异(小于或等于 37 U/mL),其在该队列中预测DFS的能力也不显著(P = .325)(图4B)。
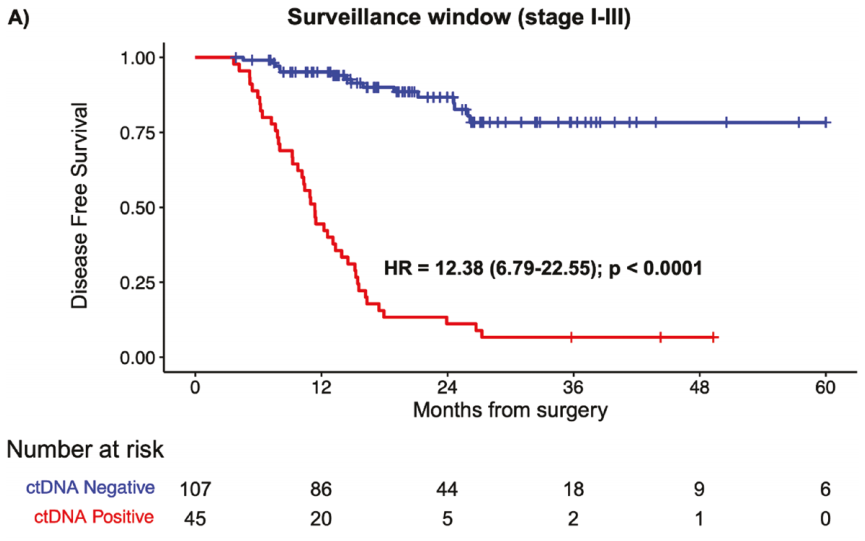
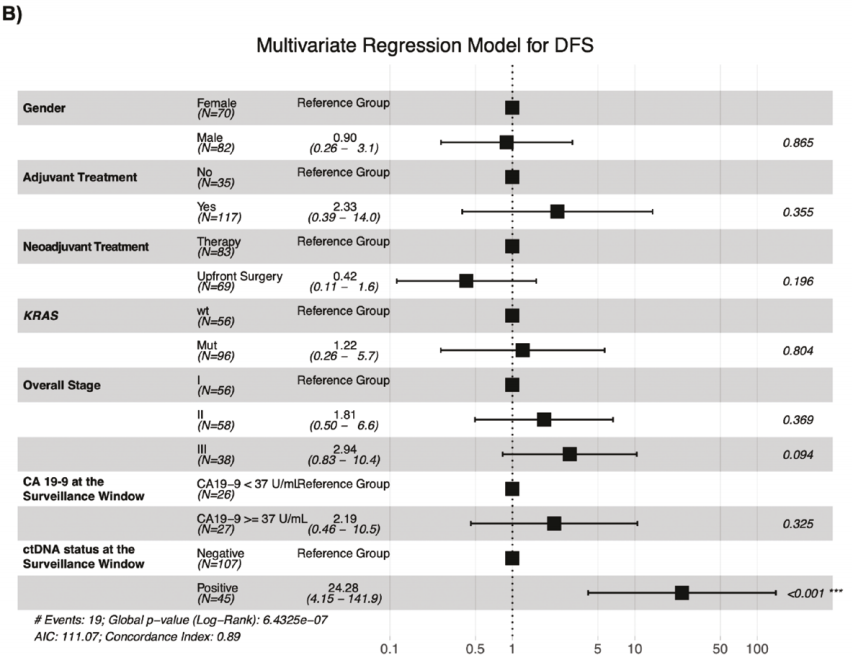

图4
ctDNA动态与患者预后的关系:
接下来,研究者研究了术后肿瘤知情ctDNA动态是否与DFS相关。研究者比较了患者在术后MRD时间点和监测期间的任何时间点的ctDNA状态。在本次分析中纳入的总共78名患者中,15.85%(14/78)保持ctDNA阳性,58.53%(42/78)保持ctDNA阴性,而23.17%(19/78)从阴性转为阳性,2.43%(3/78)从阳性转为阴性(图5)。与持续阴性患者的RR(3.3%,3/42)相比,持续阳性患者的RR明显较高(92.9%(13/14);HR 36.95,95%CI,10.18-134.15;P < .0001)或由阴性转为阳性患者的RR明显较高(94.7%(18/19);HR 19.62,95%CI,5.76-66.88;P < 0.0001)(图5)。
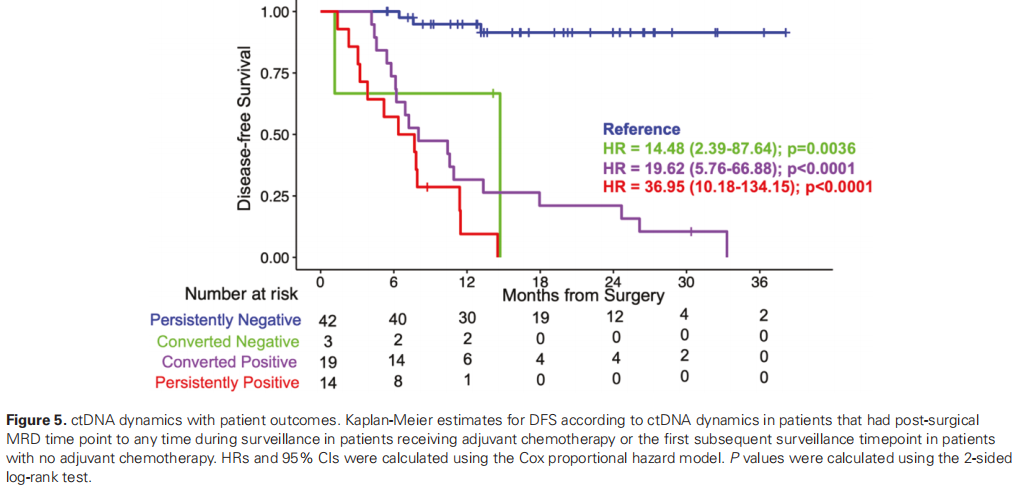
图5
患者水平的基因组特征:
研究者对Natera商业数据库提供的WES数据进行了探索性分析,以确定所有患者(N = 298)的基因组图谱和特征。WES结果显示,在考虑非同义变异时,突变型KRAS(72%)和BRCA1/2缺失(10%)是最常见的突变基因。在本分析中,有28%(84/299)的患者为KRAS野生型。在KRAS突变( n = 215)中,37.7%(81/215)为G12D,33.9%(73/215)为G12V,18.6%(40/215)为G12R,在此队列中未发现G12C突变。MSI状态0.3%(1/298)与疾病分期之间无显著关联。肿瘤分期和任何基因突变频率之间未观察到趋势。在本队列中,与KRAS野生型相比,KRAS G12V和G12D与DFS明显较差相关(图6)。
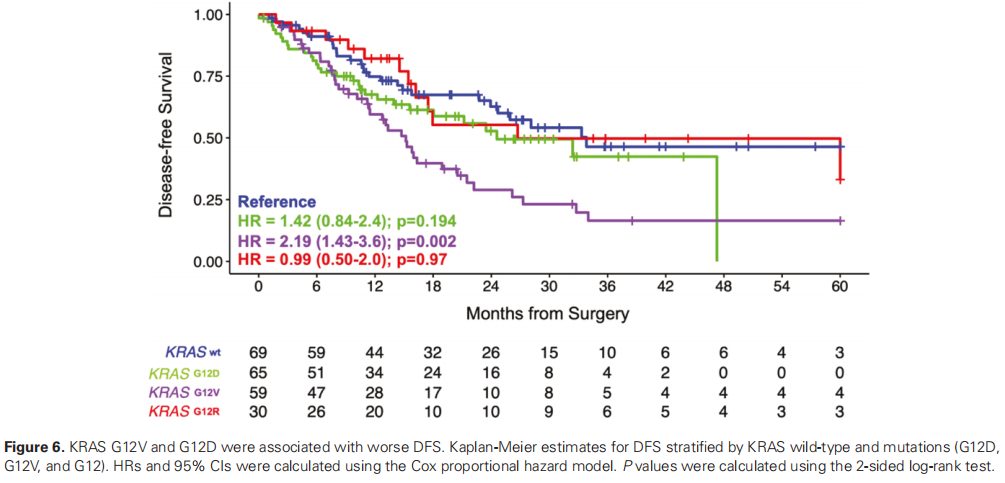
图6
讨 论
尽管PDAC患者的ctDNA检测率历来较低(归因于独特的肿瘤生物学、细针抽吸 (FNA) 技术导致的活检样本稀缺以及细胞外基质含量高导致整体肿瘤含量低),但灵敏且特异的定量方法可能使表征更加准确。通过单个KRAS点突变或常见突变基因的标准panels检测的ctDNA在检测MRD方面表现出有限的敏感性和特异性。因此,在本研究中,研究者证明在MRD窗口内和监测期间肿瘤知情ctDNA阳性既可行,又可高度预测PDAC的不良结果。这表明肿瘤知情ctDNA可能比单个KRAS基因DNA和肿瘤不可知基因panels更具有特异性,从而允许在围手术期采用以患者为中心的分层治疗方法以及早期发现复发。
Watanabe等人比较了肿瘤不可知和肿瘤知情ctDNA方法,证明在两所大学医院(n = 145)的可切除PDAC日本人群中,肿瘤知情方法的ctDNA检出率有所提高:未经治疗患者分别为39%(28/71) vs 56%(40/71),新辅助治疗患者分别为31%(23/74) vs 36%(27/74)。这一小队列研究还显示,可检测到的ctDNA与较短的DFS相关 (P = .0010)。在本多机构和种族数据集中,MRD窗口内的ctDNA阳性率为28.18%,监测窗口内的ctDNA阳性率为29.48%。在子分析中,接受NAC后进行手术的患者与接受前期手术的患者在MRD窗口内的ctDNA阳性检测率分别为21.1%和39.5%。更有趣的是,在该子分析中,基于ctDNA的连续MRD检测的预后价值显示,对于持续阳性或转为阳性的患者,复发率分别为92.9%和94.7%,这表明对所选择的化疗方案具有侵袭性疾病生物学难治性。研究者推测,临床试验使用新型药物或“转换疗法”(即mFOLFIRINOX至吉西他滨/nab-紫杉醇)可能最适合用于肿瘤知情的ctDNA持续阳性PDAC患者,因为他们要么患有活动性疾病,要么复发风险极高。相反,本分析还清楚地表明,对于无论前期手术还是NAC治疗的患者,清除ctDNA患者的DFS都有所改善。可以开展临床试验,评估这些ctDNA阴性患者使用有限疗程或减少化疗剂量的疗效。
此前,Hadano等人使用数字液滴PCR(ddPCR)仅评估了术后PDAC患者的KRAS点突变ctDNA。他们报告称,突变KRAS ctDNA阴性患者的中位OS为27.6个月,而突变KRAS ctDNA阳性患者的中位OS为13.6个月(P < .0001)。最近,Patel等利用一种不了解肿瘤情况的不可知论血液panel检测也表明,较高的ctDNA水平(%)与较差的OS相关(HR:4.35;95%CI,1.85-10.24,p = .001)。另一项利用基于肿瘤不可知NGS panel的研究报告称,术后ctDNA呈阳性的PDAC患者的DFS显著低于ctDNA呈阴性的患者(HR:5.20,P = .019)。
本研究数据代表了胰腺癌治疗领域中规模最大的真实世界个体化肿瘤知情ctDNA数据分析,并增强了ctDNA在术后MRD(HR:5.45,95%CI,2.94-10.1,P < .0001)和监测环境中(HR:12.38,95%CI,6.79-22.55,P < .0001)的预后价值。此外,每位患者的全外显子组测序将允许后续研究评估临床反应者的基因特征,并可能预测该队列中适当的治疗方案。
目前,CA 19-9是用于检测和监测PDAC的标准抗原生物标志物。然而,它的局限性包括敏感性低(假阳性率为47%,尤其是在存在胆道支架的情况下)和人群分泌不均匀(因为5%-10%的个体无法产生CA 19-9)。在本研究中,研究者发现CA 19-9升高以及其他标准临床病理特征与PDAC患者的DFS无关(P = .325)。此外,在多变量分析中,ctDNA阳性与患者生存结果的相关性比CA19-9或任何其他临床病理特征更强,这表明ctDNA可能是一种有前途的生物标志物,可用于检测胰腺癌MRD、评估治疗反应和早期识别疾病复发,并且比传统抗原生物标志物具有更高的敏感性和特异性。
本研究有几个局限性,包括患者和血浆时间点的异质性以及FNA的使用影响了获取足够的肿瘤组织。研究者还承认,鉴于这项调查的回顾性和实用性,可能存在固有的选择偏差。然而,这可能部分归因于本研究样本量较大。虽然研究者观察到了具有临床意义的前置时间(平均值:101天;范围:1-421天),但这项研究独特地展示了肿瘤知情ctDNA检测的临床效用,其中一些治疗医生可能根据ctDNA结果改变了他们的监测方案,阳性ctDNA结果触发了早期的影像学研究,从而人为地缩短了观察到的前置时间。值得注意的是,研究者确实观察到大多数(40%)的医生在手术后4至8周内为患者安排了第一次术后ctDNA检测,这与辅助治疗决策有关。由于ctDNA检测时机至关重要,可能会影响检测率,先前的研究表明,手术切除后至少等待2周是必要的,以降低手术引起的游离DNA水平升高,这可能会人为地降低ctDNA的检测率。
目前,有多项试验正在利用ctDNA进行治疗分层,并评估ctDNA动态是否可以作为实体瘤治疗效果的替代终点。例如,针对胰腺癌和胃癌患者的多中心ELYMIN18.2 CAR-T试验表明,肿瘤知情ctDNA与CLDN18.2 CAR-T细胞疗法的反应相关。在这项I期研究中,在任何时候都无法检测到ctDNA的患者中,OS更高(9.1个月 vs 3.7个月)。这些试验是将肿瘤知情ctDNA用于胰腺癌临床试验设计的“先行者”,并将验证阳性和阴性ctDNA对这些独特患者群体的预后结果。
本研究提供了最大的围手术期、经过临床验证的胰腺癌患者队列,他们具有纵向肿瘤知情、个体化ctDNA结果 ( n = 298)。总体而言,无论ctDNA阳性是在NAC还是手术后,MRD的ctDNA阳性均可预测DFS会显著缩短。此外,如果ctDNA在这些治疗干预后持续为阳性,则NAC或手术后的辅助化疗似乎不会降低DFS。鉴于该分析的探索性质,新辅助治疗或手术后肿瘤知情ctDNA为阴性且完成辅助治疗的胰腺癌患者的DFS减少这一意外趋势需要谨慎对待。未接受辅助治疗的患者可能有较好反应,而接受辅助治疗的患者则具有高风险病理特征。但是,评估完成NAC和手术(有无辅助治疗)胰腺癌患者的围手术期 SWOG 1505试验数据结果的机会将有助于确定该观察结果的有效性。超过治疗窗口期且在监测中肿瘤知情ctDNA阳性的患者DFS也较短,在多变量分析中,ctDNA是该队列中唯一显著的预后变量,而不是CA 19-9。动态上,在监测过程中从阴性转为阳性的患者的DFS明显差于转为或持续为ctDNA阴性的患者,从而为介入临床试验提供了另一个潜在的“高风险”或“治疗失败”患者队列。在本研究队列中,共有111名患者出现影像学复发,其中27名出现局部复发。所有27名患者均有可用的ctDNA时间点,其中74.07%(20/27)在术后局部复发之前的任何时间均呈ctDNA 阳性。这强调了肿瘤知情ctDNA能够在影像可能不清晰时检测腹膜内的局部复发。
将肿瘤知情ctDNA应用到临床实践中,需要现场协议来获得具有足够高细胞密度的诊断组织体积,以便立即进行NGS。此步骤将立即对患者进行表征,并帮助对治疗和预后组进行分层。根据本研究数据,完成围手术期化疗方案且ctDNA持续阳性的胰腺癌患者的复发率超过90%。这些患者可以被视为复发的“极高风险”,但更恰当地说应该称为“治疗难治性”且患有活动性疾病。这些患者可以通过肿瘤知情ctDNA在影像学进展之前被识别出来,并立即进行新的治疗试验,或者切换化疗主干以评估其结果是否可以改善。由于这些患者在MRD窗口内仍有疾病,因此非常适合评估抗肿瘤治疗的其他机制(如疫苗或细胞疗法),以确定ctDNA可否转化为阴性。然而,对于没有影像学疾病证据的ctDNA阳性患者,应该谨慎地在监测窗口内立即开始全身化疗。可能存在一个复发性PDAC寡转移亚群,这些患者可以单独接受放射治疗而不是全身治疗,或者只有肺部转移,这预示着更好的结果。监测中持续阳性的胰腺癌患者可以通过参加毒性较小的介入试验来延缓肿瘤的生长和扩散。鉴于目前有限的化疗和手术技术,胰腺癌患者在所有实体肿瘤中复发的风险始终最高,而肿瘤知情ctDNA可以为未来的临床试验分层,以确定适当的治疗方法。
参考文献:
Botta GP, Abdelrahim M, Drengler RL, et al. Association of personalized and tumor-informed ctDNA with patient survival outcomes in pancreatic adenocarcinoma. Oncologist. Published online July 17, 2024. doi:10.1093/oncolo/oyae155
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#胰腺导管腺癌# #KRAS# #分子残留疾病#
0