科伦博泰ADC药物SKB264三阴性乳腺癌新适应症拟纳入优先审评!
2023-11-05 MedSci原创 MedSci原创 发表于威斯康星
科伦博泰宣布SKB264对比研究者选择方案用于治疗既往经二线及以上标准治疗的不可手术切除的局部晚期、复发或转移性三阴性乳腺癌患者的随机、对照、开放性、多中心III期临床试验达到了由独立评审委员(IRC
根据2023年11月1日国家药品监督管理局(NMPA)药品审评中心(CDE)官网的信息,科伦药业控股子公司科伦博泰已递交注射用SKB264的优先审评请求。这一药物拟用于治疗不可手术切除的局部晚期或转移性三阴性乳腺癌(TNBC)成人患者,这些患者曾接受至少两种系统治疗,其中至少一种针对晚期或转移性阶段。
需要注意的是,SKB264此前已获得国家药品审评中心(CDE)颁发的3项突破性疗法认定(BTD),分别用于治疗局部晚期或转移性三阴性乳腺癌(TNBC)、EGFR-TKI治疗失败的局部晚期或转移性EGFR突变非小细胞肺癌(NSCLC)以及既往接受至少二线系统化疗的局部晚期或转移性HR+/HER2-的乳腺癌患者。
注射用SKB264是一种抗体偶联药物(ADC),靶向人滋养层细胞表面抗原2(TROP-2),这种抗体偶联药物具有自主知识产权,用于治疗恶性实体瘤。非临床研究数据表明,在TROP-2阳性的乳腺癌、胃癌、肺癌和结直肠癌动物模型中,SKB264表现出显著的抗肿瘤活性,并且具有较好的安全性和耐受性。早期临床研究结果显示,在转移性实体瘤患者中,SKB264表现出良好的耐受性、安全性以及令人鼓舞的抗肿瘤活性。
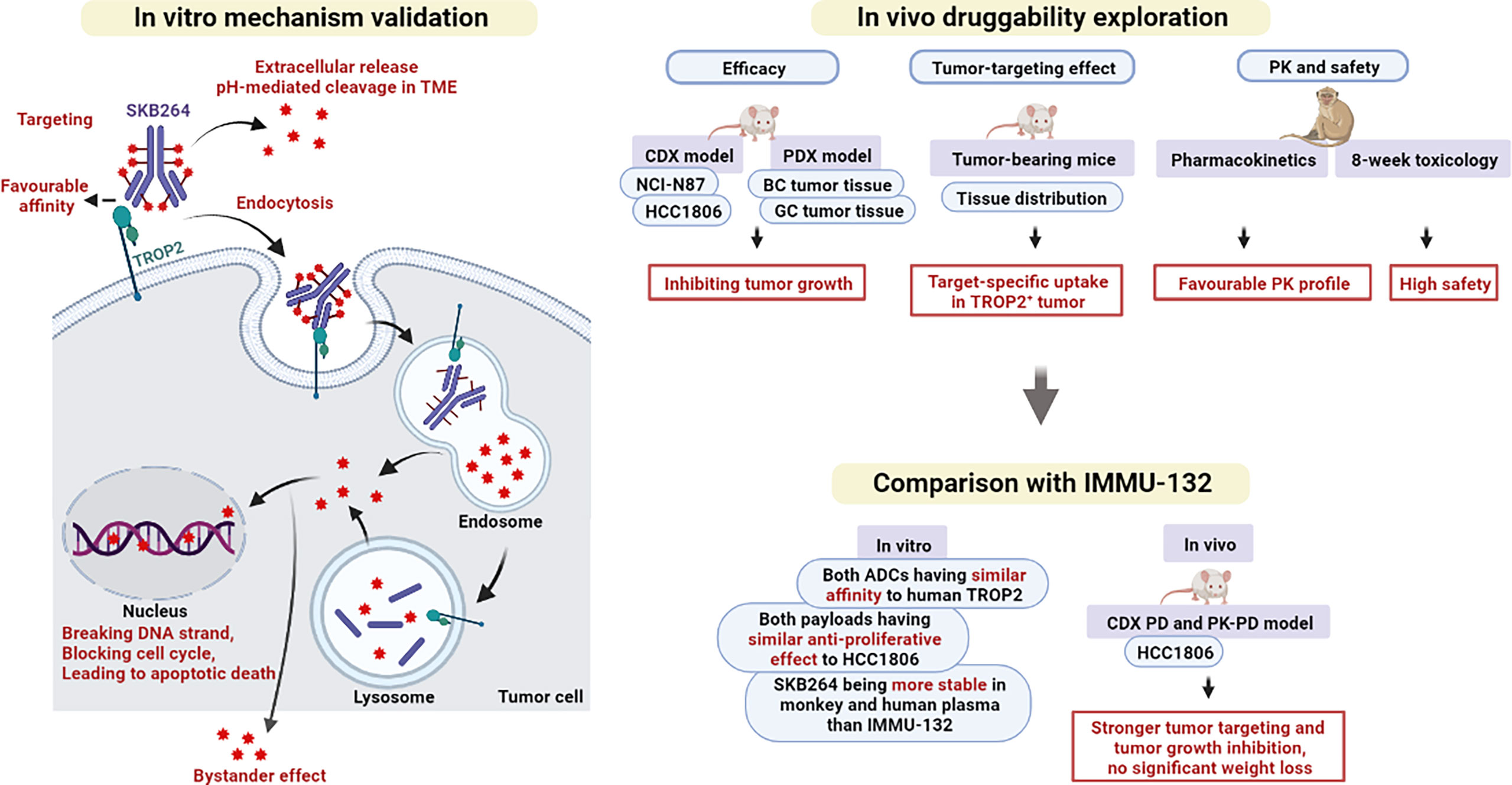
2023年8月14日,科伦博泰宣布SKB264对比研究者选择方案用于治疗既往经二线及以上标准治疗的不可手术切除的局部晚期、复发或转移性三阴性乳腺癌患者的随机、对照、开放性、多中心III期临床试验达到了由独立评审委员(IRC)评估的主要研究终点:无进展生存期(PFS)。在预先设定的期中分析中,与对照标准化疗组相比,SKB264的无进展生存期具有统计学意义上的显著改善。
此前,SKB264治疗转移性实体瘤患者的早期临床研究结果已发表在2021年CSCO学术年会上。研究结果表明,SKB264具有良好的耐受性、安全性和令人鼓舞的抗肿瘤活性,在三阴性乳腺癌和卵巢癌中的疗效数据尤为亮眼。
截至2021年4月28日,该试验共入组18例既往经历多线治疗失败的、局部晚期或转移性实体瘤患者。55.6%的患者既往接受过≥4个治疗方案。三阴性乳腺癌患者6例(33.3%)、卵巢癌患者5例(27.8%)、胰腺癌患者3例(16.7%)、尿路上皮癌患者2例(11.1%)、HER2阳性乳腺癌患者和胃腺癌患者各1例。
在17例接受了至少一次疗效评估的患者中,总体的客观缓解率(ORR)为41.2%,疾病控制率(DCR)为70.6%。
在三阴性乳腺癌患者中,ORR为40%,2例达到部分缓解(PR);在卵巢癌患者中,ORR为60%,3例PR;1例HER2+乳腺癌患者获得PR(1/1);1例胃腺癌患者获得PR(1/1);另有1例胰腺癌患者在接受SKB264治疗后疾病稳定(SD),疾病控制时间达30.3周。
这次SKB264的拟纳入优先审评可能有望加速该药物在上述适应症中的研发和上市进程,为晚期三阴性乳腺癌患者提供新的治疗选择
此次SKB264的拟纳入优先审评,可能代表着有望加速SKB264在该适应症上的研发和上市,通过提供优质治疗选择,为晚期三阴性乳腺癌患者带来获益。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#科伦博泰##ADC药物##SKB264##三阴性乳腺癌#新适应症拟纳入优先审评!
115