Circ Res 南开大学廖旭东、陈佺/天津市第一中心医院卢成志教授团队揭示FUNDC1在调控肺动脉高压中的新机制
2024-12-13 论道心血管 论道心血管 发表于陕西省
该研究首次揭示了FUNDC1在调控肺动脉高压发生发展中的新机制。
肺动脉高压(Pulmonary Hypertension, PH)是一种由多种因素引发的疾病,其主要病理特征为肺动脉血管的进行性重构,导致肺循环阻力增加,肺动脉压力升高,最终可能引发右心衰竭和死亡。尽管PH的发病机制尚未完全明了,现有研究表明,血管内皮细胞功能障碍在PH的肺血管重塑中起着至关重要的作用。然而,内皮细胞线粒体如何调控其功能,进而影响肺血管重塑的具体机制,仍然不甚清楚。
2024年12月10日,南开大学生命科学学院廖旭东教授和陈佺教授团队,联合天津市第一中心医院心内科卢成志主任团队,在肺动脉高压研究领域取得了重要进展。相关研究成果发表于国际权威期刊Circulation Research,该论文题为“Endothelial FUNDC1 Deficiency Drives Pulmonary Hypertension”,首次揭示了FUNDC1在调控肺动脉高压发生发展中的新机制。

FUNDC1 (FUN14 domain containing 1)蛋白定位于线粒体外膜,在线粒体自噬过程中发挥重要作用,且参与调节线粒体的动态平衡、数量变化以及与其他细胞器的相互作用。在本研究中发现,临床PH患者及PH动物模型的肺组织中,FUNDC1的表达水平显著降低。
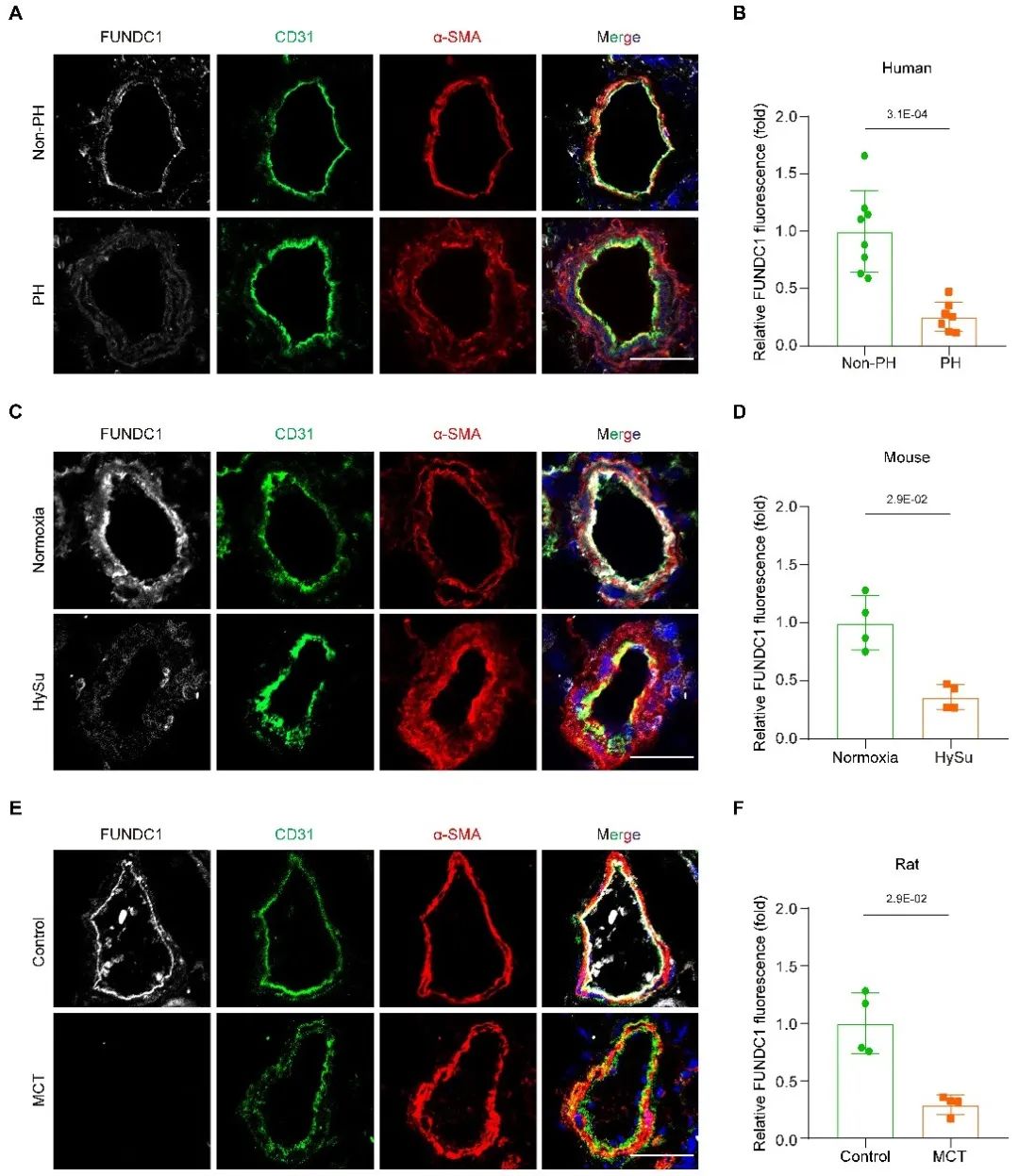
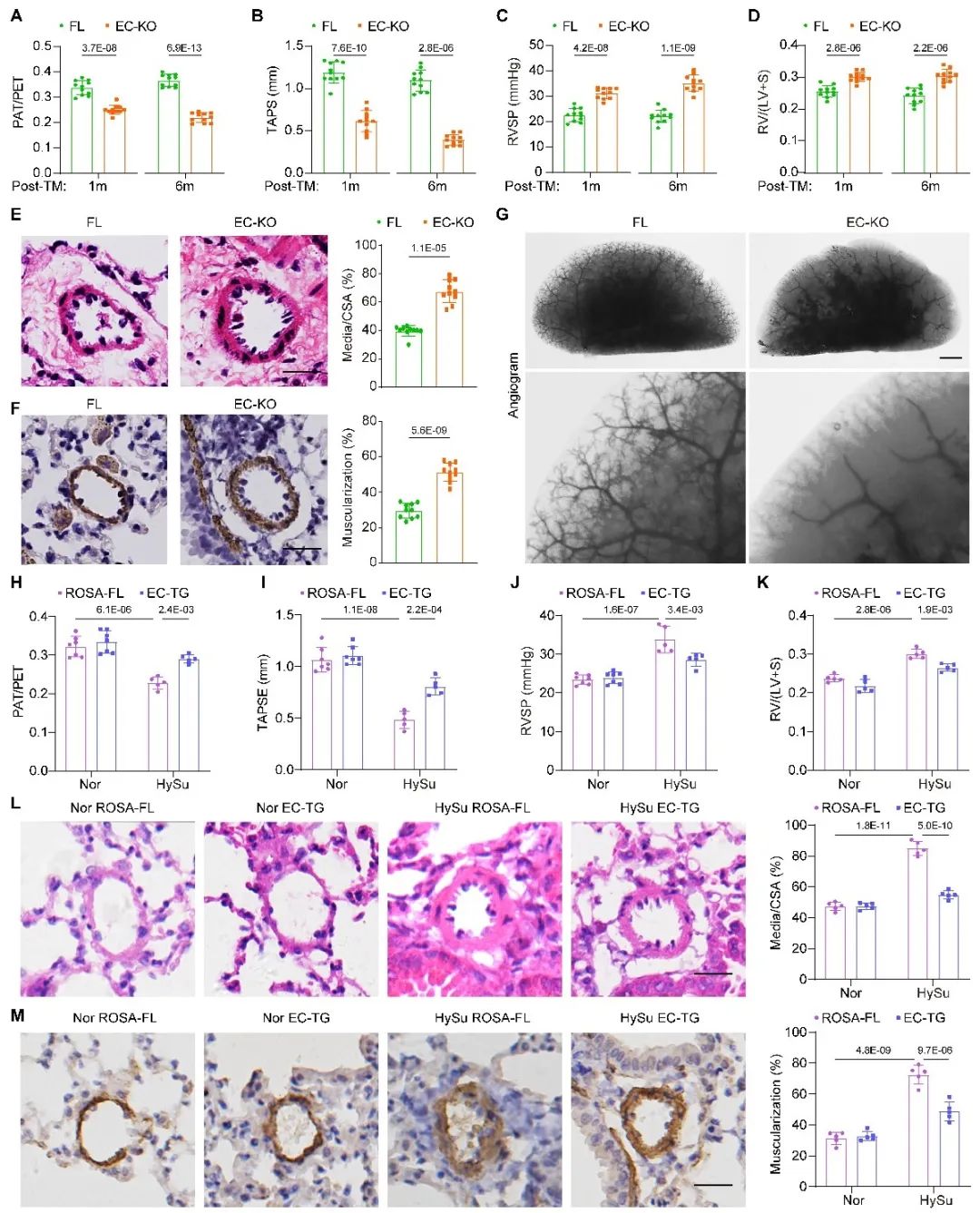
在小鼠PH模型中,FUNDC1的全身敲除促进了PH的发生,而其过表达则能够抑制PH进展。通过构建细胞特异性FUNDC1敲除小鼠模型发现,仅内皮特异性敲除FUNDC1,而非平滑肌特异性敲除,能显著促进PH的进展。此外,在PH小鼠中恢复内皮细胞FUNDC1的表达,则能显著保护小鼠免受PH的损害。进一步的研究表明,成年小鼠诱导性敲除内皮细胞FUNDC1可引发自发性PH,这一结果表明,内皮细胞中FUNDC1的缺失是PH发生的直接病理因素。研究团队新构建的内皮特异性FUNDC1诱导性敲除小鼠,作为自发性肺动脉高压模型,克服了传统PH模型的缺陷(如弱PH表型和需要缺氧诱导等),为深入探讨PH的病理机制和评估治疗策略提供了新的重要工具。
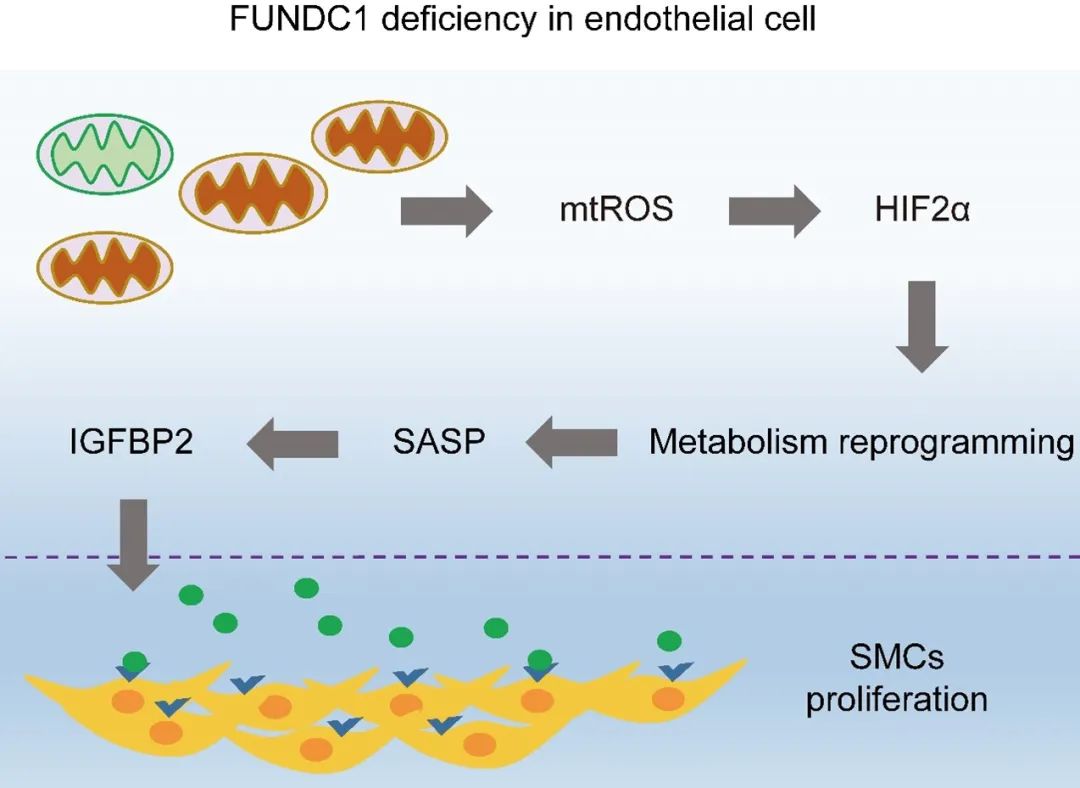
本研究利用小鼠、大鼠肺动脉高压模型及原代细胞培养等多种手段,揭示了FUNDC1缺失通过抑制内皮细胞的线粒体自噬,导致内皮细胞中线粒体ROS的积累,进而引发内皮细胞的缺氧和衰老。此外,FUNDC1缺失还促进了内皮细胞向有氧糖酵解的代谢重编程,这一过程通过mtROS-HIF2α信号通路介导。同时,内皮细胞FUNDC1缺失还促进了IGFBP2 (insulin like growth factor binding protein)的分泌,进而通过旁分泌效应驱动肺动脉平滑肌细胞增殖,促进肺血管重塑。
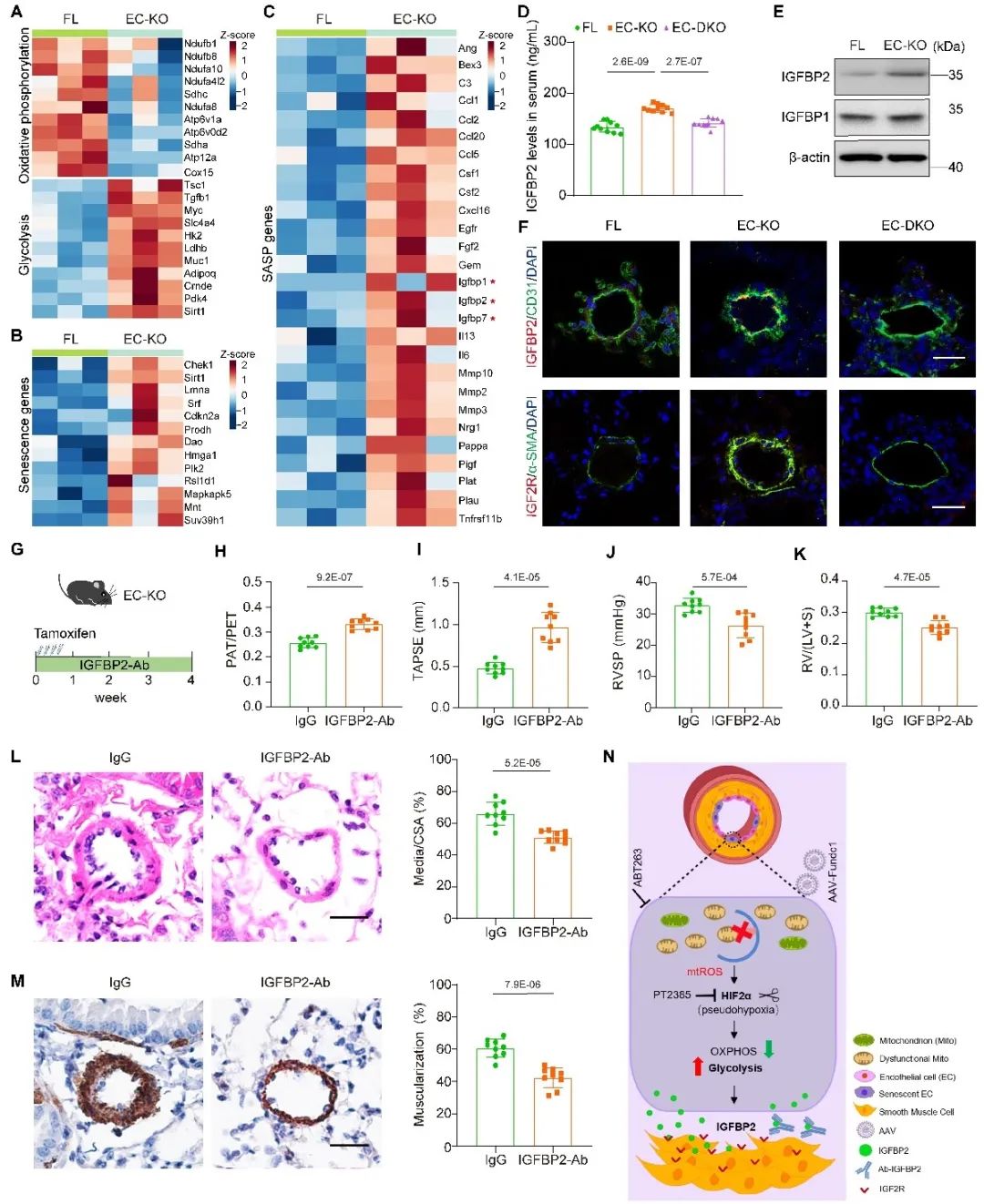
综上所述,FUNDC1介导的线粒体自噬对于维持内皮细胞稳态至关重要,内皮细胞线粒体功能障碍被证明是引发PH的独立致病因素。此外,通过靶向内皮细胞线粒体功能障碍及其影响的下游靶点,研究团队设计了一系列预防及治疗PH的实验,这些干预手段在小鼠PH模型中都展现了显著疗效。此研究不仅验证了FUNDC1介导的线粒体自噬在PH分子机制中的重要作用,也为PH的治疗提供了新的策略,具有重要的临床意义。
南开大学生命科学学院已毕业博士生裴燕冬、在读博士生任东峰为该论文的共同第一作者;南开大学生命科学学院廖旭东教授、陈佺教授及天津市第一中心医院心内科卢成志主任为论文的共同通讯作者。
原文链接:
https://www.ahajournals.org/doi/10.1161/CIRCRESAHA.124.325156
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#肺动脉高压# #Fundc1#
12