单发纯磨玻璃结节为表现的肺转移癌一例
2024-03-19 中国胸心血管外科临床杂志 中国胸心血管外科临床杂志 发表于威斯康星
随着健康体检意识的增强和低剂量螺旋CT应用的增多,磨玻璃结节(ground-glass opacity,GGO)的检出率逐年增高[1],尤其是纯GGO极少表现为转移瘤。肺是乳腺癌常见的转移部位,可表现
随着健康体检意识的增强和低剂量螺旋CT应用的增多,磨玻璃结节(ground-glass opacity,GGO)的检出率逐年增高[1],尤其是纯GGO极少表现为转移瘤。肺是乳腺癌常见的转移部位,可表现为单发或多发结节、淋巴管炎或弥漫性间质增厚[2]。然而,GGO是一种罕见的肺转移形态,可能被误诊为早期肺腺癌、间质性肺炎或病毒感染等,如果我们不能区分原发或转移性病变,就无法制定准确的治疗策略。GGO是一种非特异性的影像学表现,见于许多涉及不同临床疾病的病理过程。GGO在影像上可表现为肺泡腔变实改变,也可表现为肺间质改变、肺泡壁内细胞数量增加、液体增多等。除了早期肺腺癌或不典型腺瘤样增生外,GGO可能是肺部病毒感染(如COVID-19)、肺水肿伴间质积液、斑片状肺实质水肿或间质性疾病的表现[3],但很少表现为转移癌。实体恶性肿瘤的肺转移类型通常为多发结节或肿块、淋巴管炎或弥漫性间质增厚[2],而表现为单发GGO较为少见。本文报道1例乳腺癌肺转移表现为单发GGO患者。
临床资料 患者,女,32岁,2018年10月发现右侧乳腺包块,乳腺CT示右侧乳房外上象限见 21 mm×20 mm肿块,周围呈不规则状、毛刺样改变(图1a),行B超引导下肿瘤及腋窝淋巴结穿刺,穿刺病理示乳腺浸润性导管癌(图2a~b),免疫组化结果(图2c~d):雌激素受体(ER,>80%强+),孕激素受体(PR,20%弱-中等+),人表皮生长因子受体2(CerbB2,2+),拓扑异构酶Ⅱ(Top-2,2+),细胞角蛋白5(CK5,–),E-钙粘蛋白(E-Cadherin,+),Ki-67(>20%),P120(胞膜+),P63(–),雌激素调节蛋白(pS2,–);Fish检测HER-2为阴性。腋窝淋巴结可见腺癌细胞转移。全身检查(头、胸、腹CT,骨扫描)未见远处转移,给予2个周期多西他赛+表柔比星+环磷酰胺新辅助化疗1个月后,行保留乳头乳晕右侧乳腺腺体切除术+腋窝淋巴结采样+乳腺假体植入术。术后继续给予多西他赛+表柔比星+环磷酰胺方案术后辅助化疗4个周期,2019年7月采用亮丙瑞林+阿那曲唑内分泌治疗并每3个月复查。2021年7月胸部CT未见肺部异常病灶(图1b),而5个月后胸部CT发现右肺下叶后基底段纯GGO,大小20 mm×22 mm×20 mm(图1c),纵隔淋巴结未见明显增大,术前考虑早期肺腺癌可能性大,头颅磁共振成像、腹部CT及全身骨显像未见转移,B超检查腋窝及颈部未见增大淋巴结。2022年1月行胸腔镜肺段切除术,术中病理检查回报乳腺癌肺转移,遂行纵隔淋巴结采样术。术后病理为肺浸润性导管癌侵犯,切缘未见癌残留,脉管腔内见瘤栓(图3a~b),免疫组化染色(图3c~d):细胞角蛋白7(CK7,–),细胞角蛋白20(CK20,–),绒毛蛋白(Villin,–),转录因子GATA3(+),乳腺珠蛋白(Mammaglobin,–),甲状腺转录因子-1(TTF-1,–),P40(–),突触素(Syn,–),Ki-67(30%+),2、4、7、8、9、10、12组淋巴结见癌转移;患者术后1个月给予白蛋白紫杉醇300 mg+卡培他滨1.5 g维持化疗中,2022年7月复查胸部CT(图1d),RECIST评分为病情稳定。
 图1 乳腺 CT
图1 乳腺 CT
a:乳腺外上象限可见大小约 21 mm×20 mm 低密度肿块影(红色箭头);b:乳腺癌术后 25 个月复查胸部 CT 未见异常;c:乳腺癌术后31个月的胸部 CT 可见右肺下叶纯磨玻璃结节影(白色箭头);d:胸腔镜肺段切除术后复查
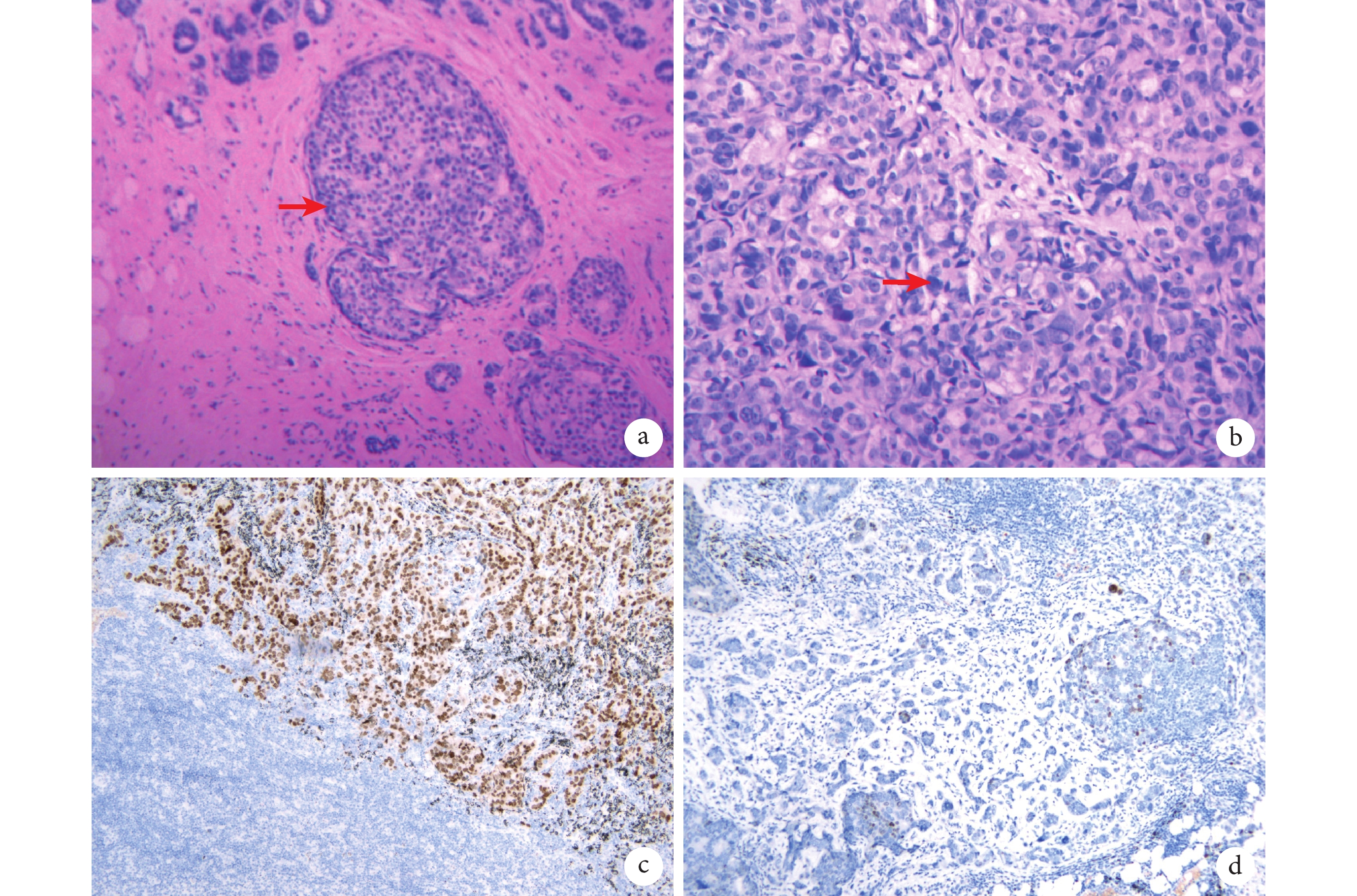 图2 术前穿刺病理和免疫组化结果
图2 术前穿刺病理和免疫组化结果
a:癌细胞充满乳腺导管(红色箭头,HE 染色,×100);b:核大深染癌细胞的聚集(红色箭头,HE 染色,×200);c:雌激素受体免疫组化结果;d:细胞角蛋白免疫组化结果;HE:苏木素-伊红
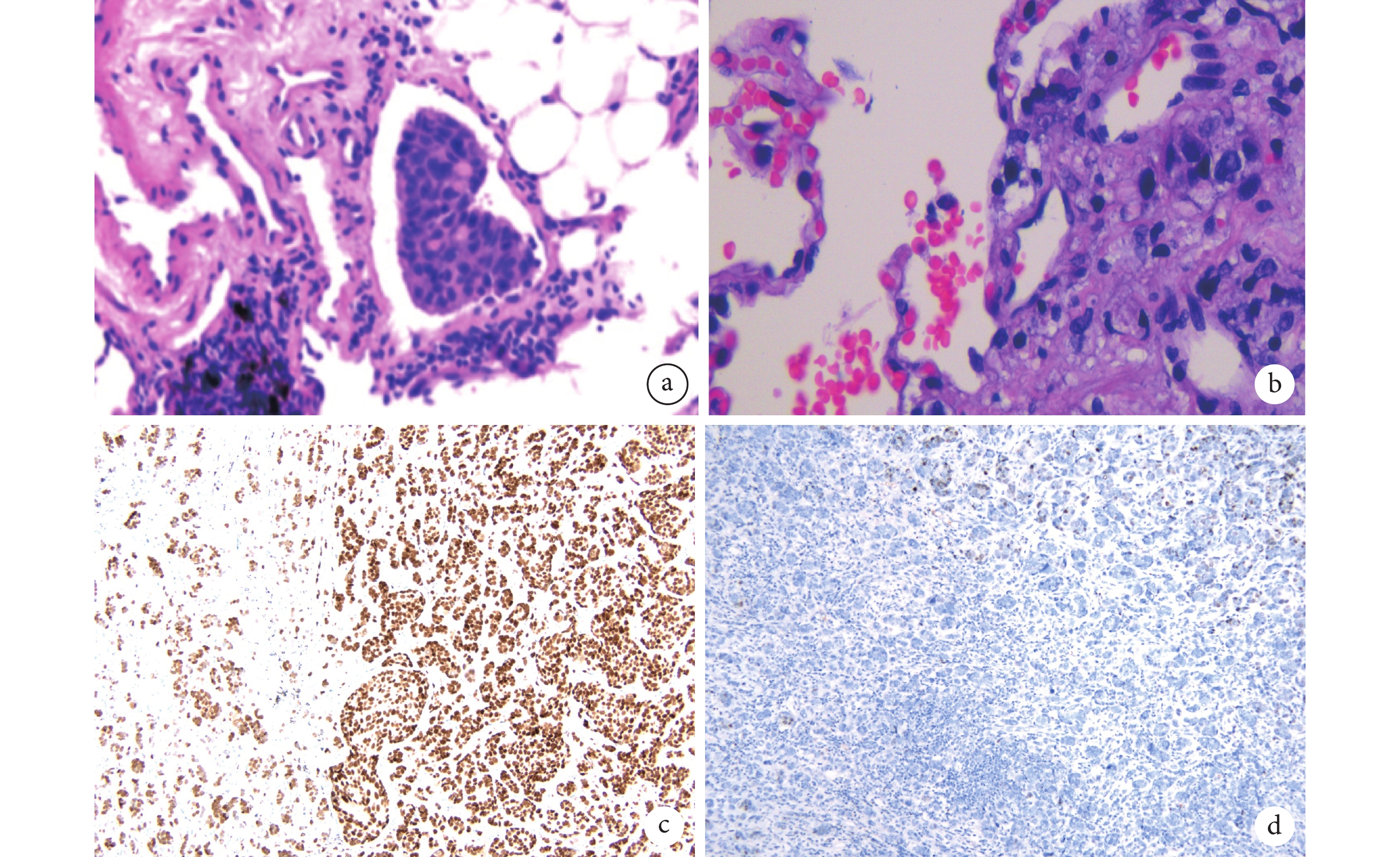 图3 术中病理检查和免疫组化结果
图3 术中病理检查和免疫组化结果
a:癌细胞贴壁样生长于肺泡空间,肺泡腔内可见癌巢(HE 染色,×200);b:可见异型细胞、核分裂象(HE 染色,×400);c:转录因子GATA3免疫组化结果;d:细胞角蛋白7免疫组化结果;HE:苏木素-伊红
讨论 截至目前,我们在中国知网、万方、维普数据库尚未检索到肺部转移瘤在CT上表现为单发纯GGO的中文文献报道。2001年有学者[4]报道1例胰腺癌肺转移CT表现为磨玻璃形态;日本Okita等[5]报道1例鼻腔内黑色素瘤肺部转移性GGO,黑色素瘤细胞沿增厚的肺泡壁呈鳞状增生,类似细支气管肺泡癌。这2项报道中,肺部病变均为多发GGO而非单发,伴有实性成分而非纯GGO。韩国学者[6]2013年报道1例乳腺癌新辅助化疗期间胸部CT显示双肺胸膜下斑片状磨玻璃样渗出影,伴有发烧症状,胸腔镜肺活检表明为乳腺癌肺转移,与本篇报道的纯GGO影像学表现不同。2020年日本学者[7]报道1例乳腺恶性叶状肿瘤术后31个月发现肺部典型GGO,随访后结节增大,手术切除后病理为乳腺恶性叶状肿瘤肺转移,其形态与本篇报道较为相似。
在肺腺癌中,GGO是非侵袭性或惰性病变,具有良好的预后[8]。初次发现的GGO根据不同的大小、实性成分占比,其随访时间不同,必要时,应开展包括放射肿瘤学、外科和介入的多学科评估[9-11],且GGO患者术前不推荐头颅磁共振成像[12]、腹部CT[13]以及骨扫描检查[14]。与此相反的是,肺转移瘤患者需要尽快治疗,在多种实体恶性肿瘤中,无论有没有纵隔淋巴结转移,手术切除可增加单发的肺转移瘤患者的生存获益[15-18]。并且,对于既往有恶性肿瘤病史的GGO患者,如果不能确定为肺原发病变的情况下,头颅增强磁共振成像、骨扫描或者 PET/CT是有必要的。在本例中,乳腺癌术后随诊检查中发现单发纯GGO,术前考虑为非典型腺瘤样增生或原位腺癌,行胸腔镜下联合肺段切除+纵隔淋巴结采样,术中病理检查提示为乳腺癌肺转移,幸运的是该患者术前进行了全身检查,未发现其他病灶,但意外的是,肺门淋巴结和纵隔淋巴结阳性,这在术前CT检查中未能发现。
原发性GGO与转移性结节的手术原则不同[19]。原发性GGO的主要手术方式是肺段切除术或联合肺段切除术+纵隔淋巴结采样,此术式可以保留更多的肺功能,其总生存率与肺叶切除术的生存率差异无统计学意义[20]。而对于肺单发转移瘤而言,手术的基本原则是尽可能完整切除转移灶、尽量多地保留肺组织,以提高患者生存率以及改善生存质量。对于外周转移灶,楔形切除是足够的,对于深部的转移灶无法行楔形切除术的可行解剖性切除,肺段切除是选择之一[17, 21]。但纵隔淋巴结采样或清扫是否可提高总生存率存在争议,尚无定论[21]。
随着抗肿瘤药物的研发和治疗手段的多样化,肿瘤患者的生存时间不断延长,在肿瘤的治疗过程中出现肺转移瘤的机会必将增多,在GGO检出率增高的背景下,以GGO为表现形式的转移癌值得警惕。在有恶性肿瘤病史的患者中,发现单发纯GGO应考虑转移瘤的可能性,应缩短随访时间。如果随访中结节进行性增大,应鼓励患者完善全身检查后尽早手术,根据术中冰冻病理检查结果决定淋巴结切除方式。
本文报道一个非常罕见的肺转移性肿瘤的CT表现,即纯GGO。存在恶性肿瘤病史的患者治疗后出现GGO,应考虑肺转移性瘤的可能性,应缩短随访时间。对于单发、手术可切除远处转移瘤应尽早手术切除,术前全身检查以排除其他器官转移,根据术中冰冻病理检查结果决定淋巴结切除方式。在肿瘤治疗中,多学科团队对罕见病例制定合理的治疗策略具有一定的帮助。
原始出处:
敬涛, 宋铁牛, 魏小平, 冯海明, 张少博, 王成, 蒋鹏, 李斌. 单发纯磨玻璃结节为表现的肺转移癌一例. 中国胸心血管外科临床杂志, 2024, 31(3): 485-488. doi: 10.7507/1007-4848.202207003
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#磨玻璃结节# #肺部磨玻璃结节# #肺转移癌#
64