OS超五年不是梦!免疫治疗成为早期NSCLC治疗新标准
2023-02-02 找药宝典 找药宝典 发表于上海
相比于晚期肺癌的内科姑息治疗,可手术的早期肺癌患者是目前肺癌中最有希望长期治愈的人群,因此提高这部分人群的无病生存时间,是非常重要的临床方向。
相比于晚期肺癌的内科姑息治疗,可手术的早期肺癌患者是目前肺癌中最有希望长期治愈的人群,因此提高这部分人群的无病生存时间,是非常重要的临床方向。而免疫治疗,在拿下晚期肺癌后,已经不断向早期布局。随着人们对免疫治疗不断的探索,免疫治疗在早期肿瘤中也展现出很好的应用前景。今年一月上半月,纳武利尤单抗(欧狄沃,O药)刚刚获得中国国家药品监督管理局(NMPA)批准新增适应症,联合含铂双药化疗(每三周一个疗程,持续三个疗程),用于可切除的(肿瘤≥4 cm或淋巴结阳性)非小细胞肺癌(NSCLC)成人患者的新辅助治疗,近日FDA又批准帕博利珠单抗(K药)新适应症,用于手术切除及铂类化疗后的Ⅰb、Ⅱ或Ⅲa期非小细胞肺癌的辅助治疗。今天,我们就来聊一聊早期NSCLC的免疫治疗。
1. 阿替利珠单抗
2021 年 10 月 16 日,FDA 批准了 atezolizumab (阿替利珠单抗,T药) 用作切除术和铂类化疗后的辅助治疗以及由 Ventana Medical Systems, Inc. 开发的 VENTANA PD-L1 (SP263) 检测设备,用作辅助诊断设备用作切除术和铂类化疗后的辅助治疗,用于 II 至 IIIA 期非小细胞肺癌患者。这是第一个也是唯一一个可用于 NSCLC 辅助治疗的癌症免疫疗药物,是肿瘤药物发展史的重要里程碑!

该申请批准是根据IMpower010(NCT02486718) Ⅲ 期试验数据,共有 1280 名患者纳入了该实验并接受了顺铂+培美曲塞/吉西他滨/多西他赛/长春瑞滨治疗1至4个周期,然后其中1005名患者以1:1的比例随机接受每21天1200mg的T药或BSC。
该试验的主要终点是研究者评估的 DFS,该 DFS 进行了分层测试:
(1)II 至 IIIA 期疾病且 PD-L1 表达为 1% 或更高的患者;
(2)II 至 IIIA 期疾病的所有随机患者;
(3)意图IB 至 IIIA 期疾病的治疗 (ITT) 人群。
次要终点包括:ITT 人群的总生存期 (OS)、PD-L1 表达≥50% 的 II 至 IIIA 期疾病患者的 DFS,以及所有 3 个人群的 3 年和 5 年 DFS .
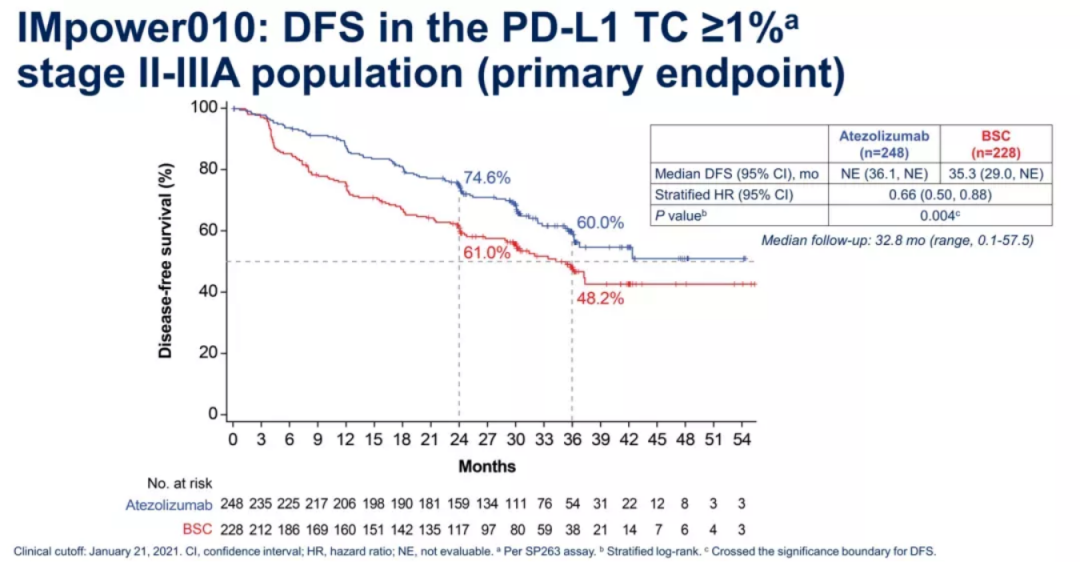
根据在2021年ASCO年会上更新的最新数据显示,中位随访时间为32.2个月(范围,0.57-5),在PD-L1 TC≥1%的Ⅱ~ⅢA期患者中,虽然T药组尚未达到中位无病生存期(DFS),但是T药相比对照组有显示的DFS获益,对照组中位DFS为35.3个月(HR=0.66,95%CI: 0.50~0.88,P=0.004),36个月DFS率60.0% vs 48.2%。
研究组和对照组中所有随机化任何PD-L1表达的II和IIIA期人群的中位无病生存期(DFS)为42.3个月(95% CI,36.0–NE)和35.3个月(95% CI,30.4-46.4 HR,0.79;95% CI,0.64-0.96;P =0.02);
在 ITT 人群中,研究组 (n = 507) 和对照组 (n = 498) 的中位 DFS 分别不可评估 (95% CI, 36.1–NE) 和 37.2 个月 (95% CI, 31.6–NE) (HR,0.81;95% CI,0.67-0.99;P =0.04)。

从实验中的II-IIIA期NSCLC患者数据结果来看,与最佳支持治疗(BSC)相比,T药的加入与复发或死亡风险的小幅度降低相关,中位随访32.2个月后的HR为0.79 (P=0.02);在ITT人群分析中,T药降低复发或死亡风险的幅度具有临界意义,中位随访32.2个月后的风险比为0.81(P=0.04)。
更有中期分析的早期 OS 数据显示,在 II 至 IIIA 期疾病和 PD-L1 表达为 1% 或更高的患者亚组中,HR 为 0.77(95% CI,0.51-1.17),在 II 期至 IIIA 期疾病的所有随机人群中0.99(95% CI) , 0.72-1.33) ,在 ITT 人群中为 1.07 (95% CI, 0.80-1.42)。
接受T药治疗的患者最常报告的不良反应包括天冬氨酸转氨酶、血肌酐和丙氨酸转氨酶升高。其他毒性包括高钾血症、皮疹、咳嗽、甲状腺功能减退、发热、疲劳/虚弱、肌肉骨骼疼痛、周围神经病变、关节痛和瘙痒。
NCCN 非小细胞肺癌指南在2021V7版中,阿替利珠单抗被推荐用于 IIB 至 IIIA期NSCLC患者(肿瘤细胞表达PD-L1≥ 1%)手术和铂基化疗后辅助治疗。这是免疫治疗首次被推荐首个获批用于早期NSCLC治疗。

2.纳武利尤单抗
2022年3月4日,美国FDA批准Oppo(nivolumab,O药)联合化疗,作为新辅助疗法,治疗可切除(肿瘤≥4cm或淋巴结阳性)非小细胞肺癌患者,不论患者PD-L1表达情况。
全球获批不到一年,首个肺癌术前免疫疗法来到中国,该适应症获批是基于CheckMate-816研究。
CheckMate-159研究已证实,纳武利尤单抗单药和在纳武利尤单抗基础上联合含铂化疗,用于早期患者新辅助治疗的疗效。2020年10月,III期临床研究CheckMate-816达到病理完全缓解(pCR)的主要研究终点,该研究结果于2021年4月在美国癌症研究协会 (AACR) 年会上公布,证实O药联合化疗作为新辅助治疗能够为非小细胞肺癌患者带来获益。该研究是首个也是目前唯一证实免疫检查点抑制剂联合化疗能够为非小细胞肺癌患者带来获益的III期临床研究。
CheckMate-816是一项随机、开放标签、多中心III期临床研究,旨在评估与单用化疗相比,纳武利尤单抗联合化疗用于可切除非小细胞肺癌患者新辅助治疗的疗效。研究纳入358例 Ib至IIIa期的可切除NSCLC患者,术前随机接受O药(360 mg)联合基于组织学分型的含铂双药化疗(每3周一次,最多3个周期),或者单用含铂双药化疗(每3周一次,最多3个周期)。主要研究终点是pCR率(pCR即经盲态独立病理审核后手术切除标本中未发现癌细胞)和无事件生存期(EFS),关键次要终点包括总生存期(OS)、主要病理缓解(MPR,MPR即手术切除标本中的肿瘤细胞比例降低到≤10%),以及至死亡或远处转移的时间。

结果显示,意向治疗人群(ITT人群)中术前接受纳武利尤单抗和化疗组的pCR率分别是24% VS 2.2%(比值比 [OR] 13.94,99%置信区间[CI]:3.49-55.75; p<0.0001),pCR率翻了十倍不止,以压倒性的优势达到主要研究终点。
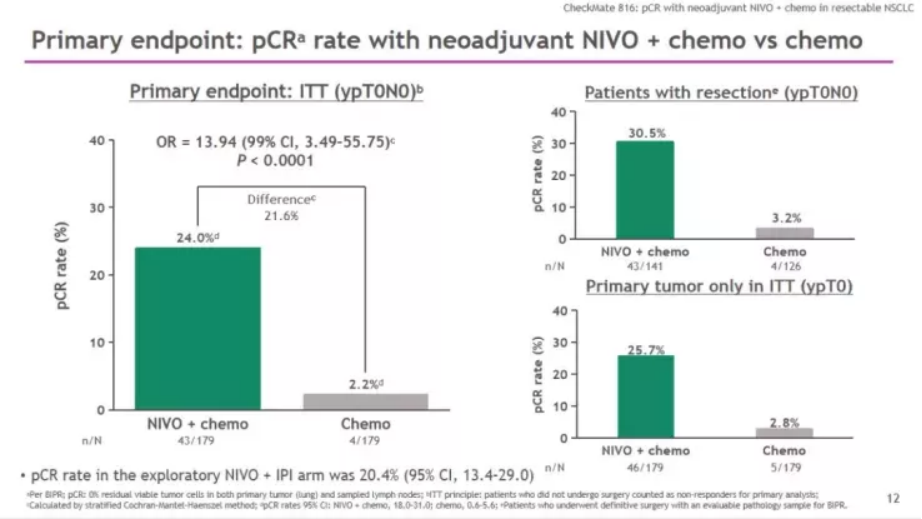
关键次要研究终点MPR翻四倍!(36.9% vs 8.9%; 比值比[OR] 5.70, 99%置信区间[CI]: 3.16-10.26),安全性特征与过往研究一致,未发现新的治疗相关不良事件类型。
10倍的pCR率、4倍的MPR率,让CheckMate-816成为业内关注的焦点,在关注化免联合新辅助治疗是否能够为患者带来获益的同时,化免联合新辅助治疗是否会对患者后续的手术治疗造成影响同样是业界关注的焦点。
CheckMate-816研究手术治疗结局数据显示,化免联合新辅助不影响手术治疗、不影响手术治疗方式及程度、病理缓解深度更强、安全性可控是早期NSCLC免疫治疗史上里程碑。新辅助治疗获得成熟的长期生存数据往往需要数十年,但从目前10倍于化疗的pCR率上看,最终OS数据也是值得期待的,有望改变未来的临床实践,为更多早期NSCLC患者带来更好的生存获益!
3.帕博利珠单抗
2023年1月26日,FDA发布公告,批准PD-1抑制剂派姆单抗(Pembrolizumab,Keytruda)的新适应症,用于手术切除及铂类化疗后的Ⅰb、Ⅱ或Ⅲa期非小细胞肺癌的辅助治疗。
该批准基于Ⅲ期PEARLS/KEYNOTE-091试验(NCT02504372)的结果,与安慰剂对照组相比,派姆单抗辅助治疗可以显著延长手术完全切除的非小细胞肺癌患者的无病生存期。
KEYNOTE-091 招募了 IB、II 至 IIIA 期的实现R0完全切除的 NSCLC 患者1177例,以 1:1 的比例随机接受静脉注射pembrolizumab,剂量为每 3 周 200 mg,持续 1 年,或每 3 周静脉注射安慰剂,持续 1 年。
双重主要终点是总体患者群体和 PD-L1肿瘤比例评分 (TPS) ≥ 50% 患者的 DFS。关键的次要终点包括 OS 等。
中期分析的其他结果表明,与安慰剂相比K药PD-L1 TPS ≥ 50% 患者的DFS,然而并未达到预先指定统计学意义。

研究人员将继续随访,并比较总生存期 (OS) 差异,作为次要终点。
本研究中 KEYTRUDA 的安全性与先前报道的研究中观察到的一致。结果将在即将召开的医学会议上公布,并将提交给监管机构。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












