Acta Pharmacol Sin 北京大学郭宇轩课题组发布心脏Z线邻近蛋白组及其在新靶点发现中的应用
2024-08-24 论道心血管 论道心血管 发表于上海
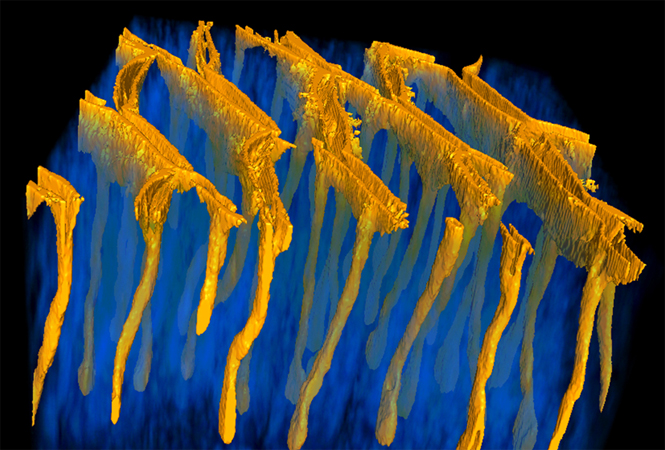
该研究克服了心肌细胞Z线在体外培养中发生紊乱、难以真实反映体内成熟心肌Z线的困难,建立了基于腺相关病毒(AAV)和生物素连接酶BioID2的体内邻近蛋白质组学技术。
Z线(Z-disc)是肌原纤维中肌小节之间的富含多种蛋白质的横纹状结构[1,2]。Z线在心脏中参与多种病理生理过程,包括调节肌小节的组装、收缩与舒张[3],作为结构脚手架调控其他关键亚细胞结构,如横小管和肌浆网形成的连接膜复合物(JMC, Junctional Membrane Complex)[4]。同时,Z线是调节心肌细胞信号转导的核心细胞骨架结构[5,6]。虽然已有研究报道了部分Z线蛋白调控心脏病理生理过程的功能,但是由于缺乏Z线的蛋白组学研究,科学家对Z线仍然缺乏较全面、系统性的认知。
2024年7月23日,北京大学基础医学院、北京大学心血管研究所、血管稳态与重构全国重点实验室郭宇轩课题组在Acta Pharmacologica Sinica杂志上发表题为“In vivo proximity proteomics uncovers palmdelphin (PALMD) as a Z-disc-associated mitigator of isoproterenol-induced cardiac injury”的论文[7]。该研究克服了心肌细胞Z线在体外培养中发生紊乱、难以真实反映体内成熟心肌Z线的困难,建立了基于腺相关病毒(AAV)和生物素连接酶BioID2[8]的体内邻近蛋白质组学技术。该研究发现了新的Z线蛋白—PALMD。在异丙肾上腺素(ISO)诱导的应激性心脏损伤下,PALMD对心肌结构和功能有保护作用。在机制层面上,PALMD蛋白通过稳定NEXN蛋白,进而稳定了JMC结构,最终影响了心脏的损伤与重构。

1. 建立AAV-ACTN2-BioID2体内邻近标记技术,发现PALMD是新的Z线蛋白
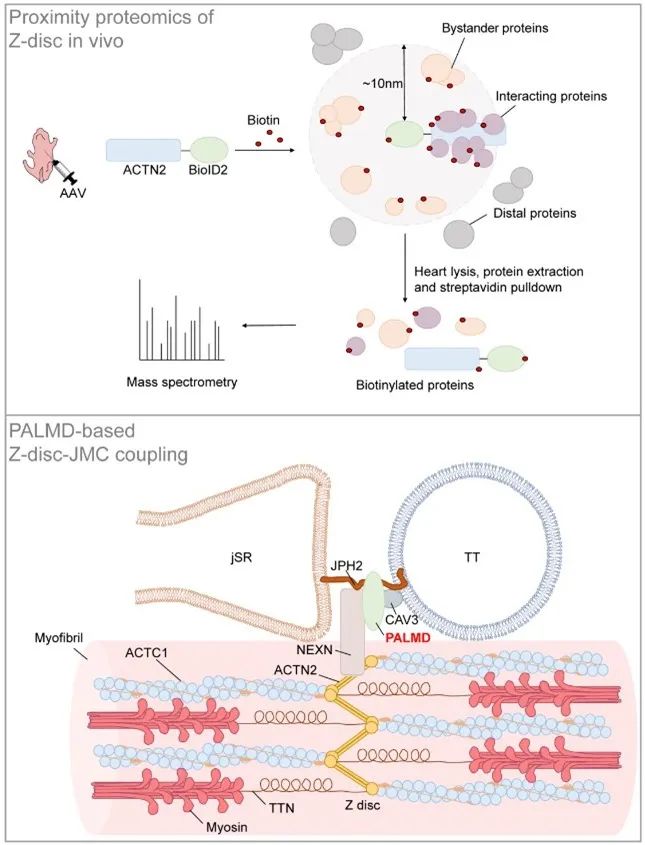
邻近标记技术是近几年发展的可在活细胞或组织中原位标记邻近蛋白质的新技术。在生物素连接酶BioID2作用下,目的蛋白10nm范围内的其他蛋白质将被生物素化,生物素化的蛋白可以被链霉亲和素选择性分离出来,后续进行质谱鉴定,分析目标蛋白的邻近蛋白质组[9]。利用这一技术,作者以辅肌动蛋白ACTN2 (α-Actinin-2)为Z线标记物,构建了由心肌特异性启动子cTNT驱动的BioID2质粒,并通过AAV载体,递送到新生小鼠体内。在小鼠P11-P14给予外源生物素后,BioID2可将Z线邻近蛋白质生物素化,接着收集P14小鼠的心脏裂解液并通过链霉亲和素磁珠富集生物素化蛋白,可实现小鼠体内心肌细胞特异的Z线邻近蛋白质组研究。通过质谱分析,作者鉴定出237个富集在Z线附近的备选蛋白。GO分析显示,被富集的蛋白主要为Z线蛋白质,且大量已知Z线蛋白被富集,这说明体系的成功建立。
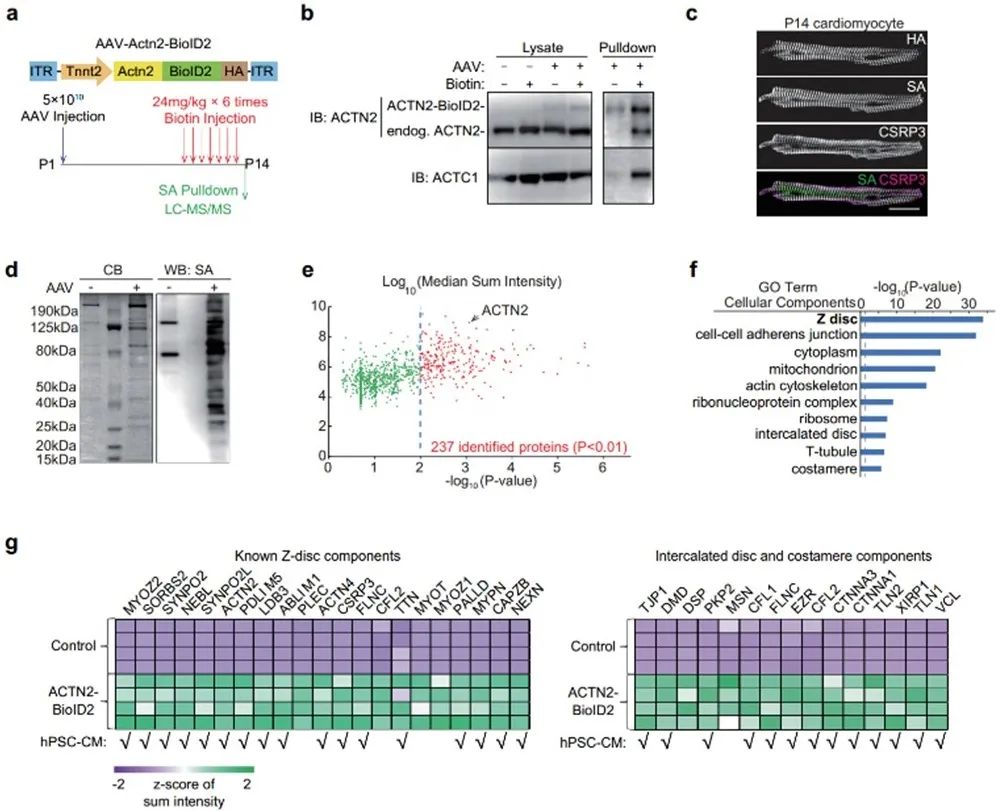
接下来,作者对质谱发现的蛋白质进一步筛选,期望发现新的Z线蛋白。筛选标准为:第一,在过往研究中未报道过的定位在Z线的蛋白;第二,分子量小于AAV最大包装限度,方便后续研究。作者筛选出7个候选蛋白,进行AAV包装后在心肌细胞中进行了原位验证。其中,PALMD蛋白与Z线的共定位情况最好。
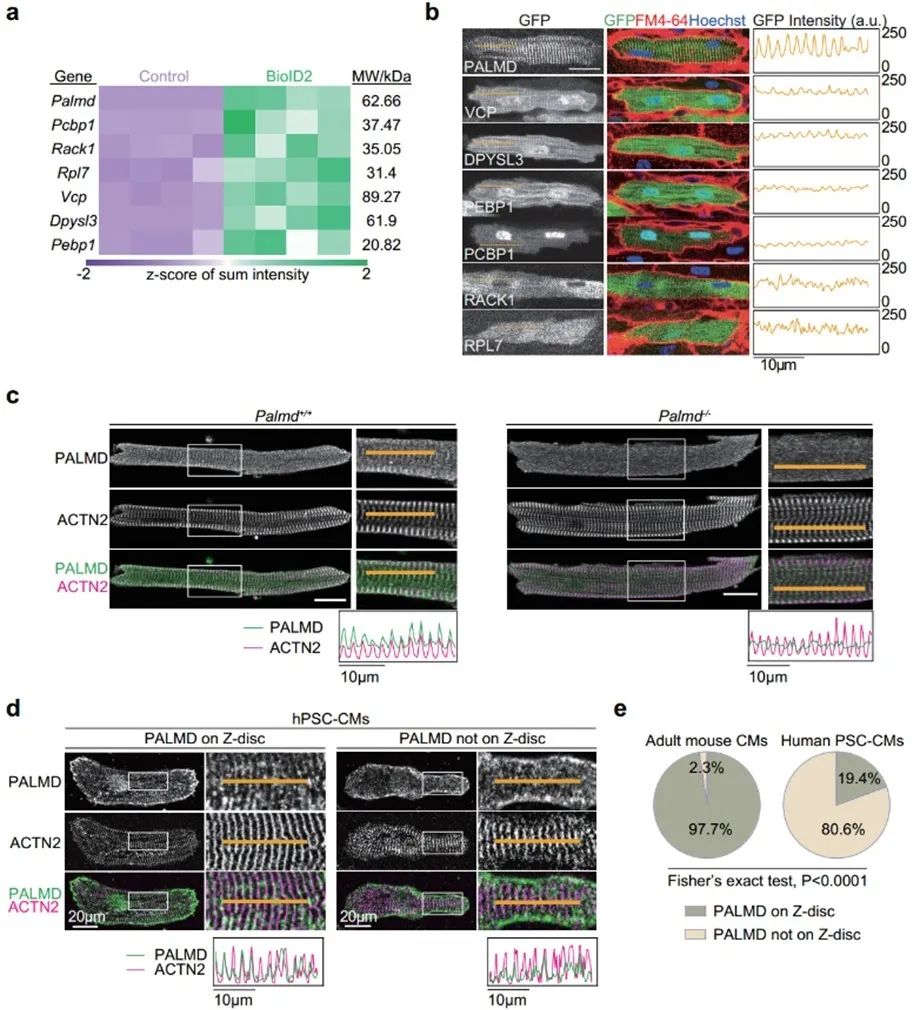
2. PALMD参与心肌对异丙肾上腺素的病理响应
Palmd属于Paralemmin蛋白家族,在过往的心血管研究中被报道在心脏中有表达,但以往研究聚焦于Palmd在血管内皮细胞与瓣膜间质细胞中的功能[10,11],没有研究其在心肌细胞中的功能。为了研究Palmd的功能,作者团队制作了Palmd全身敲除的小鼠模型,并在蛋白水平验证了敲除的完全性。但是,Palmd全身敲除小鼠在基线水平的心脏收缩功能正常。
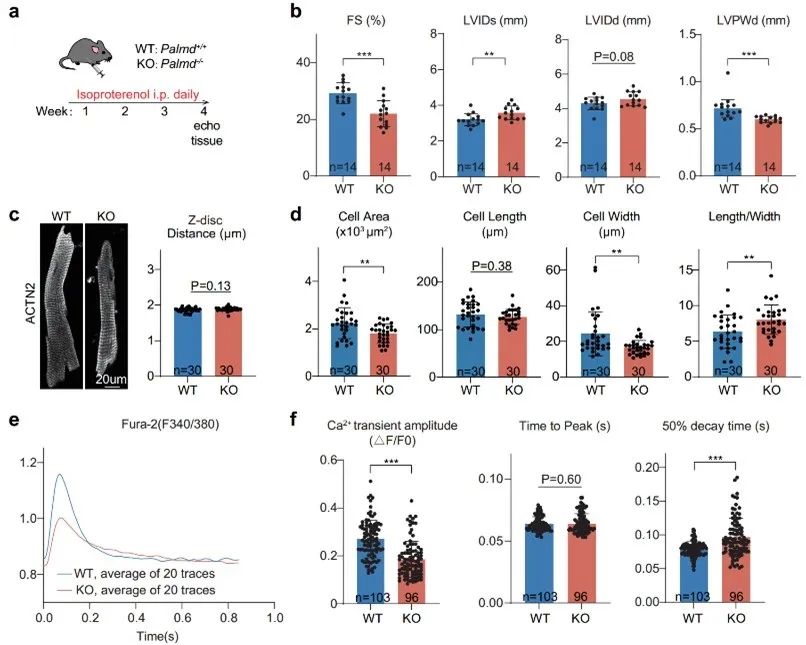
由于很多蛋白虽然不调节心脏在基线水平的功能,但是会在应激作用下发挥功能,因此作者使用异丙肾上腺素ISO,来模拟应激诱导的心脏损伤,探究Palmd在疾病发展中的潜在作用。通过心功能监测,作者发现ISO慢性处理4周后,Palmd敲除小鼠射血分数显著低于对照组,左室内径显著增大,室壁厚度显著低于对照组,提示其心脏收缩功能受损。进一步地,作者分离了单个心肌细胞,从心肌细胞的维度上探究Palmd敲除带来的变化。作者发现Palmd敲除小鼠在ISO处理后细胞面积缩小,细胞宽度变窄,长宽比增加,这些数据说明Palmd敲除的心肌细胞在ISO处理后不能正常地发生病理性肥厚。同时,Palmd敲除小鼠钙瞬变的峰值下降,提示其兴奋收缩偶联受损。综上,作者得出结论,Palmd敲除小鼠在慢性ISO处理下产生更严重的心脏结构功能异常。
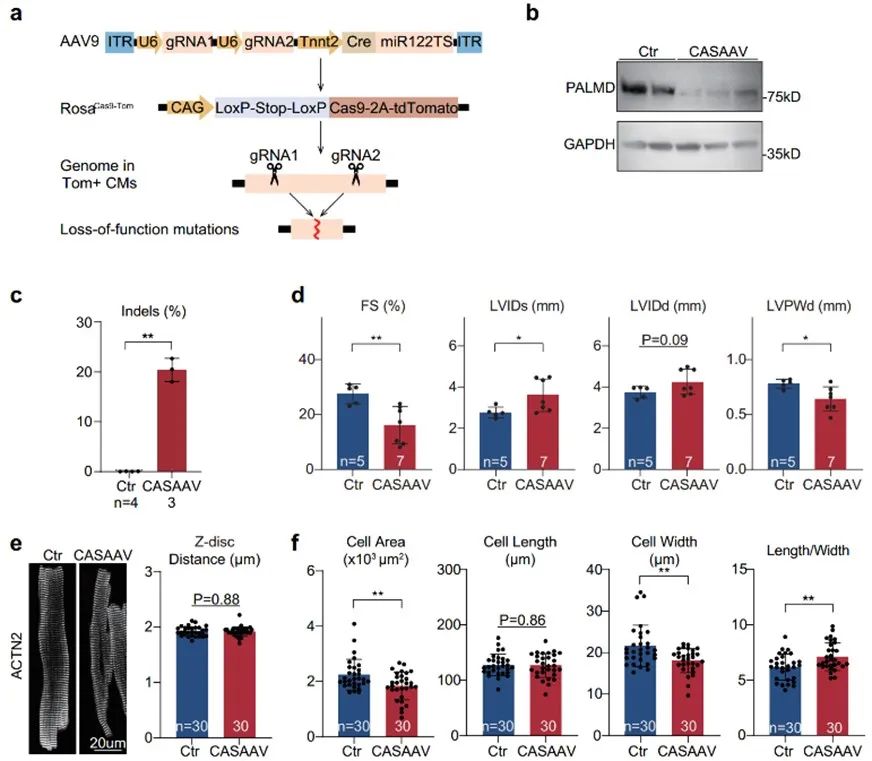
由于Palmd已知在心脏的多种细胞类型中表达, Palmd全身敲除模型也许并不能反应Palmd在心肌细胞中的功能。因此,作者利用了CASAAV (CRISPR/Cas9/AAV9-based somatic mutagenesis)技术[12],通过在RosaCas9-Tomato小鼠中注射包装有心脏特异性表达的重组酶Cre及靶向Palmd基因gRNA的AAV载体,实现了心脏特异性的Palmd基因敲除。与Palmd全身敲除结果相一致,在4周的ISO慢性处理后,Palmd心肌细胞特异性敲除小鼠射血分数显著降低,左室内径增大,室壁厚度显著低于对照组,说明其心脏收缩功能受损更严重。心肌细胞形态上,Palmd心肌细胞特异性敲除小鼠在ISO处理后,同样表现为细胞面积缩小,细胞宽度变窄,长宽比增加,提示心肌肥厚异常。
既然Palmd的全身或心肌细胞特异性敲除均会导致ISO诱导的心脏损伤加重,那相应的,PALMD过表达是否可以挽救ISO诱导的心脏损伤呢?因此,作者探究了Palmd在心肌细胞中特异性过表达对ISO诱导的心脏损伤的保护作用。通过AAV载体在野生型小鼠心肌细胞中对Palmd基因进行过表达,并在小鼠成年后给予ISO长期处理。与预期结果一致,ISO处理下,Palmd过表达组小鼠的射血分数显著恢复,左室内径相比于对照组缩小,室壁厚度相比对照组增加。同时,心肌细胞大小、长宽比均得到显著恢复。以上结果表明,Palmd的过表达可以减轻ISO诱导的心脏损伤。
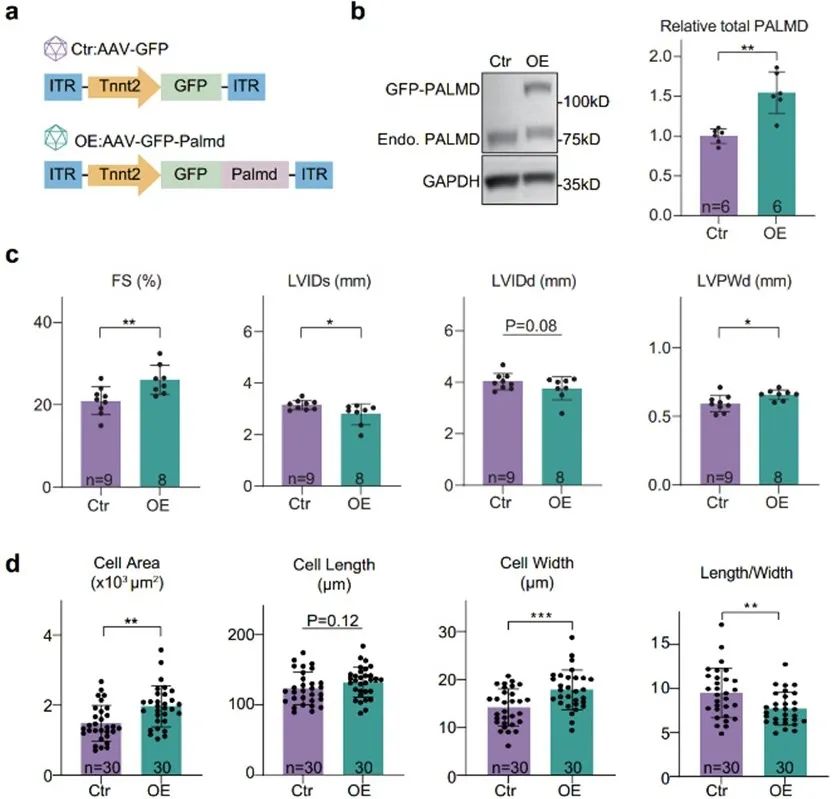
3. PALMD通过稳定NEXN蛋白维持Z线与JMC的耦连和功能
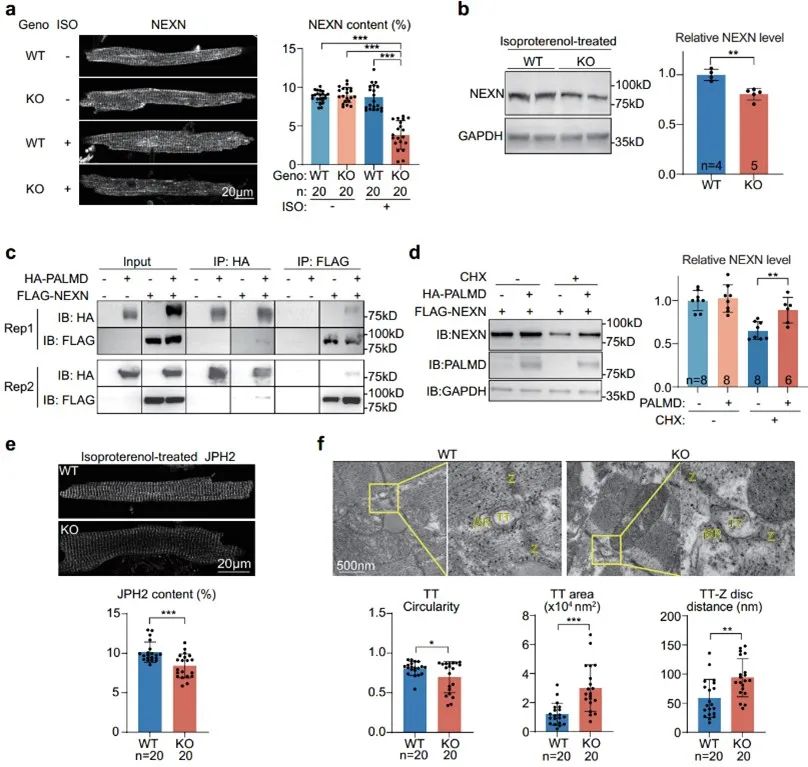
进一步探究机制,作者团队检索了一系列与心脏收缩功能障碍有关的Z线蛋白,发现NEXN蛋白在ISO处理的Palmd敲除小鼠中蛋白表达量下降,且Z线定位紊乱。通过COIP实验,作者证实了PALMD与NEXN蛋白存在相互作用。通过蛋白降解实验作者证实了PALMD可以增加NEXN蛋白的稳定性。由于NEXN被报道有调控JMC以及调控横管发生与形成的作用[13],因此作者对JMC这一超微结构进行了电镜观察,发现Palmd敲除鼠中,由于NEXN含量下降,影响了JMC的正常结构,表现为横管圆度下降、面积增大,到Z线的距离增大。因此,PALMD是通过增加NEXN稳定性,进而维持了正常的JMC结构。
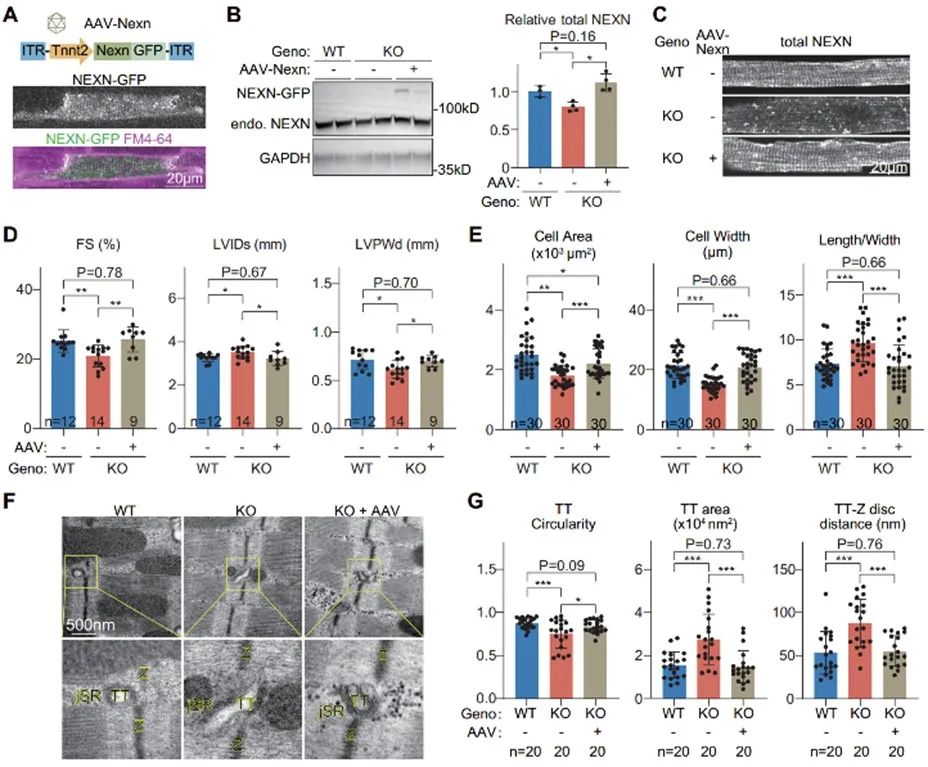
最后,作者在Palmd全身敲除小鼠中通过AAV在心肌细胞中特异性的回补了NEXN,单个心肌细胞的免疫荧光实验显示,NEXN回补后其Z线结构恢复规律排列。给予同样的ISO慢性处理四个月后,回补了NEXN的Palmd敲除小鼠的心脏损伤情况恢复,表现为射血分数显著恢复,左室内径相比于Palmd敲除组缩小,室壁厚度相比敲除组增加。心肌细胞面积、宽度及长宽比均得到显著恢复。透射电镜实验显示,超微结构JMC中,横管圆度回升、横管面积及到Z线的距离恢复到接近正常水平。以上结果表明,NEXN的回补可以减轻ISO诱导的Palmd敲除小鼠的心脏损伤。
综上所述,作者团队建立了基于AAV-ACTN2-BioID2载体的心脏Z线邻近蛋白质组学技术,并发现PALMD是Z线的新成分,在ISO处理下,对心脏的损伤与重构有保护作用。其内在机制是由于PALMD稳定NEXN蛋白,从而稳定JMC的正常结构,最终影响心脏的损伤与重构。
北京大学基础医学院博士生郭聪婷是本研究的第一作者。北京大学郭宇轩研究员和波士顿儿童医院William Pu教授是本研究的通讯作者。本工作获得了北京大学董尔丹研究员和李开龙教授、北京大学第三医院肖晗教授和赵明明副研究员、南方科技大学曹阳坡研究员、南方医科大学刘灿昭教授、阜外医院兰峰教授和刘旭杰教授的大力支持与合作。本研究获得国家自然科学基金、国家重点研发计划和北京市科技新星计划的资助。
参考文献
[1] Sanger JM, Sanger JW. The dynamic Z bands of striated muscle cells. Sci Signal 2008; 1: pe37.
[2] Lange S, Ehler E, Gautel M. From A to Z and back? Multicompartment proteins in the sarcomere. Trends Cell Biol. 2006;16:11–8.
[3] Crocini C, Gotthardt M. Cardiac sarcomere mechanics in health and disease. Biophys Rev 2021; 13: 637-52.
[4] Hong T, Shaw RM. Cardiac T-Tubule Microanatomy and Function. Physiol Rev 2017; 97: 227-52.
[5] Frank D, Frey N. Cardiac Z-disc Signaling Network. J Biol Chem. 2011;286:9897–904.
[6] Guo YX, Cao YP, Jardin BD, Sethi I, Ma Q, Moghadaszadeh B, et al. Sarcomeres regulate murine cardiomyocyte maturation through MRTF-SRF signaling. Proc. Natl Acad Sci USA 2021; 118: No. 2 e2008861118
[7] Guo C, Jardin BD, Lin J, Ambroise RL, Wang Z, Yang L, et al. In vivo proximity proteomics uncovers palmdelphin (PALMD) as a Z-line-associated mitigator of isoproterenol-induced cardiac injury. Acta Pharmacol Sin. 2024 Jul 23
[8] Feng W, Liu CZ, Spinozzi S, Wang L, Evans SM, Chen J. Identifying the cardiac dyad proteome in vivo by a BioID2 knock-in strategy. Circulation. 2020;141:940–2.
[9] Varnaitė R, MacNeill SA. Meet the neighbors: Mapping local protein interactomes by proximity-dependent labeling with BioID. Proteomics 2016; 16: 2503-18.
[10] Sáinz-Jaspeado M, Smith RO, Plunde O, Pawelzik SC, Jin Y, Nordling S, et al. Palmdelphin regulates nuclear resilience to mechanical stress in the endothelium. Circulation. 2021;144:1629–45.
[11] Wang S, Yu H, Gao J, Chen J, He P, Zhong H, et al. PALMD regulates aortic valve calcification via altered glycolysis and NF-κB-mediated inflammation. J Biol Chem 2022; 298: 101887.
[12] Guo YX, VanDusen NJ, Zhang LN, Gu WL, Sethi I, Guatimosim S, et al. Analysis of cardiac myocyte maturation using CASAAV, a platform for rapid dissection of cardiac myocyte gene function in vivo. Circ Res. 2017;120:1874-+.
[13] Liu CZ, Spinozzi S, Chen ZY, Fang X, Feng W, Perkins G, et al. Nexilin is a new component of junctional membrane complexes required for cardiac T-tubule formation. Circulation. 2019;140:55–66.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#心脏损伤# #异丙肾上腺素# #心脏Z线#
46