European Respiratory Journal:肺动脉高压的多组学方法与传统“遗传研究”的整合
2024-09-26 刘少飞 MedSci原创 发表于上海
在PAH方面,精准医学的进展仅限于阐明预后和少数PAH基因相关的临床特征。要使这种精准医学方法成功,需要各种遗传驱动因素的内型。

肺动脉高压(PAH)的分类历史上主要基于临床特征,目前尚不清楚是否存在其他相关的分类和聚类方式,这些方式可能基于其他组学维度。多组学整合结合了不同“组学”技术的数据,以揭示复杂的分子交互作用。这种方法提供了多样生物维度的全面视图,从而对疾病机制有更完整和细致的理解。多组学整合主要有三种方法:后分析数据整合、综合数据分析和系统建模技术。前两种方法作为发现工具或假设生成器,提供了高层次的机制性见解。相反,系统建模技术主要用于解释或假设验证,旨在数学上描述潜在的机制。
整合多层组学数据,包括基因组学、转录组学、蛋白质组学和代谢组学,对于揭示PAH的复杂机制至关重要。数量性状位点(QTL)绘图在此过程中发挥了重要作用。表达QTL将遗传变异与基因表达水平联系起来;蛋白质QTL将遗传变异与蛋白质丰度联系起来;代谢物QTL将遗传变异与代谢物浓度联系起来。这些QTL分析有助于理解遗传变异如何影响中间表型并对疾病病理产生影响。通过在疾病背景下(如PAH)过度表现的QTL,有助于识别遗传风险变异介导疾病易感性的潜在生物机制。例如,围绕循环蛋白的全基因组关联研究(GWAS)揭示了血小板源性生长因子-β受体(PDGFRβ)的顺式作用蛋白QTL,这一受体是PAH中的已知药物靶点(存在安全性问题)。临床试验可以利用蛋白质QTL来识别可能从特定治疗(如靶向PDGFRβ的伊马替尼)中受益的患者。最近,Walters等人利用多组学整合展示了SOX17基因上游增强子区域中的常见遗传变异如何影响PAH。
QTL数据与孟德尔随机化(MR)研究的结合可以推断遗传变异与表型特征之间的因果关系。MR使用遗传变异作为工具变量来区分因果关系与相关性,从而为潜在的治疗靶点提供强有力的证据。在PAH的背景下,MR研究表明铁缺乏(与PAH高度相关)与疾病无因果关系,将焦点缩小到更相关的生物途径。Toshner等人利用MR研究了白介素(IL)-6在PAH中的因果作用,发现与托珠单抗(IL-6受体拮抗剂)的治疗效果无显著关系,且IL6R变异与PAH风险之间没有因果联系。有趣的是,这种效果可能被现有药物逆转。
系统建模技术研究相关基因、蛋白质和代谢物之间可能的多重同时交互作用。例如,将扰动的基因、microRNA和蛋白质映射到交互组中,揭示了miRNA-21作为肺动脉高压的核心调节因子,突出了补体在PAH中的作用,并揭示了新的疾病途径和药物靶点。这种方法尽管仍处于早期阶段,但随着数据的增加(来自肺血管疾病表型组学等研究),展现出很大的前景。这些多组学整合的方法增加了我们对PAH的理解,并支持精准医学方法的发展。
体外功能研究对于定义变异的致病性至关重要,特别是对于错义和假定的剪接变异。这些研究为较新的PAH基因之一—GDF2(编码配体BMP9)提供了重要证据。BMP9以前体蛋白的形式合成,经过二聚化和furin切割。在体外蛋白表达研究中发现,PAH患者中发现的稀有错义变异破坏了这一切割过程,导致成熟BMP9减少。携带GDF2突变的PAH患者血浆中BMP9水平降低。门脉高压相关的PAH中的BMP9水平也降低,这一水平预测了无移植生存期。现有数据表明,相关的PAH患者具有正常的BMP9血浆水平,尽管在部分IPAH病例中BMP9水平可能降低。对于TBX4,荧光素酶报告测定被用于评估错义变异的致病性。这导致了意外发现的功能获得变异,这些变异与较晚的PAH发病年龄相关。类似类型的研究对于其他显示出较多错义变异的基因也很重要,以增强作为确定性PAH基因的证据,并更好地理解潜在的分子机制,从而指导治疗策略。此外,人工智能的进步提供了越来越准确的算法来预测错义和剪接区域变异的可能致病性(或其他性质)。
虽然外显子组和基因组测序研究在识别具有相对较高外显率的稀有变异的基因方面取得了进展,但常见遗传变异的贡献仍然滞后,主要是因为现有队列的效能不足以检测小效应。一个显著的例外是SOX17,其中既有稀有变异也有常见变异。GWAS和一项荟萃分析识别了SOX17附近的风险等位基因,这些等位基因通过调节增强子的功能改变了内皮细胞中的基因表达调控。该风险单倍型带来了小但高度显著的PAH风险增加,赔率比为1.8。转录因子SOX17在心脏发育和肺血管形态发生中发挥着重要作用,SOX17中的稀有失功能变异可能占结构性先天性心脏缺陷相关PAH病例的多达3%。识别因果遗传变异的统计能力随着队列的规模而增加。因此,像国际PAH遗传研究联盟(PAH-ICON;https://pahicon.com/)这样的举措将对于最大化队列的规模和种族多样性以进行发现和验证至关重要。为实现这一目标,采用现有标准,如GA4GH(全球基因组和健康联盟;www.ga4gh.org/)、观察医学结果伙伴关系常见数据模型(观察健康数据科学和信息学;www.ohdsi.org/)或快速医疗互操作资源,以确保表型数据使用统一的命名法,并且数据联邦允许数据聚合以增加效能。
仅依赖基因组学评估只能解释约25%的特发性PAH(IPAH)患者。随着高通量技术的进步,可以评估额外的分子维度,从而进行大规模基因表达(转录组学)分析及其通过DNA甲基化、组蛋白修饰、染色质构象和非编码RNA(表观基因组学)调控的分析,蛋白质(蛋白质组学)、脂质(脂质组学)和代谢物(代谢组学)的丰度分析,甚至最近在单细胞水平上进行分析。实际上,多组学分析现在开始识别与PAH相关的新型生物标志物和途径,有可能探索个体化治疗并改善风险分层。对359名HPAH/IPAH患者的全血转录组学分析识别了与少数基因失调相关的预后不良、中等和良好的三个亚组。对PAH和对照肺组织的转录组分析用于定义不同的内型。类似地,计算分析也被应用于定义癌症和PAH之间的差异依赖网络,以确定可能的药物重新用途。最终,将各种不同的数据形式整合到每位患者中,以应用精准医学方法将是重要的。精准医学是一种整合性的心血管疾病预防和治疗方法,考虑个体的遗传学、生活方式和暴露作为其心血管健康和疾病表型的决定因素。这种关注克服了医学中的还原主义局限性,该局限性假定所有具有相同疾病表现的患者具有共同的病理表型,因此应类似对待。精准医学将标准临床和健康记录数据与先进的泛组学(即基因组学、转录组学、表观基因组学、蛋白质组学、代谢组学、微生物组学)进行深度表型分析。这些表型数据可以在分子交互作用(交互组)网络框架内进行分析,以揭示以前未识别的疾病表型、疾病之间的关系,选择药物治疗或识别潜在的蛋白质-药物或药物-药物相互作用。
在PAH方面,精准医学的进展仅限于阐明预后和少数PAH基因相关的临床特征。要使这种精准医学方法成功,需要各种遗传驱动因素的内型。内型可以定义一种临床表型的独特病理生理机制,该机制对PAH的机制病因具有更精确的特异性,可能与致病基因具有更直接的遗传关联。例如,BMPR2杂合子携带者通常有“原发性肺动脉高压”亚型。相比之下,TBX4相关HPAH患者可能具有合并第1组和第3组PH内型,伴有气道、肺血管和骨骼异常。未来的工作应阐明基因相关的内型(内表型),整合各种组学来源的数据和复杂分析,以1)指导高风险人群的风险分层;2)增强预后评估;3)促进疾病监测;4)支持治疗选择;5)指导新治疗开发;6)协助改善联合治疗(图2)。
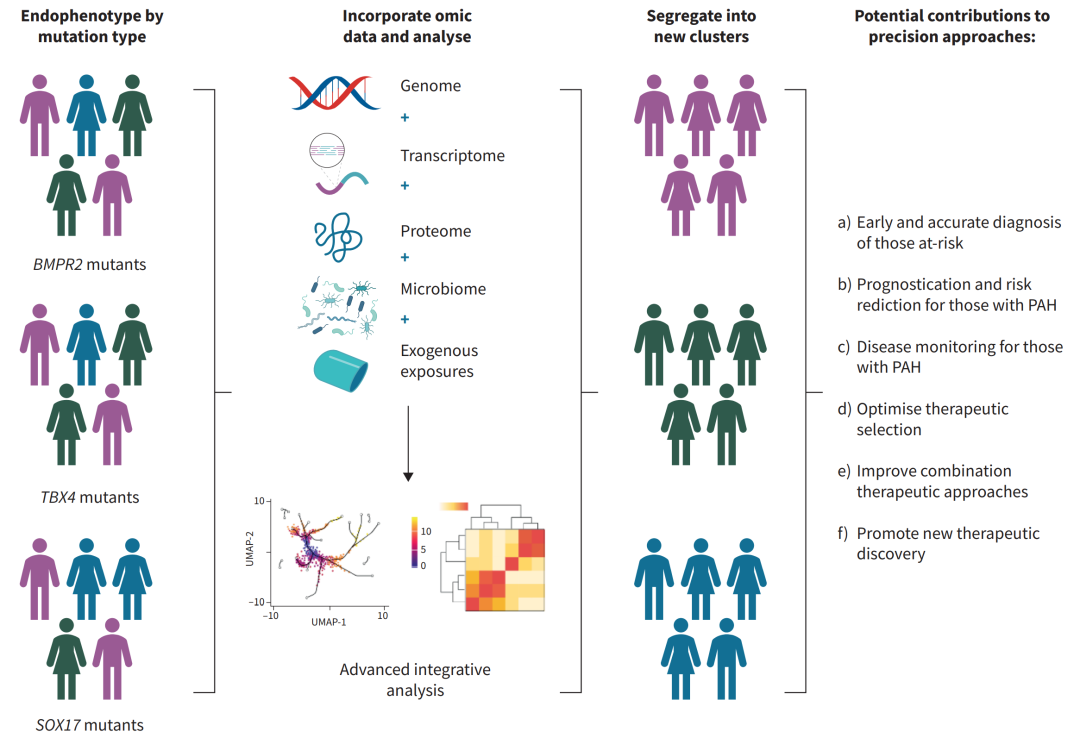
图2.优化精准医学方法的示例:该图展示了如何利用基因组信息优化对个体的精准医学方法。随着基因相关内型(内表型)的确定,这些信息可以与多种组学来源的数据(如转录组学和蛋白质组学)结合。还应考虑整合外源性影响因素,如环境或其他暴露。随后,综合分析方法可能揭示具有相似内型(包括PAH特异性突变)的个体最终被划分为不同的疾病谱系群体。尽管它们具有相似的内型,但可能在生物学上存在差异,并具有不同的疾病谱。这可能最终改善对群体及个体的精准医学方法。BMPR2:骨形态发生蛋白受体2; TBX4:T-box转录因子4; SOX17:SRY-box转录因子17.
如图2所示,将个体分为不同稀有变异的PAH特定基因组的群体只是精准方法的开始,而不是结束。应用当前和未来的组学及相关技术进一步探索每位患者的生物学变异,可能允许将患者更精确地划分为内型群体,从而更好地促进精准护理方法。
原始出处:
Genetics and precision genomics approaches to pulmonary hypertension;Eric D. Austin, Micheala A. Aldred, Mona Alotaibi, Stefan Gräf, William C. Nichols, Richard C. Trembath, Wendy K. Chung;European Respiratory Journal Jan 2024, 2401370; DOI: 10.1183/13993003.01370-2024
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#肺动脉高压# #多组学方法#
80