J diabetes:一种新兴的T1D治疗策略:靶向胰腺β细胞中的PI3K/Akt信号通路以增强其存活和功能
2022-10-24 代谢网 MedSci原创
PI3K/Akt信号通路是一个很有潜力的T1D治疗靶点,因为它对细胞存活、增殖和代谢有明显的影响。越来越多的证据表明,PI3K/Akt信号通路是决定β细胞质量和功能的关键因素。
1型糖尿病(T1D)是一种由体内的免疫细胞攻击β细胞引起的自身免疫性疾病。在80%至90%的β细胞群被破坏后,患者进入不可逆的高血糖状态,必须依靠外源性胰岛素生存。然而,胰岛素注射只能降低血糖,却无法像β细胞一样对血糖状态做出反应。胰岛移植是一种治疗方法,但是胰岛移植前后都会发生大量的β细胞死亡。因此,要预防和治愈T1D,维持β细胞的存活和代谢活性是重中之重。
PI3K/Akt信号通路是一个很有潜力的T1D治疗靶点,因为它对细胞存活、增殖和代谢有明显的影响。越来越多的证据表明,PI3K/Akt信号通路是决定β细胞质量和功能的关键因素。
近期,Journal of Diabetes期刊发表了一篇来自澳大利亚科技大学的Sheila Donnelly等研究者的综述,分析了将调控PI3K/Akt信号通路作为提高β细胞功能和存活的相关研究,总结出较有潜力的治疗方法。今天一起来看看这篇文章。

图1 文章首页
01. PI3K/Akt信号通路简介
首先,介绍一下PI3K/Akt信号通路。在细胞外有丝分裂因子的刺激下,PI3K/Akt级联反应开始,大致分为四步,如图2所示。
第一步:PI3K的激活
PI3K直接或间接地通过衔接分子(例如胰岛素受体底物蛋白)与受体结合,从而被激活。然后,活化的PI3K将磷脂酰肌醇(3,4)-双磷酸(PIP2)转化为磷脂酰肌醇(3,4,5)-三磷酸(PIP3)。
第二步:Akt的活化
之后,Akt在质膜上与PIP3结合,这时候的Akt还处于未活化状态。接下来,两个位点的磷酸化使Akt完全活化,分别是肌醇依赖性蛋白激酶1(PDK1)磷酸化的Thr308位点,以及mTOR复合物2(mTORC2)或DNA依赖性蛋白激酶(DNA-PK)磷酸化的Ser473位点。
第三步:Akt对下游靶标的作用
活化的Akt介导其各种下游靶标的抑制或刺激性磷酸化,例如叉头盒蛋白O(FOXO),糖原合酶激酶3(GSK3β),半胱天冬酶-9(caspase-9)和Bcl-2相关的死亡启动子(Bad)。
第四步:负反馈因子对PI3K/Akt通路的抑制
为防止级联反应过度进行,负反馈因子出动。具体而言,有磷酸酶和张力蛋白同系物(PTEN),可以将PIP3去磷酸化为PIP2,还有PHLPP1和PHLPP2,分别在Thr308或Ser473位点对Akt进行去磷酸化。
总的来说,PI3K/Akt信号通路受到了各种因子的严格调控,使得机体在增殖和凋亡之间实现了最佳平衡。
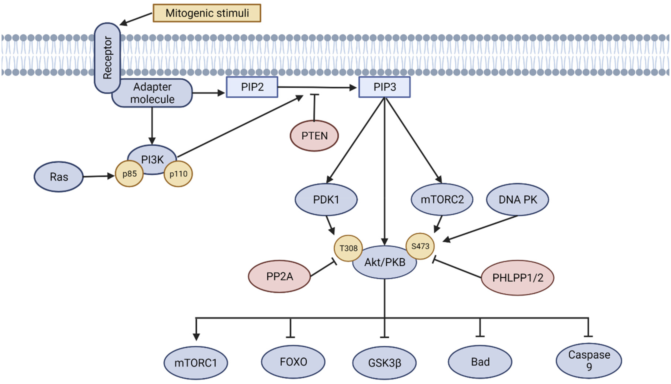
图2 PI3K/AKT信号通路机制图
02. 小鼠模型提供了PI3K/AKT信号通路调节β细胞质量和功能的证据
①CA-Akt小鼠模型
在β细胞中,表达组成性活性形式的Akt1(CA-Akt)使β细胞大小和总胰岛质量显著增加,从而改善了葡萄糖耐量。在链脲佐菌素(STZ)诱导的糖尿病中的保护作用较明显。
②CA-EGFR小鼠模型
过表达组成性活性表皮生长因子受体(CA-EGFR),使小鼠β细胞增殖率增加,改善了糖耐量,并显著抑制STZ诱导的β细胞凋亡。此外,从CA-EGFR过表达动物中分离出的胰岛对促炎细胞因子(IL-1β,TNF-α和IFNγ)的细胞毒性作用具有抗性,这些因子是T1D中β细胞破坏的主要原因。具体机制可能是CA-EGFR抑制了Bcl-2相互作用介质(BIM)。
③小鼠模型
过表达caspase-3生成的RasGAP N末端片段,简称片段N。研究表明,在非肥胖糖尿病(NOD)小鼠模型中,β细胞特异性表达片段N的小鼠与对照组相比,前者的高血糖和糖尿病进展较慢。进一步,胰岛研究表明,与对照组相比,片段N表达与凋亡β细胞数量的减少有关,这种抗凋亡作用可能是增强Ras的活性而产生的,而Ras又激活了PI3K/Akt信号传导。
④PTEN缺失小鼠模型
与上述观察结果一致,β细胞中PI3K/Akt途径的关键负调节因子PTEN的缺失也被证明可以预防STZ诱导的糖尿病。使用小鼠β细胞系β-TC-6的体外研究表明,PTEN缺失使细胞凋亡减少并部分逆转了Akt抑制。
总的来说,以上几种模型提供了令人信服的证据,表明β细胞中PI3K/Akt通路的激活有可能积极调节β细胞功能以延缓糖尿病的发展。
03. PI3K/AKT信号通路的调节因子是潜在的治疗方法
PI3K/Akt信号通路的调节因子大致可分为三类,分别是蛋白质和肽类,植物提取物和miRNA,根据相关研究,总结各因子的作用如下:

表1 蛋白质和肽类调节因子
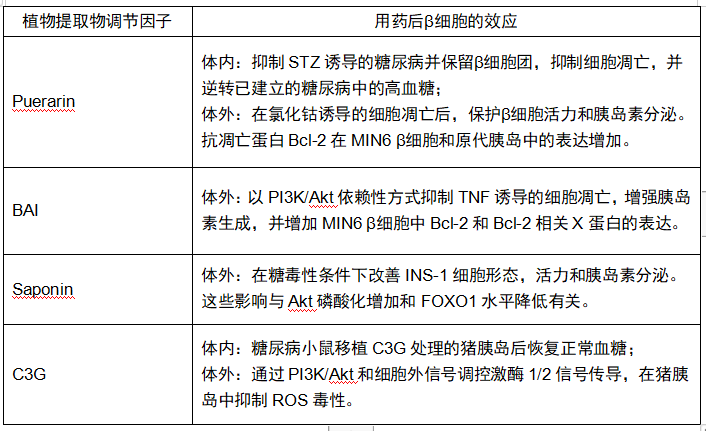
表2 植物提取物调节因子
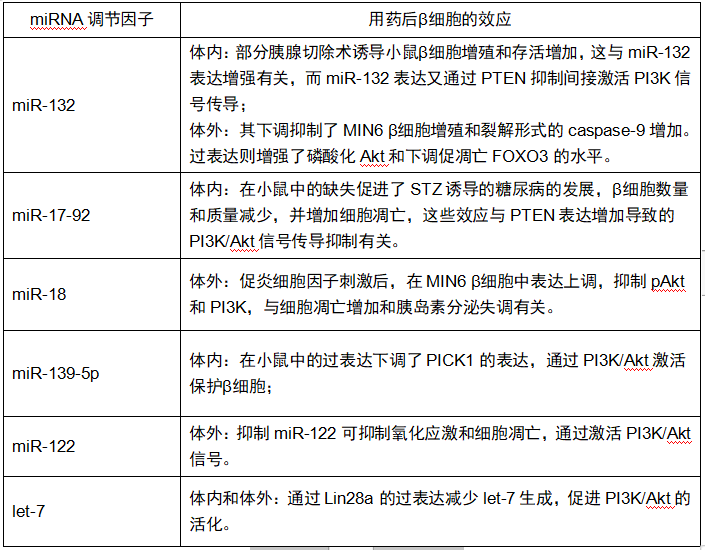
表3 miRNA调节因子
04. PI3K/AKT信号通路的调节在治疗T2D和胰岛移植方面的应用
除了T1D,还有T2D,虽然二者病因不同,但它们最终都会导致β细胞质量和功能的下降(图二)。在T1D中,β细胞丢失是由持续数月/数年的自身免疫破坏过程介导的,β细胞质量减少80%至90%。在T2D中,由于β细胞响应胰岛素抵抗而经历代偿性扩增,从而导致β细胞衰竭和死亡。此外,T2D的全基因组关联研究表明,大多数基因是β细胞质量和/或功能的调节因子。
此外,在胰岛制备期间和胰岛移植后保存β细胞质量至关重要,并且是患者广泛应用的主要临床障碍。因此,保留功能性β细胞质量的方法为T1D和T2D提供了治疗思路。表4总结了现有的一部分研究所推定的潜在治疗药物。
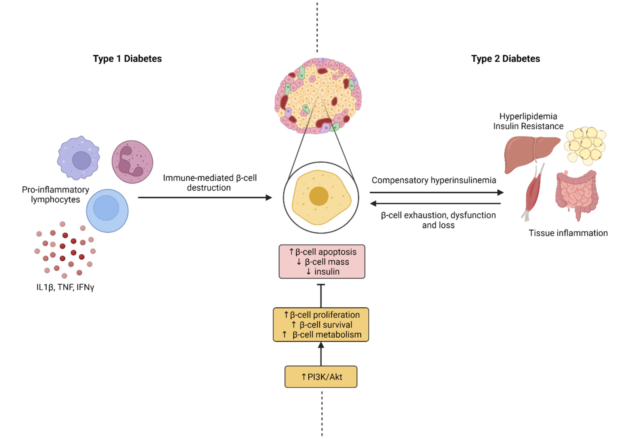
图2 T1D和T2D的发病机制
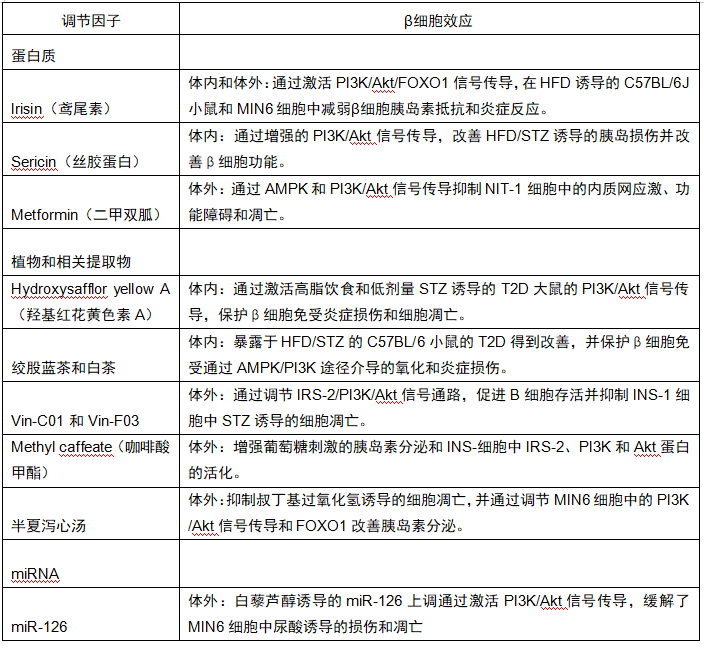
表4 PI3K/Akt通路的调节因子作为T2D的推定治疗方法
05. 结论
综上,PI3K/Akt通路是很有前途的糖尿病治疗靶点之一,不仅在T1D中至关重要,而且在T2D中也相当重要。PI3K/Akt信号通路的调节可以支持疲惫的β细胞以缓解高血糖和胰岛素抵抗。同时,在β细胞中增强PI3K/Akt信号的治疗也可以扩展到胰岛移植,以抵消在整个分离和递送过程中发生的大量β细胞死亡,然后在移植后对抗异体和自身免疫破坏。
文章链接:
https://onlinelibrary.wiley.com/doi/10.1111/1753-0407.13252
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言