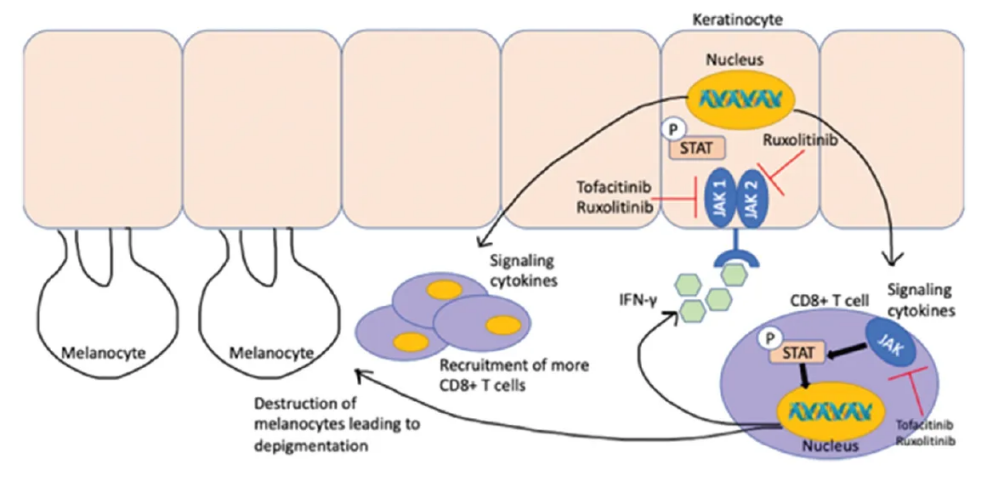
Ritlecitinib新药临床试验用于白癜风治疗
一项多中心、随机双盲、安慰剂对照的IIb期试验,评估了口服Ritlecitinib治疗活动性非节段性白癜风的有效性和安全性。
药师华子 - Ritlecitinib - 2023-08-07
新药临床试验期间药物警戒和风险控制研究六:完善新药临床试验期间药物警戒和风险控制监管体系的建议
本文从完善临床试验期间药物警戒监管体系和关键要素两个方面, 对进一步完善我国新药临床试验期间药物警戒和风险控制监管体系提岀若干建议, 供业内人士参考。
中国药事 - 药物警戒,风险控制,新药临床试验 - 2023-01-24
中国1类新药分布及临床试验概况分析
我国有近6700余个药物品种处于临床研究阶段,临床研究数目多、临床研究药物品种多。临床数目多,则是临床研究情况的表现,即药品临床;药物品种多,则是药物研发情况的表现,即临床药品。临床试验直观反映了药品的有效性及安全性,又侧面折射出药物研发的状态与进展。下面本文将对我国药品临床与临床药品(1类新药)做逐一分析:1、我国临床试验(CTR)情况研究-药品临床2013年9月6日,我国国家食品药品监督管理总
药渡 - 1类新药,临床研究 - 2018-11-01
中国新药注册临床试验进展年度报告 (2023年)
国家药监局药品审评中心对 2023 年中国新药注册临床试验现状进行全面汇总和分析,同时对近年来的变化趋势特点进行分析,运用信息化手段助力提升临床试验安全监管能力。
国家药品监督管理局药品审评中心 - 新药注册临床试验 - 2024-05-23
儿童中药新药Ⅳ期临床试验设计要点
Ⅳ 期临床试验为新药上市后应用研究阶段,是新药临床试验的一个重要组成部分,是上市前新药Ⅰ、Ⅱ、Ⅲ期临床试验的补充和延续,既可以验证上市前临床试验的结 果,也可以对上市前临床试验的偏差进行纠正,更重要的是可以弥补上市前临床试验缺乏的资料和信息,从而为临床合理用药提供依据。儿童作为特殊群体在药品开 发研制中区别于成人,通过针对儿童的临床试验,来检测药物的安全性、有效性,为儿科合理用药提供依据
药物评价研究 - Ⅳ期,临床试验,设计 - 2014-08-09
如何开展新药临床试验:从GCP,SOP到临床试验管理和质量控制
GCP的原则与内容 GCP(Good Clinical Practice),即药物临床试验质量管理规范,它是临床试验过程的标准规定,包括方案设计、组织实施、监查、稽查、记录、分析总结和报告。其目的是保证药品临床试验过程规范,结果科学可靠,保护受试者的权益并保障其安全。 一、GCP的发展过程 19世纪末化学制药工业的兴起,开创了化学药品开始用于临床治疗的新纪元。大量新药上市,一方面改善
上海交通大学医学院附属第九人民医院 - 新药,临床试验 - 2015-07-04
ASH 2018:创新药临床试验数据汇总
各大药企、生物技术公司在ASH2018大会上踊跃发布了血液病相关药物的临床数据。本文汇总盘点了百济神州、艾伯维、诺华、南京传奇、Bluebird……数家明星公司的临床试验数据。1 .百济神州百济神州在此次ASH大会上一共公布了3项临床试验研究,分别是:1. 替雷利珠单抗单药治疗R/R cHL中国患者的关
医药魔方 - ASH,创新药,临床试验 - 2018-12-06
新药临床试验方案设计的研究
新 药临床试验是药品上市前最重要的研究环节之一。新药在上市之前,需要进行I-Ⅲ期的临床试验;上市后,需进行Ⅳ期临床试验,I-Ⅳ期的临床试验是对药物的 疗效、安全性及风险效益进行科学性、真实性及可靠性的临床疗效与安全性的评价研究。I-Ⅲ期的新药临床试验的数据,需提供给国家食品药品监督管理局 (SFDA)审查,以此作为重要的依据,来决定该药上市与否。全面的、结构清晰的临床研究方案,应该包括研
中国临床药理学杂志 - 临床试验,方案 - 2014-08-09
新药临床试验中遇到的100个问题(下)
指与试验相关的原始数据被第一次记录的文件,它可以是 CRF(这种直接记录的方法须在试 验方案中注明)、试验专用的病例本、患者病例、输入计算机的数据、实验室报告、检查仪器自 动打印的图表等等,甚至是记录有试验数据的一个小纸片都应称做原始资料
佰荣泰华 - 临床试验,新药 - 2017-04-25
新药临床试验中遇到的100个问题(上)
在新药研发和临床试验过程中我们会遇到这样或者那样的问题,本文总结了100个我们在新药临床试验中经常遇到的问题,仅供大家参考! 1、什么是 GCP?GCP(Good Clinical Practice)中文译为“药品临床试验管理规范”,它是一种对涉及人类受试者的临床试验的设计、实施、记录及报告的国际性道德和科学质量标准。无论是由药厂发起或是由合同研究组织实施的临床试验,都应遵从此标准
佰荣泰华 - 临床试验,新药 - 2017-04-25
新药临床试验设计中的基础问题解读
1新药临床试验管理规范1.1受试者权益安全性保障(即伦理性) 1.临床试验必须获得国家药品监督管理局的批准 2.为确保受试者的权益,并为之提供公众保证。必须经伦理委员会批准 3.中国GCP规定参加临床试验的研究单位必须是国家药品临床研究基地 4.中国GCP规定,负责临床试验的研究者(investigator)必须具备的条件
MedSci原创 - 新药,临床试验,设计 - 2012-12-25
为您找到相关结果约500个