Gastroenterology:天津医科大学郝继辉团队揭示了改善胰腺导管腺癌的化疗耐药新机制
2024-11-27 iNature iNature 发表于陕西省
该研究低氧和酸性肿瘤微环境驱动的AVL9通过AVL9-IκBα-SKP1复合物促进胰腺导管腺癌的化疗耐药。
吉西他滨联合白蛋白-紫杉醇(AG)是治疗胰腺导管腺癌(PDAC)的关键选择。然而,对化疗的反应相对较差,耐药性发展迅速。
2024年11月18日,天津医科大学郝继辉及Zhou Tianxing共同通讯在Gastroenterology在线发表题为“Hypoxic and acidic tumor microenvironment-driven AVL9 promotes chemoresistance of pancreatic ductal adenocarcinoma via the AVL9-IκBα-SKP1 complex”的研究论文。该研究低氧和酸性肿瘤微环境驱动的AVL9通过AVL9-IκBα-SKP1复合物促进胰腺导管腺癌的化疗耐药。

PDAC是一种侵袭性很强的疾病,预后不佳。由于90%的2例患者在诊断时已失去手术机会,因此化疗仍是主要治疗方法。最近,AG被推荐为PDAC2的标准方案。然而,由于化疗耐药,对AG的反应并不令人满意。因此,迫切需要探索一种潜在的新的治疗因子来克服PDAC的化疗耐药。AVL9是酵母的胞吐基因,被证实参与细胞极性和迁移。在癌症领域,AVL9已被确定为NSCLC、ccRCC和CRC5-7的肿瘤驱动基因。然而,AVL9在PDAC中的功能、机制和翻译尚未深入研究。
PDAC具有致密纤维和缺氧微环境。HIF-1α在缺氧条件下组成性表达,可调控多种原癌基因的转录,驱动PDAC9的进展。缺氧诱导肿瘤的代谢重编程和糖酵解相关基因的过度表达已在全球70%以上的人类癌症中被发现。乳酸是糖酵解过程中最重要的代谢产物。2019年,Zhang等人首次将组蛋白赖氨酸(K)残基的乳酸衍生乳酸化(la)定义为一种表观遗传修饰,可直接刺激染色质基因的转录。乳酸酰化修饰是一种新的表观遗传密码,可以重编程细胞以获得恶性表型。
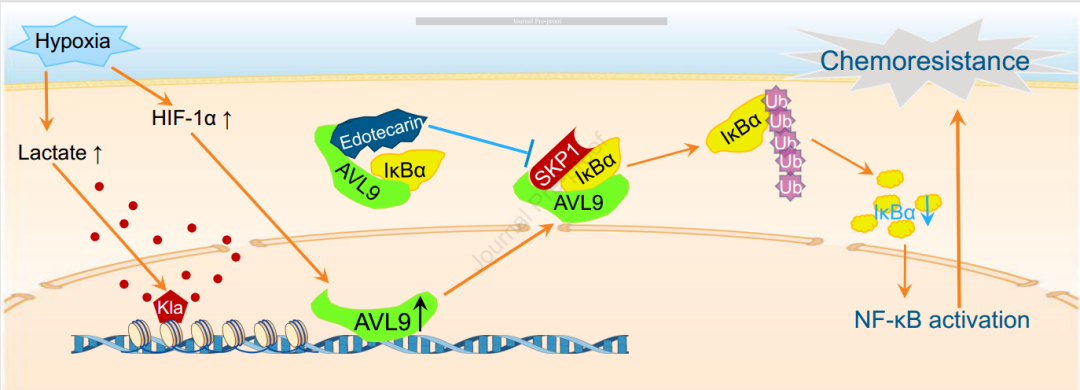
机理模式图(图源自Gastroenterology)
在这里,研究人员通过多策略筛选,确定AVL9是PDAC中AG耐药的关键靶点。其促肿瘤作用在临床队列中得到证实。机制上,HIF-1α,一个缺氧相关的转录因子,驱动了AVL9的表达。AVL9作为支架,促进IκBα与SKP1结合,导致IκBα泛素化和降解增强,进而激活NF-κB 通路。潜在的AVL9靶向抑制剂Edotecarin被证明可以逆转PDAC的AG 化疗耐药。在PDAC中,HIF1α驱动AVL9的表达。AVL9、IκBα和SKP1的物理相互作用为NF-κB通路的异常激活提供了一种新的分子机制。因此,以AVL9为靶点的药物Edotecarin可能是使PDAC对AG增敏的一种有前景的治疗策略。
参考消息:
https://www.gastrojournal.org/article/S0016-5085(24)05695-6/abstract
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















乳酸是糖酵解过程中最重要的代谢产物!
14
#胰腺导管腺癌# #化疗耐药#
17